四段式气调醇化过程不同形态烟梗的质量变化
2023-06-01李易非王道铨罗登炎常明彬王锐亮姜焕元林志平李金兰阙文豪李华杰
李易非,王道铨,何 伟,罗登炎,常明彬,王锐亮,姜焕元,林志平,李金兰,阙文豪,李华杰
福建中烟工业有限责任公司技术中心,福建省厦门市滨水路298 号 361021
传统烟梗加工工艺普遍存在醇化过程烟梗颜色加深、制梗丝过程烟梗较难回潮等问题,直接影响后续制梗丝工序加工质量和烟梗在卷烟产品中的使用。技术缺陷主要表现为:一是工艺流程复杂,设备投资大;二是制造的梗丝呈大片状,形态结构与叶丝差异较大,物理质量与卷烟产品匹配性不好;三是制造的梗丝杂气、刺激性相对凸显,感官质量存在缺陷。为了提升梗丝质量,近年各卷烟工业企业围绕烟梗压切成型工艺进行了深入研究。研究表明,改进烟梗润梗浸梗技术[1-2],改变烟梗切丝方式[3-4],优化梗丝干燥工艺参数[5-7],均能够在一定程度上提升梗丝内在质量。除了对制梗丝工序进行研究外,前端的烟梗复烤工序也有文献报道,主要集中在对不同产地、部位、年份、等级、形态烟梗的理化特性和吸湿性能等方面的研究[8-12]。目前,大多数研究均是在烟梗复烤和制梗丝环节围绕提高梗丝形态和感官质量来进行,对打叶复烤之后醇化过程中烟梗的内在质量变化研究较少。烟草原料的醇化主要包括化学变化、酶催化和微生物作用,其中微生物作用对原料内在质量的影响起至关重要的作用。已有研究表明,利用“四段式气调法”改变片烟醇化过程中氧气浓度可以改变细菌群落结构分布,明显改善片烟的感官质量,延长质量高点的保持时间[13]。高通量基因测序是检测菌群分布的重要手段,目前该方法已经在食品发酵与安全[14-15]、环境保护[16]、生态养殖[17]、医学检验[18-19]等领域广泛应用,在烟草行业也有应用研究。包可翔等[20]利用Illumina MiSeq测序平台对不同产地和部位自然醇化片烟中细菌16S rDNA 进行高通量测序分析,寻找到不同样品中的优势菌门和优势菌属;刘亭亭等[21]采用Biolog ECO代谢表型及高通量测序技术研究了赤星病发生期不同成熟度(成熟、适熟、未熟)烟叶叶际微生物代谢功能与群落结构,明确了真菌群落和细菌群落的优势菌群及丰富度与烟叶成熟度的相关性;李梅云等[23-24]对烟叶微生物发酵机理进行了研究,明确了假单胞菌属、鞘氨醇单胞菌属和芽孢杆菌属是3种优势产香菌属,假单胞菌属在烟草中的主要代谢产物为吡嗪类物质,鞘氨醇单胞菌属能够对芳香化合物降解产香,芽孢杆菌属是烟草醇化过程氨态氮和酰胺氮含量增加的关键因素。本文中以云南和福建的烟梗为研究对象,在打叶复烤过程叶梗分离后将烟梗制成片状,采用四段式气调技术进行仓储醇化,旨在探寻不同形态烟梗四段式醇化过程质量变化和制得梗丝的品质差别,为烟梗压片复烤及制丝创新工艺技术研究提供理论依据和技术支撑。
1 材料与方法
1.1 材料和仪器
试验样品为打叶后2019年云南B梗和福建C梗(长度≥20.0 mm),不同产地、两个等级的烟梗分别进行传统烤梗和制梗片复烤加工(梗片厚度约为0.8~1.5 mm,烤后烟梗含水率为11.0%),具体加工工艺流程见图1和图2。制得的梗条和梗片以50 kg为单位打包,在烟叶仓库四段式气调条件下醇化18个月,每隔3个月取样一次,取样过程中所用的取样袋、手套、剪刀等物品均经过灭菌处理。采用5点取样法,每个取样点取约500 g 样品,分别置于无菌自封袋中,-10 ℃冷库存放,具体样品编号及相关信息如表1所示。
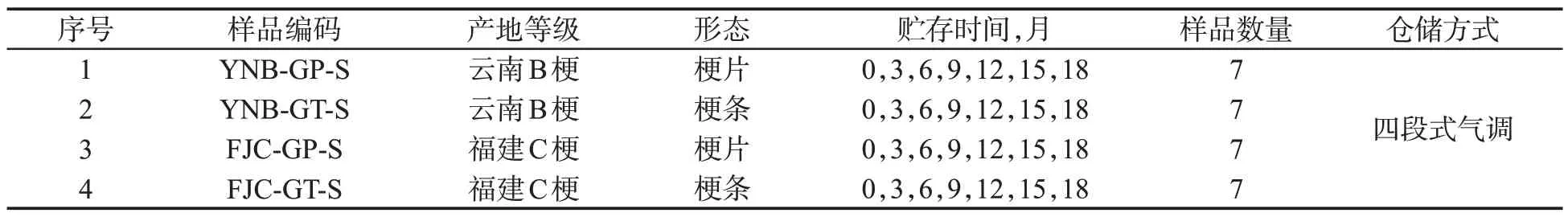
表1 烟梗样品信息表Tab.1 Information of tobacco stem samples

图1 传统烤梗工艺流程Fig.1 Technological process of traditional tobacco stem redrying

图2 制梗片复烤工艺流程Fig.2 Technological process of tobacco stem redrying in flake shape
仪器:7890/5975 气相色谱-质谱联用仪(美国Agilent 公司);MINOLTA-CR-410 型色彩色差计(日本Konica公司);ML204/02分析天平(感量0.000 1 g、瑞士Mettler Toledo公司)。
1.2 方法
1.2.1 仓储养护方法
在四段式气调贮存条件下,对云南B梗和福建C梗的梗条和梗片进行18个月的跟踪取样。四段式气调技术参数如表2所示。
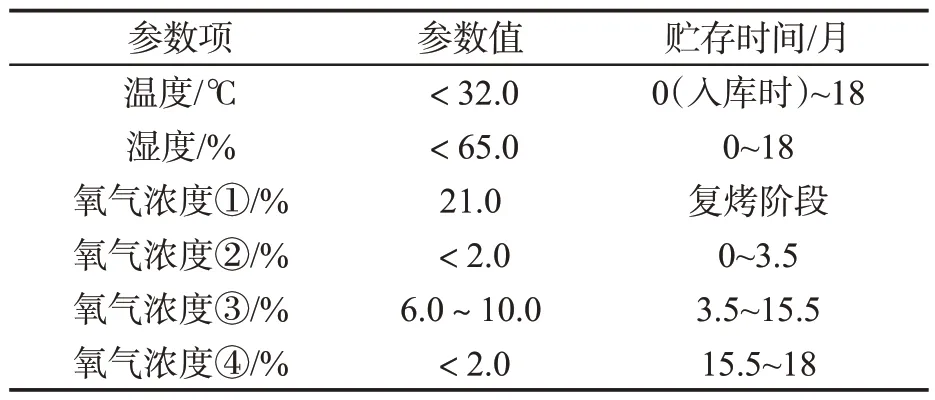
表2 四段式气调技术参数Tab.2 Technical parameters of a four-stage controlled atmosphere aging technology
1.2.2 色差值检测
取不同醇化时间的梗条和梗片各100 g,均匀铺洒于托盘内(20 cm×20 cm),用标准比色卡(CR-43,日本Konica公司)进行零点校准,分别在托盘的4个角和中心点位置进行样品色度的检测,记录各点样品色差值△E,计算△E的均值。
1.2.3 含水率检测
取色差值检测后样品50 g,按照YC/T 31—1996《烟草及烟草制品 试样的制备和水分测定 烘箱法》对烟梗进行破碎,检测样品含水率。
1.2.4 烟梗感官质量评价
分别将梗条和梗片制成梗丝,卷制成烟支,参照YC/T 415—2011 标准[22]进行感官评吸,评吸人员不少于5 人。感官质量总分=香气特性+烟气特性+口感特性,其中,香气特性=香气质+香气量+透发性+杂气,烟气特性=浓度+劲头+细腻程度+成团性,口感特性=刺激性+干燥感+干净程度+回甜。单项感官评价指标满分为9分,最小计分单位为0.5分。
1.2.5 细菌群落高通量测序
1.2.5.1 基因组DNA提取
使用事先经湿热灭菌处理的剪刀将各样品剪成小片,使用OMEGA Soil DNA Kit 试剂盒(美国Omega 公司)提取样品基因组DNA,使用Quabit 2.0(美国Life公司)测量DNA浓度,确保提取了足够数量的高质量基因组DNA。
1.2.5.2 PCR扩增
扩增区域为细菌16S rRNA基因的“V3-V4”区。引物:PCR正向引物(5'-CCTACGGGGNGGCWGCAG-3')和PCR反向引物(5'-GACTACHVGGTATCTATCC-3')。反应体系:模板DNA(10 ng/μL)2 μL;PCR正向引物(10 μmol)1 μL;PCR 反向引物(10 μmol)1 μL;2×KAPA HiFi Hot Start Ready Mix 15 μL,用dd H2O补足至30 μL。反应条件:95 ℃预变性3 min,先执行5个热循环(95 ℃变性30 s,45 ℃退火30 s,72 ℃延伸30 s),再执行20个热循环(95 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s),最终在72 ℃再延伸5 min。在TBE缓冲液中,使用1%(质量浓度)琼脂糖凝胶电泳检查PCR产物,使用溴化乙锭染色,并在紫外光下观察。
1.2.5.3 MiSeq测序
样本送到上海生工生物股份有限公司,采用通用Illumina 接头和标签进行文库构建,使用AMPure XP 磁珠试剂对样本进行目标片段的纯化,并利用Illumina MiSeq高通量测序平台进行细菌16S rDNA测序。
1.2.5.4 数据处理与分析
测序下机的双端序列数据,通过cutadapt去除接头序列,根据PE reads 之间的overlap 关系使用PEAR 将成对reads 拼接成一条序列。根据barcode序列和引物序列从拼接后的数据中拆分出各样本的数据,并使用PRINSEQ切除序列尾部质量值20以下的碱基,过滤含N 序列和短序列(200 bp 以下)。按照97%相似性对序列进行OTU 聚类,在聚类过程中去除嵌合体,得到OTU的代表序列。将所有优化序列比对至OTU代表序列,选出与代表序列相似性在97%以上的序列,生成OTU表格。细菌使用RDP数据库对不同OTU代表序列进行物种注释,真菌使用unite 数据库进行注释。使用OTU 表格和物种丰度表进行α/β多样性及其他下游分析。
2 结果与讨论
2.1 不同形态烟梗醇化过程含水率和颜色变化
经检测分析,由表3可知,在四段式醇化过程中,两种形态的烟梗含水率均略有增加,梗条含水率增加0.95百分点,梗片增加0.47百分点,梗片较梗条含水率波动小。由图3可知,云南B梗的色差值较福建C 梗小,颜色浅,在醇化过程中,梗条和梗片的颜色均逐渐转深,其中,云南梗条样品的△E极差为4.53,梗片样品的△E极差为2.39,福建梗条样品的△E极差为2.75,梗片样品的△E极差为1.03,由极差值可知,在四段式贮存条件下,云南B梗和福建C梗的梗条颜色转深程度及速率均大于梗片,颜色转深对梗丝与叶丝的外观配伍有不良的影响。因此,在四段式醇化条件下,梗片醇化过程含水率和颜色较稳定,色差值变化小,转深速率较低。
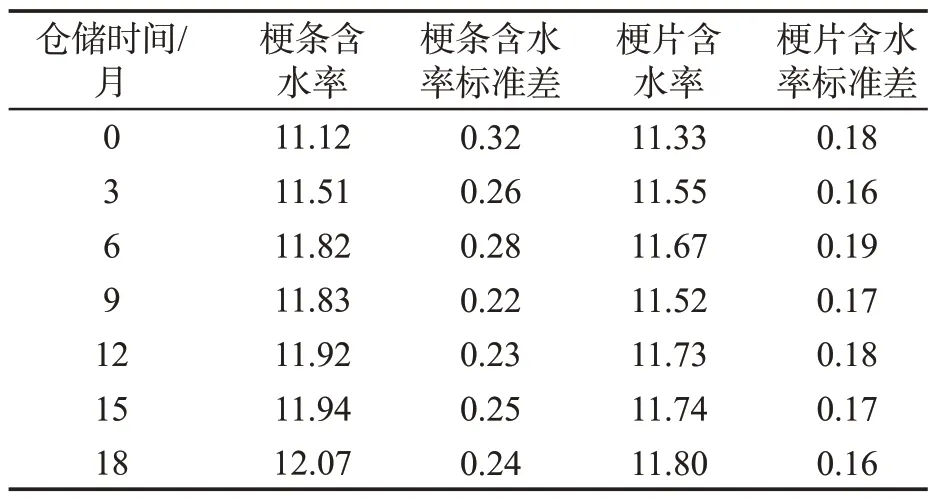
表3 不同形态烟梗在四段式醇化过程中含水率变化Tab.3 Changes in moisture content of tobacco stems by shapes during four-stage controlled atmosphere aging(%)
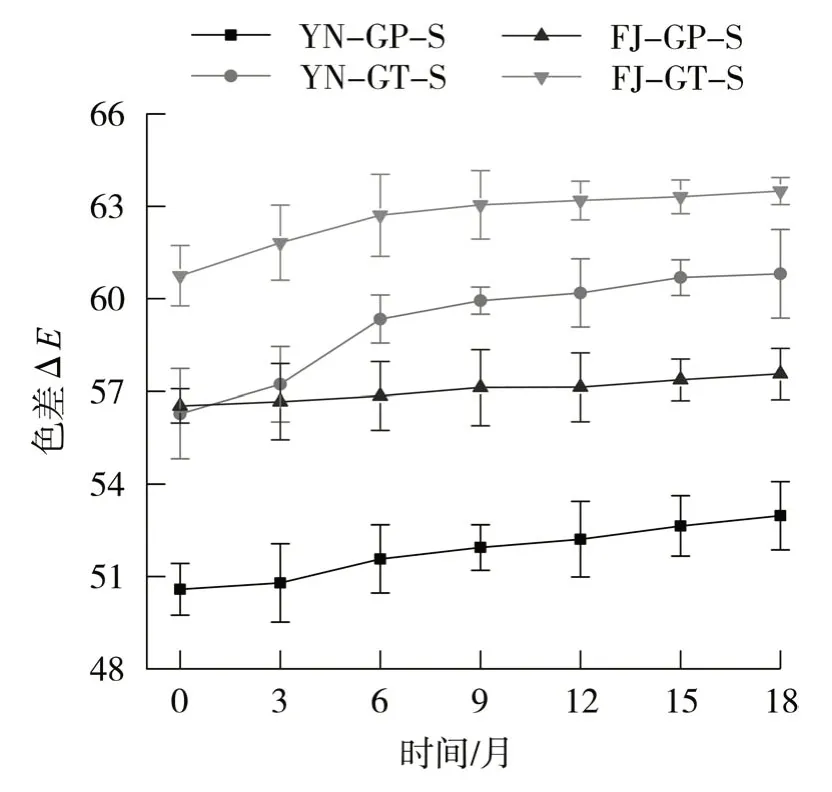
图3 不同形态烟梗在仓储醇化过程中的色差变化Fig.3 Changes in color difference of tobacco stems by shapes during storage and aging
2.2 不同形态烟梗醇化过程中表面细菌群落结构分析
2.2.1 测序结果α多样性分析
由表4可知,云南B梗和福建C梗在四段式气调贮存过程中梗片和梗条的12个样品获得了45 599~59 534 条优质序列(reads),获得的细菌OTU 数为117~544个。云南B梗的梗片和梗条在贮存过程中的OTU 总数分别为297/261(6 个月)、544/117(12 个月)、478/359(18 个月)。福建C 梗的梗片和梗条在贮存过程中的OTU 总数分别为359/120(6 个月)、190/191(12个月)、485/161(18个月)。为了解云南B梗和福建C梗的梗片、梗条分别贮存6~18个月细菌群落的共性和特性,将云南B 梗和福建C 梗样品OTU 数据合并后,进行韦恩图分析(图4),由图4 可知,云南B 梗的梗片和梗条在贮存过程中独有的OTU 数分别为48/34(6 个月)、251/7(12 个月)、161/85(18 个月),福建C 梗的梗片和梗条在贮存过程中独有的OTU 数分别为53/2(6 个月)、4/3(12 个月)、147/7(18个月)。以上结果表明云南B梗和福建C梗梗片贮存OTU 总数和独有OTU 数在6 个月、12 个月、18个月大于梗条贮存。
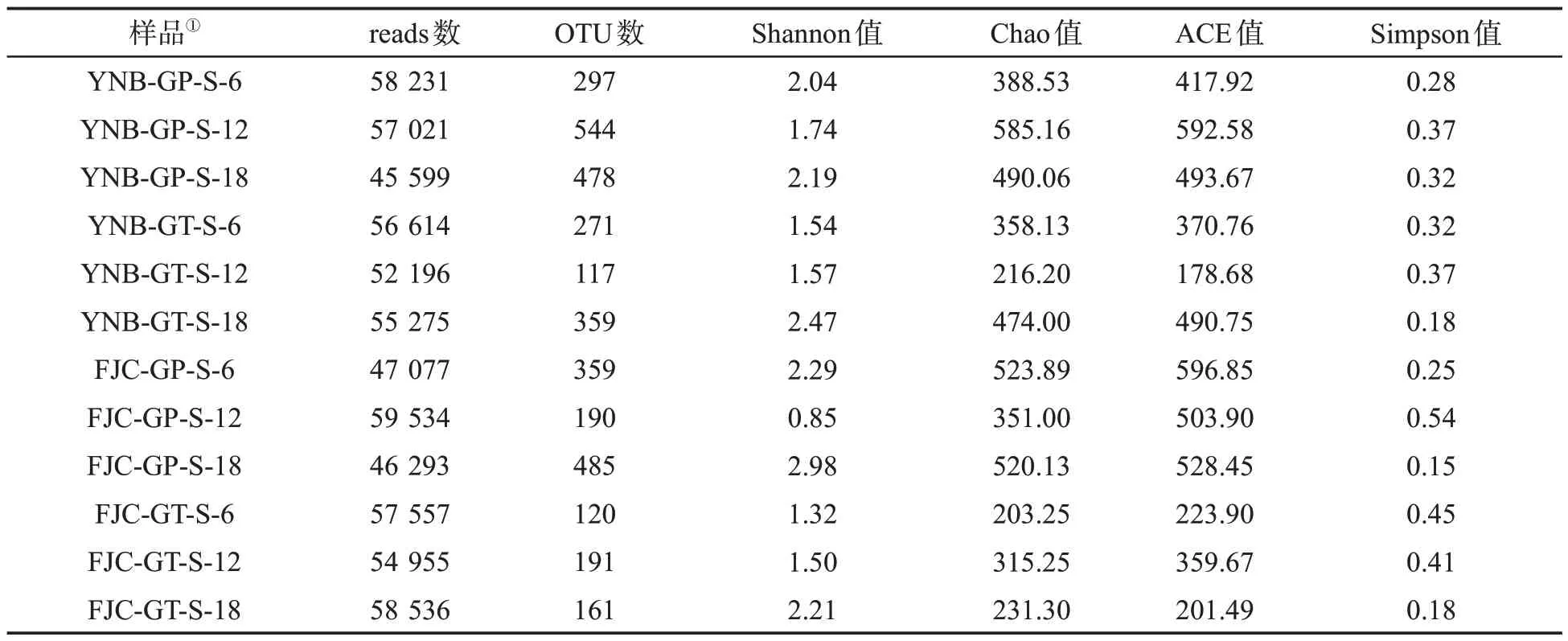
表4 测序结果reads、OTU、多样性指数数据Tab.4 Sequencing reads,OTU and diversity index data
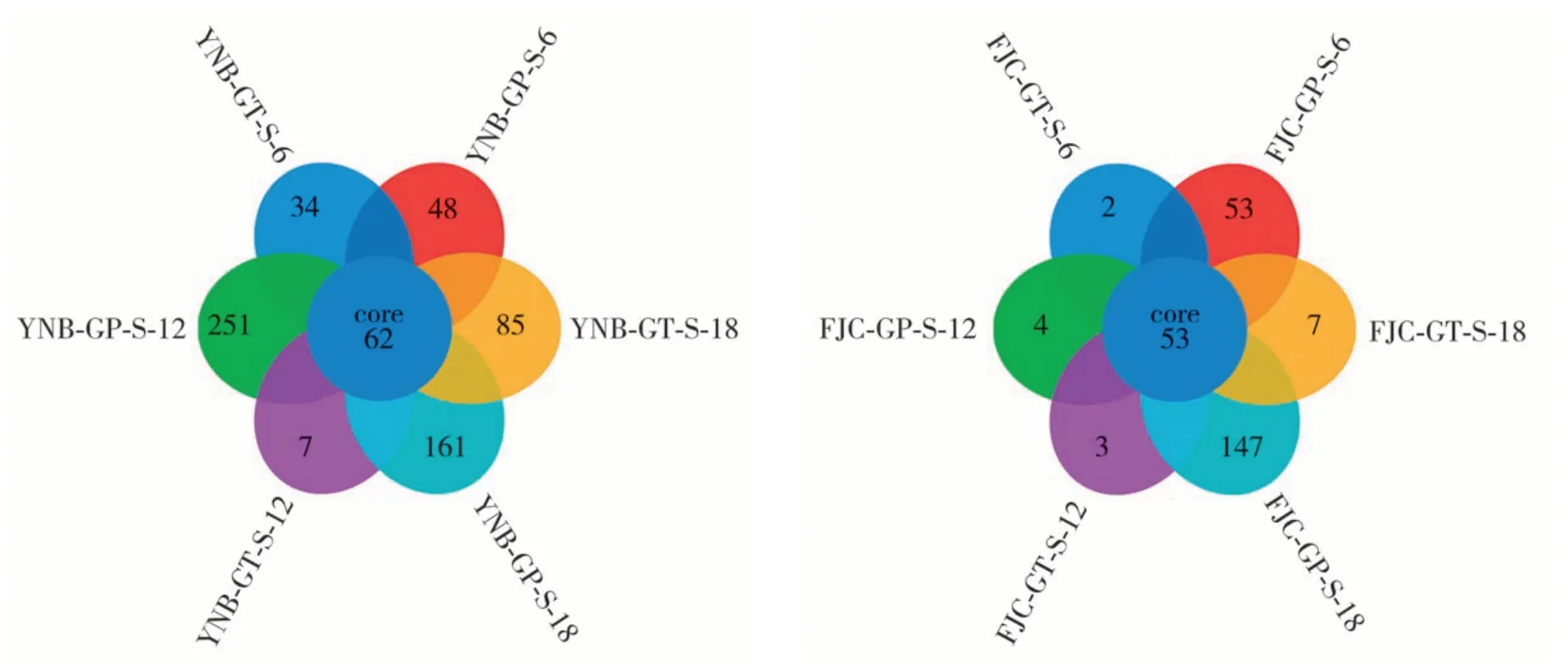
图4 云南B梗和福建C梗梗片、梗条贮存不同时间细菌OTUs分布韦恩图Fig.4 Wayne diagrams of OTU distribution of flake-shaped and bar-shaped Yunnan B stems and Fujian C stems stored for different periods
由图5可以看出,云南B梗和福建C梗梗片贮存6~18个月的Chao值和ACE值的平均值均大于梗条贮存。
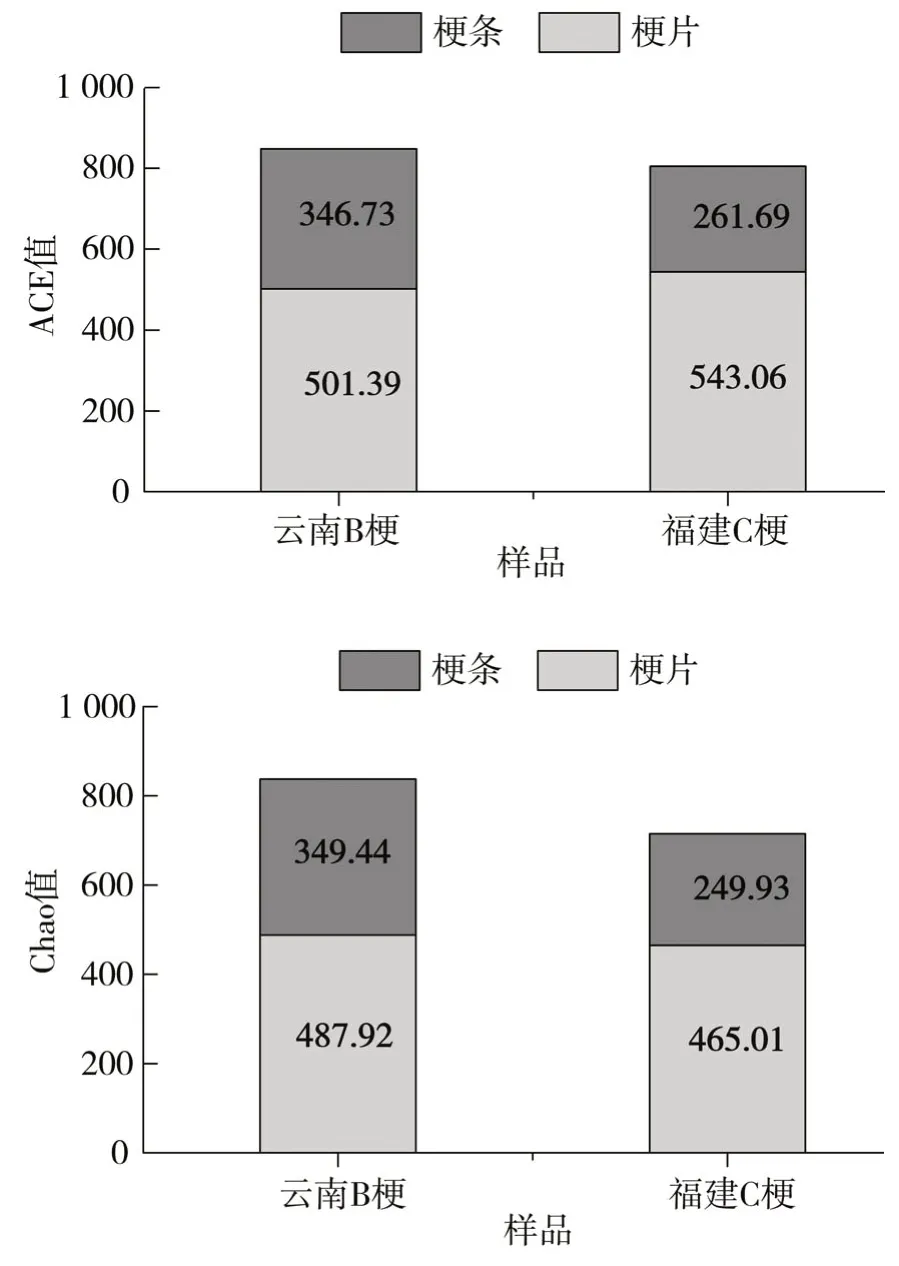
图5 云南B梗和福建C梗贮存6~18个月的Chao值和ACE值均值Fig.5 Average Chao values and ACE values of Yunnan B stems and Fujian C stems stored for 6-18 months
综上,在四段式醇化条件下,梗片醇化6~18 个月的OTU 数、Chao 值和ACE 值的平均值均大于梗条,细菌群落丰度高于梗条。
2.2.2 门、属水平细菌群落结构差异分析
图6、图7分别为云南B梗和福建C梗12份样品门、属水平细菌组成。由图6可知,云南和福建12份梗片、梗条样品的细菌群落主要归属于4个门,分别为变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria),变形菌门为12 份烟梗样品的优势菌门。云南B梗和福建C梗变形菌门平均占比超过60%(云南B梗62.43%,福建C梗71.28%)。
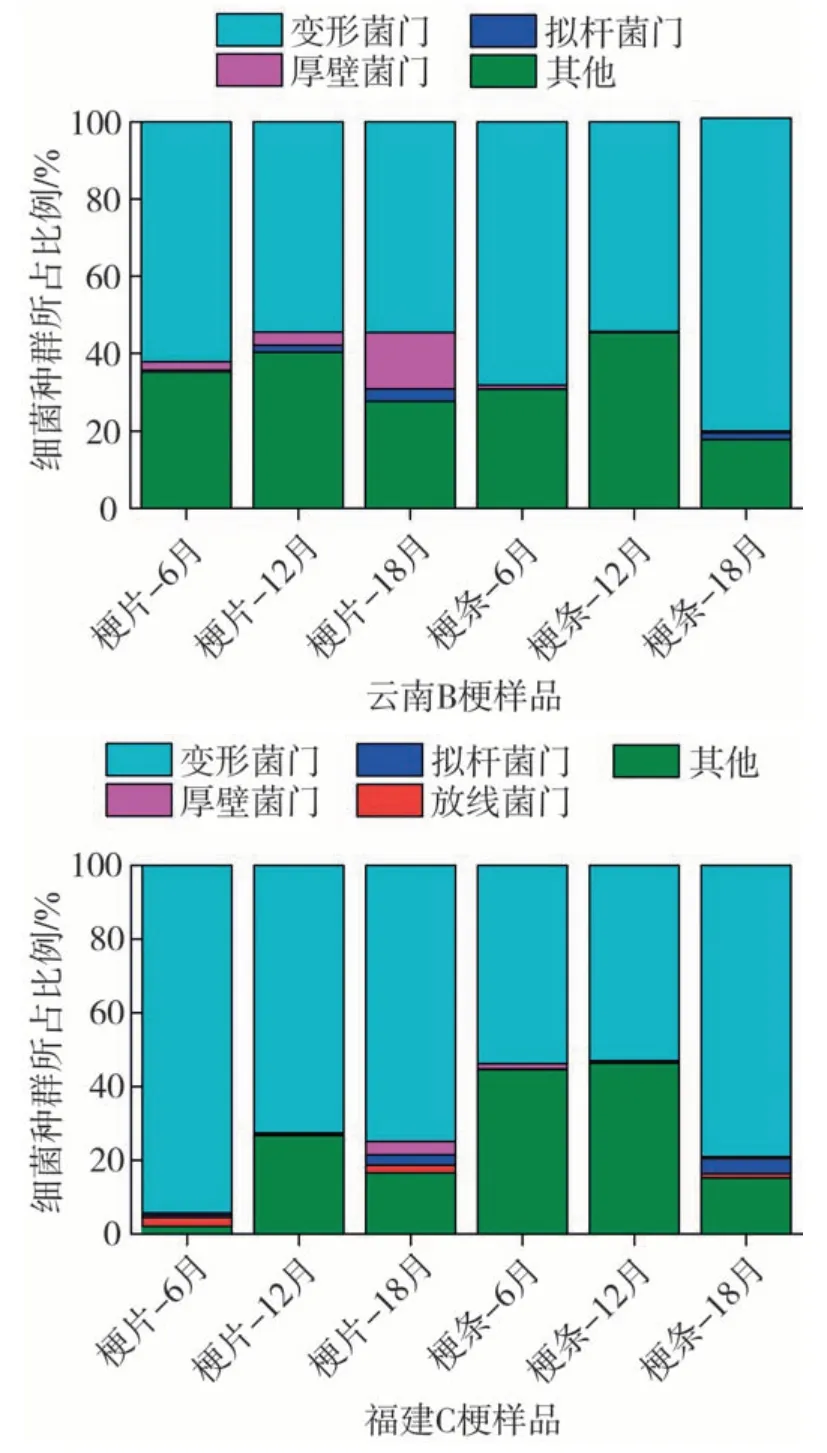
图6 云南B梗和福建C梗12份样品门水平细菌组成Fig.6 Bacterial composition(phylum level)of 12 samples of Yunnan B stems and Fujian C stems
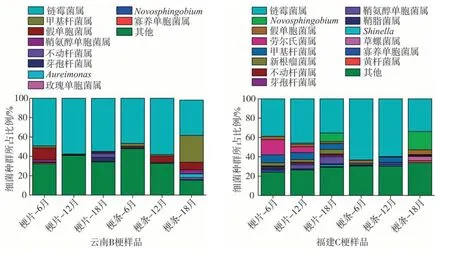
图7 云南B梗和福建C梗12份样品属水平细菌组成Fig.7 Bacterial composition(genus level)of 12 samples of Yunnan B stems and Fujian C stems
由图7 可知,在能鉴定至属水平的菌属中,云南B梗含有的主要菌属(6个样品平均占比≥1%)有链霉菌属(Streptomyces)(50.48%)、甲基杆菌属(Methylobacterium)(5.74%)、假单胞菌属(Pseudomonas)(4.86%)和鞘氨醇单胞菌属(Sphingomonas)(1.64%)4 种,福建C 梗的主要菌属(6 个样品平均占比≥1%)为链霉菌属(46.11%)、新鞘氨醇杆菌属(Novosphingobiumsilvae)(4.91%)、甲基杆菌属(4.86%)、劳尔氏菌属(Ralstonia)(3.68%)、假单胞菌属(2.71%)、鞘氨醇单胞菌属(2.63%)和新根瘤菌属(Neorhizobium)(1.79%)7 种。链霉菌属、甲基杆菌属、假单胞菌属、鞘氨醇单胞菌属是云南B 梗和福建C 梗共有的优势菌属,福建C 梗的属水平群落结构较云南B 梗丰富。芽孢杆菌属(Bacillas)、假单胞菌属和鞘氨醇单胞菌属是梗片的优势菌属。链霉菌属主要分布于含水量较低、有机质含量丰富的中性或微碱性土壤中,烟梗是烟叶的农副产品,因此其在菌属中占比较高;芽孢杆菌属可消除烟叶青杂气、降低刺激性,被认为是在醇化过程中的有益菌属[23-24],其在梗片贮存过程中的占比明显大于梗条贮存,云南B 梗和福建C 梗的梗片在6~18 个月的平均占比分别为3.53%和3.07%,而在梗条贮存6~18 个月时的平均占比分别为1.08%和1.27%;假单胞菌属在烟草中的代谢产物主要为吡嗪类物质,该类物质是烟草抽吸的重要香味成分前体物之一,鞘氨醇单胞菌属是芳香化合物好氧降解过程最关键的酶,可以在芳香化合物中不断生长[23-24],梗片贮存过程各取样时间点假单胞菌属和鞘氨醇单胞菌属占比均高于梗条,云南B 梗和福建C 梗梗片假单胞菌属在6~18 个月平均占比为2.68%和2.53%,梗条平均占比为0.86%和0.77%,梗片鞘氨醇单胞菌属在6~18 个月平均占比为1.48%和1.23%,梗条平均占比为0.12%和0.27%,这将促进梗片有利香味成分的生成,加快醇化进程,更快到达感官质量高点。
2.3 醇化后梗片和梗条所制梗丝的感官质量对比
四段式醇化条件下,梗条和梗片制成的梗丝感官质量评价结果见表5。结果表明,梗片制得的梗丝感官质量综合得分高于在相同贮存时间下梗条制得的梗丝。其中,云南梗片所制梗丝的最高分为51.5分,梗条所制梗丝的最高分为51.0分;福建梗片所制梗丝的最高分为50.5 分,梗条所制梗丝的最高分为50.0 分。梗片所制梗丝的杂气、刺激和干净程度等指标优于梗条。同时,云南梗片达到感官质量高点的贮存时间为9个月,梗条为15个月;福建梗片达到感官质量高点的贮存时间为6个月,梗条为12个月,表明梗片的醇化速率较梗条快,这与梗条和梗片的微生物群落分析中3 种优势产香菌属的梗片占比较高的规律是一致的。
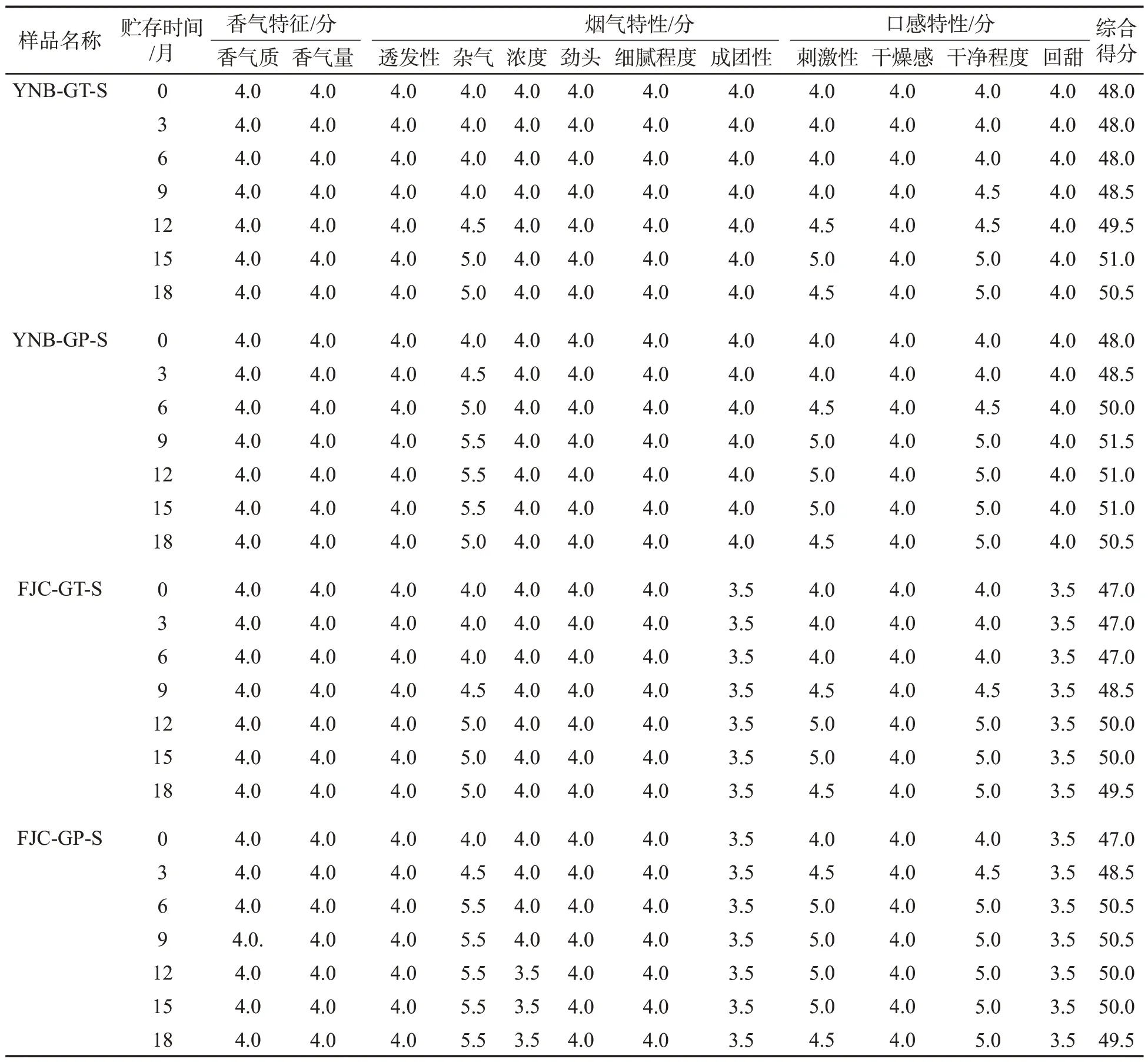
表5 梗条和梗片不同贮存时间的感官质量对比Tab.5 Sensory quality scores of bar-shaped and flake-shaped tobacco stems stored for different periods
3 结论
在四段式醇化过程中,①两种形态的烟梗含水率均略有增加,梗条含水率增加0.95百分点,梗片增加0.47百分点,梗片较梗条含水率波动小;梗条和梗片的颜色均逐渐转深,贮存18个月梗片的色差值极差小于梗条,梗条颜色转深程度及速率均大于梗片。因此,在四段式醇化条件下,梗片醇化过程含水率和颜色较稳定,色差值变化小,转深速率较低。②梗片四段式醇化过程不同形态烟梗的细菌群落优势菌门均为变形菌门,云南B 梗和福建C 梗共有的优势菌属为链霉菌属、甲基杆菌属、假单胞菌属和鞘氨醇单胞菌属4 种,梗片醇化6~18 个月的OTU 数、Chao值和ACE值的平均值均大于梗条,细菌群落丰度高于梗条,其中假单胞菌属、鞘氨醇单胞菌属和芽孢杆菌属3种优势产香菌属含量高于梗条,这对烟梗贮存过程品质改善起有利作用,加快梗片醇化进度。③在烟梗四段式气调技术醇化过程中,梗片较早出现感官质量高点,醇化后采用梗片投料制得的梗丝感官质量明显优于梗条制得的梗丝,主要表现在杂气降低、刺激性减弱、口腔残留较少。综上所述,烟梗适宜采用梗片形态在四段式醇化条件下贮存,有利于提高烟梗含水率和颜色的稳定性,增加优势菌属丰度和有益菌属占比,缩短醇化周期,改善制得梗丝的感官质量,起到降本增效的作用。
