非酒精性脂肪性肝病患者血清ALT、AST 与肝纤维化的关系
2023-05-31王艳红
王艳红
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是临床上除了饮酒原因导致的肝细胞内脂肪过度沉积的其余已确定因素所引发的一系列病理综合征,其中尤以肥胖为主的代谢综合征最多,每年我国NAFLD 的发生率都在递增,现在已经达到约25.00%。现代临床研究发现NAFLD 能够显著诱发肝硬化,甚至肝恶性肿瘤,而且还参与其他慢性肝病的恶化,并且有诱发动脉粥样硬化和2 型糖尿病的风险,严重影响人民群众的健康和生活。临床上有大约60%的NAFLD 患者病情没有显著恶化趋势,但肝纤维化还是会发生在一部分NAFLD 患者身上,因此如何及早诊断和治疗NAFLD 肝纤维化就是现在临床医师的主要任务和责任。检验学上通过肝细胞活检是诊断肝纤维化的标准方法,但是由于要对患者进行一定程度的侵入操作,会对患者造成身体和精神负担,临床上采用的人数相对较少。由于分子生物学的不断发展,对NAFLD的研究也在显著进步,已经可以通过血清学标志物预测NAFLD 的病情发展情况。血清丙氨酸氨基转移酶(alanine aminotransferase,ALT)和天门冬氨酸氨基转移酶(aspartate aminotransferase,AST)为临床上用来评估肝功能的血清学标志物。现阶段的研究[1]证实,肝功能中的血清学标志物可以较准确评估NAFLD 患者出现肝纤维化的风险,对此本研究选择86 例NAFLD 患者作为研究对象,分析NAFLD 患者血清ALT、AST 与肝纤维化的关系。现报告如下。
1 资料与方法
1.1 一般资料 选择2019 年7月~2021 年7月本院收治的86 例NAFLD 患者作为研究对象,根据影像学检查结果分为无肝纤维化组(59 例)、肝纤维化组(27 例)。无肝纤维化组中女28 例,男31 例;年龄40~86 岁,平均年龄(62.78±9.34)岁;病程1~7 年,平均病程(5.7±1.7)年。肝纤维化组中女11 例,男16 例;年龄42~83 岁,平均年龄(64.13±8.59)岁;病程1.0~6.4 年,平均病程(5.3±1.5)年。两组患者性别、年龄等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 诊断标准 符合2018 年修订的《非酒精性脂肪性肝病防治指南》[2]诊断NAFLD 的标准。
1.3 纳入标准 ①没有大量饮酒史;②没有其他的代谢或遗传病;③通过肝脏超声诊断未患有脂肪肝;④患者及家属均了解此次试验目的,并签署知情同意书。
1.4 排除标准 ①患有各种病毒性肝炎疾病;②因药物或自身免疫导致的肝炎;③患有严重的贫血,或血液系统疾病;④处于妊娠期或哺乳期女性;⑤患有糖尿病、循环系统疾病。
1.5 方法 ①血清ALT、AST 水平及肝纤维化指标检测:患者入院后采集清晨空腹静脉血,用离心机以4000 r/min 速度离心,提取血清,冷藏保存,统一检测血清ALT、AST 水平和透明质酸酶(hyaluronidase,HA)、层粘连蛋白(laminin,LN)、Ⅲ型前胶原(procollagen type Ⅲ,PCⅢ)等肝纤维化相关指标水平。②临床诊断肝纤维化方法:通过B 超定位,对患者进行穿刺,取肝组织进行活检,通过《肝纤维化中西医结合诊疗共识意见》[3]的要求对标本进行评价,S0 期为没有发生肝纤维化,S1~S2 期为轻度肝纤维化,S3~S4 期为重度肝纤维化。③一般生化指标测量:测量患者的总胆固醇(total cholesterol,TC)、低密度脂蛋白胆固醇(low density lipoprotein,LDL-C)、甘油三酯(total glyceride,TG)等血脂指标以及空腹血糖(fasting blood glucose,FBG)水平。
1.6 观察指标 比较两组患者血清ALT、AST 及肝纤维化指标(HA、LN、PCⅢ)水平,分析NAFLD 患者肝纤维化的影响因素,分析NAFLD 患者血清ALT、AST与肝纤维化的相关性。
1.7 统计学方法 采用SPSS20.0 统计学软件对研究数据进行统计分析。计量资料以均数±标准差(±s)表示,采用t检验;计数资料以率(%)表示,采用χ2检验;影响因素采用二元Logistic 回归;相关性采用Pearson 相关分析。P<0.05 表示差异具有统计学意义。
2 结果
2.1 影响NAFLD 患者肝纤维化的单因素分析 肝纤维化组患者血清FBG、ALT、AST、HA、LN、PCⅢ水平均明显高于无肝纤维化组,差异具有统计学意义(P<0.05)。两组患者血清TC、LDL-C、TG 水平比较差异无统计学意义(P>0.05)。见表1。
表1 影响NAFLD 患者肝纤维化的单因素分析(±s)

表1 影响NAFLD 患者肝纤维化的单因素分析(±s)
注:与无肝纤维化组比较,aP<0.05
2.2 影响NAFLD 患者肝纤维化的二元Logistic 回归分析 以NAFLD 患者是否发生肝纤维化为因变量(肝纤维化=1、无肝纤维化=0),血清ALT、AST、FBG(均以实际值为准)为自变量,进行二元Logistic 回归分析,结果显示血清ALT、AST 水平是NAFLD 患者肝纤维化的影响因素(P<0.05)。见表2。

表2 影响NAFLD 患者肝纤维化的二元Logistic 回归分析
2.3 NAFLD 患者血清ALT、AST 水平与肝纤维化指标的相关性分析 Pearson 相关分析显示:NAFLD 患者血清ALT、AST 水平与LN、PCⅢ均呈明显正相关(P<0.05),但与HA 水平无明显相关性(P>0.05)。见表3。
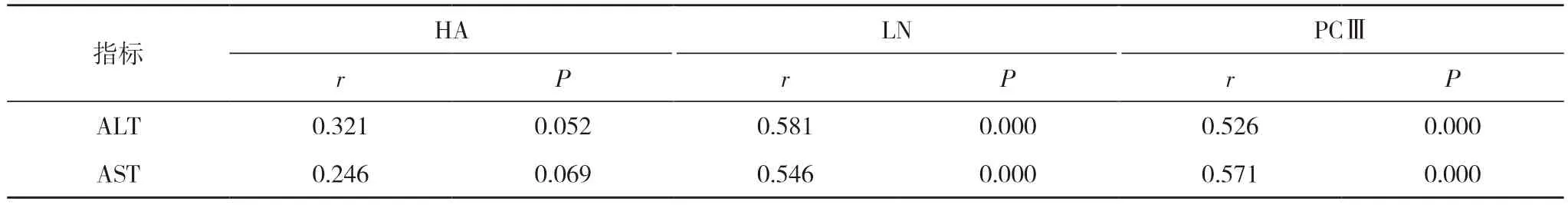
表3 NAFLD 患者血清ALT、AST 水平与肝纤维化指标的相关性分析
3 讨论
NAFLD 是临床上将除饮酒原因以外导致肝细胞内脂肪过度沉积的其余已确定因素所引发的一系列病理综合征。其发生的诱因和遗传相关性、胰岛素抵抗关系密切,属于内因导致的代谢性肝细胞受损。NAFLD除了有单纯性的脂肪肝,还有非酒精性脂肪性肝炎,并包括其导致的肝硬化[4-6]。现代社会肥胖已经成为世界性疾病,而其导致的代谢障碍性疾病逐年增多,NAFLD 现在已成为欧美等发达国家及我国富裕地区慢性肝病的重要病因。普通人群NAFLD 的患病率在10%~30%之间,其中10%~20%为非酒精性脂肪性肝炎;而非酒精性脂肪性肝炎的患者10 年内肝硬化的发生率是比较高的,高达25%,所以临床上需要高度重视[7-9]。
NAFLD 可显著诱发严重肝硬化,甚至是肝脏相关的恶性肿瘤;同时还可以增加其他肝病的病情发展,并且有诱发动脉粥样硬化和2 型糖尿病的风险,严重影响人民群众的健康和生活[10-12]。因此,NAFLD 已经是当前医学领域的新挑战。近期内。NAFLD 对人体的危害将不断增加,临床上要积极的通过腹部B 超的诊断来提高检出率。同时通过指导患者的饮食运动控制疾病的发生。通过药物、饮食、运动联合,达到明显的治疗作用。相关文献[4]显示:NAFLD 患者患有肝纤维化和肝硬化的几率显著增加,一般是健康人群的5~7 倍,其中更是有40%~50%的NAFLD 患者会因肝癌或肝功能衰竭而死亡。一般情况下大部分急慢性肝损伤都会导致肝纤维化,属于肝硬化的早期病变,其病理特点主要是脂肪颗粒大量沉积在细胞外间质,但其是一种可逆性的病理变化,所以如果及早发现NAFLD患者出现肝纤维化并采取措施,就会对患者的病情发展和转归产生积极影响[13-15]。一般肝纤维化患者并没有明显的不适症状和体征,仅能够通过影像学技术明确诊断,虽然肝细胞病理检查是诊断肝纤维化的最可靠方式,但是对患者的损害也较大,患者的接受度不高,所以找寻一种既可靠准确又安全简单的检测方法,并能最大程度的及早发现NAFLD 患者肝纤维化,就成为临床医师的重要任务。
ALT、AST 是代表肝功能的血清标志物,HA、LN、PCⅢ是可以准确体现肝细胞纤维化程度的实验室指标。ALT 大量包含在肝脏和心脏细胞中,如果肝脏细胞出现损伤,其血清ALT 水平就会显著上升。AST 水平在健康人群中比较低,但是如果肝细胞受损后,AST 水平就会显著上升。临床证明,NAFLD 患者都有部分肝脏组织受到损害[16-18]。HA、LN、PCⅢ水平可以比较准确地评估患者出现肝纤维化的几率[19]。此次研究发现肝纤维化患者的血清ALT、AST、HA、LN、PCⅢ水平均显著升高,与早期蔡昱等[10]研究中NAFLD 患者血清HA、LN、PCⅢ水平与健康人群没有不同的结果相差很大,有可能是因为此次研究的标本较少。此次研究还发现NAFLD 患者出现肝纤维化后,其血清ALT、AST 水平也显著上升,而且NAFLD 患者的血清ALT、AST 水平与LN、PCⅢ水平呈正相关性(P<0.05),可以证明血清ALT、AST 水平和NAFLD 患者发生肝纤维化的情况关系密切,所以通过不断检测NAFLD 患者的血清ALT、AST 水平,可以及早发现肝纤维化的发生情况。相关试验证明[11],当肝细胞损伤后,HA 水平显著增加,所以可以准确地体现肝细胞受损。LN 是由肝细胞生成的非胶原糖蛋白,当肝细胞受损时,LN 水平就会增加;相关文献介绍证实,当出现肝纤维化时,患者的血清PCⅢ水平上升,所以血清PCⅢ也可以准确体现肝纤维化的发生[20,21]。
综上所述,血清ALT、AST 是NAFLD 患者出现肝纤维化的影响因素,且NAFLD 患者血清中ALT、AST水平与肝纤维化指标LN、PCⅢ均呈明显正相关,通过检测ALT、AST 水平可以评估NAFLD 患者是否有肝纤维化发生。
