长链非编码RNA NORAD在肺癌中的表达及其对肺癌细胞增殖能力的影响
2023-05-31王靖杨利杰宋政王瑞宇张钰璐李俊
王靖,杨利杰,宋政,王瑞宇,张钰璐,李俊
1.大理大学临床医学院,云南 大理 671000;
2.大理大学第一附属医院心胸外科,云南 大理 671000;
3.大理大学公共卫生学院,云南 大理 671000
非编码RNA(non-coding RNA,ncRNA)主要包括长链非编码RNA(long non-coding RNAs,LncRNAs)和微小RNA(miRNAs)。LncRNAs是一种长度超过200个核苷酸的ncRNA,主要位于细胞核或者细胞质中[1],其表达与细胞生长、发育、肿瘤发生及进展等多种细胞生物学过程关系密切[2]。LncRNAs可通过竞争内源性RNA(ceRNAs)的方式,作为miRNA“分子海绵”来抑制miRNA 介导的靶标mRNA 的降解[3-4]。例如,LncRNA LCAT1 可作为ceRNA,通过“海绵化”miR-4715-5p 上调Ras 相关C3 肉毒菌素物底物1(ras-related C3 botulinum toxin,Rac1)活性,进而促进肺癌的进展[5]。LncRNA DRAIC在肺癌中的表达显著升高,与患者的预后密切相关,其可通过抑制miR-223-3p的表达,促进肺癌细胞的增殖、迁移、侵袭[6]。LncRNA可作为肺癌的诊断标志物及候选治疗靶点[7]。
LncRNA DNA损伤诱导的非编码RNA(NORAD)也称为LINC00657,位于chr20:34636726-34636747,主要存在于细胞质中,在多种肿瘤的表达均显著升高[8]。NORAD 可通过miRNA-455/CDK14 轴影响肺癌细胞的增殖能力[8]。但NORAD 与肺癌细胞增殖的深入调控机制,尚不明确。课题组前期通过高通量测序筛选发现,包括LncRNA NORAD 在内的多种LncRNA 的表达显著上调[9]。本研究在前期研究的基础之上,研究NORAD 在肺癌中的表达及其与细胞增殖的关系,初步明确NORAD在肺癌中的可能调控机制。
1 材料与方法
1.1 实验材料与试剂 肺癌细胞(A549、HCC827、NCI-H1299、NCI-H1395、NCI-H1650)购自于赛百慷(上海)生物技术股份有限公司,HFL1(人胚肺成纤维细胞)购自于武汉灵思生物技术有限公司,由本实验室保存。Annexin V FITC/PI 细胞凋亡检测试剂盒、CCK-8 试剂盒购自于北京索莱宝科技有限公司,免疫荧光检测试剂盒购自于武汉灵思生物有限公司,qRT-PCR 检测试剂盒购自于美国Bio-Rad 公司,Lipofectamine 3000转染试剂盒购自于美国Invitrogen公 司,Anti-Bad antibody、Anti-Bcl-2 antibody、Anti-Cleaved Caspase-3 antibody、Anti-Ki-67 antibody 购自于英国Abcam 公司;Anti-GAPDH antibody 购自于武汉三鹰生物技术有限公司。hsa-miR-26b-5p mimics、hsa-miR-654-5p mimics、及NC (Negative control)购自于广州锐博生物,si-NORAD (5'-AAGCCACCUUUGTGAACAGUA-3')购自于上海吉玛制药技术有限公司。qRT-PCR引物由生工生物工程(上海)股份有限公司合成,引物序列见表1。10 对肺癌患者肿瘤及配对的癌旁组织均为2019 年1月至2021 年12 月在我院心胸外科住院,行肺手术后经病理检查明确诊断为肺癌患者。患者年龄44~76 岁,平均年龄55 岁,其中男性4 例,女性6 例。肿瘤及其配对的癌旁样本置于液氮中保存。每例患者均已签署知情同意书,由我院伦理委员会审查和批准。
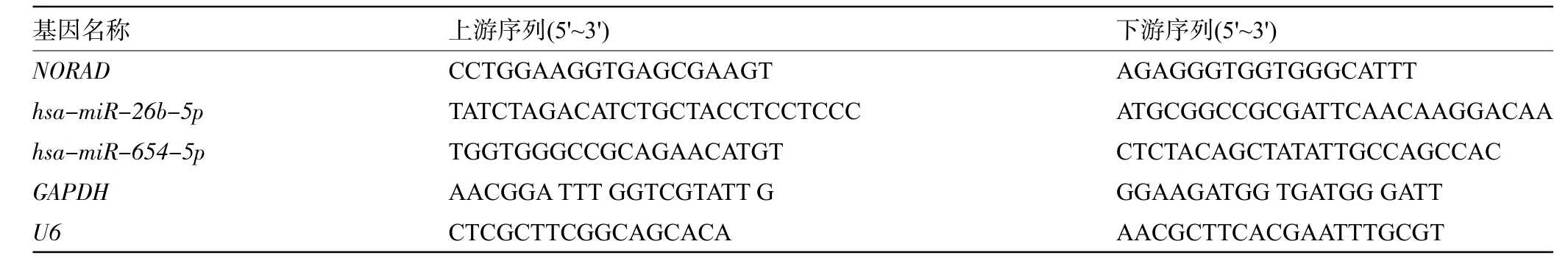
表1 qRT-PCR引物序列Table 1 Primers of qRT-PCR
1.2 主要仪器 HERAcell 150i1型CO2培养箱购自于美国Thermo 公司;Lightcycler480 型qRT-PCR 仪购自于美国Roche公司;NIKON DS-U3正置荧光显微镜购自于日本尼康;Multiskan Sky 全波长酶标仪购自于美国Thermo公司;FACS Calibur 流式细胞仪购自于美国BD 公司;PowerPace Basic 型电泳仪购自于美国Bio-RAD公司。
1.3 实验方法
1.3.1 肺癌组织样本RNA-seq分析 取6个肺癌组织及配对的癌旁组织样本经过RNA 抽提、纯化、建库之后,基于Illumina HiSeq2500 测序平台,对这些文库进行双末端(paired-end,PE)测序,筛选差异表达基因(筛选标准:|log2FoldChange|>1,P<0.05)。
1.3.2 NORAD互做miRNA生物信息学分析 利用在线分析软件Starbase (https://starbase.sysu.edu.cn/index.php)、Jefferson (https://cm.jefferson.edu/rna22/Precomputed/)、miRDB (http://mirdb.org/)及miRNA 测序数据联合分析NORAD可能互做miRNA。
1.3.3 细胞复苏及培养 细胞复苏后,A549 及HFL1 细胞利用Ham's F-12K 加10% 胎牛血清培养,HCC827、NCI-H1299、NCI-H1395 及NCI-H1650 细胞利用RPMI-1640 加10%胎牛血清培养;另所有细胞培养基中均增加1%青霉素-链霉素双抗培养。所有细胞置于37℃、5%CO2培养箱中培养,待细胞联合度达到80%~90%时,按照1∶(2~3)的比例传代,备用。
1.3.4 qRT-PCR检测NORAD及hsa-miR-654-5p、hsa-miR-26b-5p表达 TRIzol裂解法提取肺癌组织及细胞总RNA,逆转录试剂盒逆转录成cDNA,qRT-PCR检测NORAD、hsa-miR-654-5p、hsa-miR-26b-5p 的表达。数据以2-△△CT表示,△CT=目的基因Ct值-内参基因Ct 值,△△CT=实验组[Ct (目的基因)-Ct (内参基因)]-对照组[Ct(目的基因)-Ct(内参基因)]。
1.3.5 免疫荧光检测肺癌组织中Ki-67表达 肺癌及配对的癌旁组织样本经冰冻切片,室温晾干水分,4%多聚甲醛固定10 min,置于磷酸盐缓冲液(PBS) (pH7.4)中在脱色摇床上晃动洗涤3 次,每次5 min。抗原修复后,5%BSA 抗原阻断,滴加Ki-67 抗体(1∶300),4℃孵育过夜;PBS 清洗3 次,每次5 min,滴加Cy3标记的二抗,37℃孵育60 min,PBS清洗3次,每次3 min,滴加抗荧光淬灭封片剂。利用日本尼康正置荧光显微镜(NIKON DS-U3)采集照片。利用Image-pro plus6.0 分析软件计算每个样本中Ki-67 的平均荧光值。
1.3.6 细胞分组及转染 取对数生长期的A549细胞,1×104cells/mL的细胞量传于细胞培养6孔板,将A549 细胞随机分为空白对照组(Control)、si-NORAD组、miR-654-5p mimics 组、miR-26b-5p mimics 组、si-NORAD与miR-654-5p mimics联合组、si-NORAD与miR-26b-5p mimics 联合组。si-NORAD、miR-654-5p mimics、miR-26b-5p mimics 按照Lipofectamine 2000脂质体转染试剂盒说明书转染入A549细胞,24 h后收集细胞对应检测。
1.3.7 EdU 检测细胞增殖 将37℃预热的EdU工作液(20 μmol/L)加入6孔板,37℃、5%CO2继续培养2 h 后,去除培养基,PBS 清洗细胞3 次,加入4%多聚甲醛,室温固定15 min,每孔用1 mL 细胞通透液(含0.3%Triton X-100 的PBS),室温孵育10~15 min,PBS清洗细胞3次后,每孔加入5 μL 碘化丙啶(PI)染色,荧光显微镜拍照。
1.3.8 细胞凋亡检测 收集细胞,按照试剂盒操作说明,预冷乙醇固定后,加入10 μL Annexin V-FITC及PI染色液,轻轻混匀,室温避光孵育15 min,随后置于冰浴中,上机检测,FlowJo Dongle分析软件进行分析。
1.3.9 荧光素酶检测 将包含NORAD 与miR-26b-5p、miR-654-5p 结合位点的野生型(Wt)及突变型(Mut)序列的pmiGLO载体分别与miR-654-5p mimics、miR-26b-5p mimics 或NC 片段传染A549 细胞,24 h后收集细胞,利用荧光素酶检测试剂盒检测荧光素的表达。
1.3.10 Western blot 检测 A549 细胞利用RIPA裂解,冰上孵育20 min后,4℃、14 000×g离心3~5 min,取上清液,BCA 定量,每孔按照20 μg 蛋白量上样,SDS-PAGE电泳后,转膜,分别以兔抗Ki-67(1∶800)、Bad(1∶800)、Bcl-2(1∶500)、Cleaved Caspase-3(1∶800)及GAPDH(1∶10 000),4℃、孵育过夜后,TBST 漂洗3次,加入HRP酶标抗兔二抗。加入ECL 发光液膜置于全自动化学发光分析仪中扫描,通过TANON GIS软件读取相关条带灰度值。
1.4 统计学方法 所有实验均重复三次,计量数据以均数±标准差(±s)表示。实验数据采用GraphPad Prism6.0统计分析及绘图。多组间数据的比较采用单因素方差分析,组内两两比较采用LSD-t检验,组织标本中NORAD与miR-26b-5p、miR-654-5p表达采用配对t 检验,利用线性回归分析肺癌组织中NORAD 与Ki-67、miR-26b-5p及miR-654-5p与Ki-67及NORAD与miR-26b-5p、miR-654-5p 的表达相关性。以P<0.05为差异有统计学意义。
2 结果
2.1 LncRNA NORAD 在肺癌中的表达及其与Ki-67 表达的相关性 RNA-seq 分析发现,与癌旁组织比较,NORAD 在肺癌组织中的表达显著升高(log2FoldChange=6.455,P=0.000)。qRT-PCR 检 测 分析,与癌旁组织比较,肺癌组织中NORAD的表达显著上调(t=6.430,P=0.000);qRT-PCR 检测发现,与HFL1细胞比较,肺癌细胞中NORAD 的表达显著上调(F=46.910,P=0.000)。免疫荧光检测发现,与癌旁组织相比,肺癌组织中Ki-67 的表达显著升高(t=9.100,P=0.000);线性回归分析,肺癌组织中NORAD的表达与Ki-67的表达呈正相关(r=0.646,P=0.000),见图1。
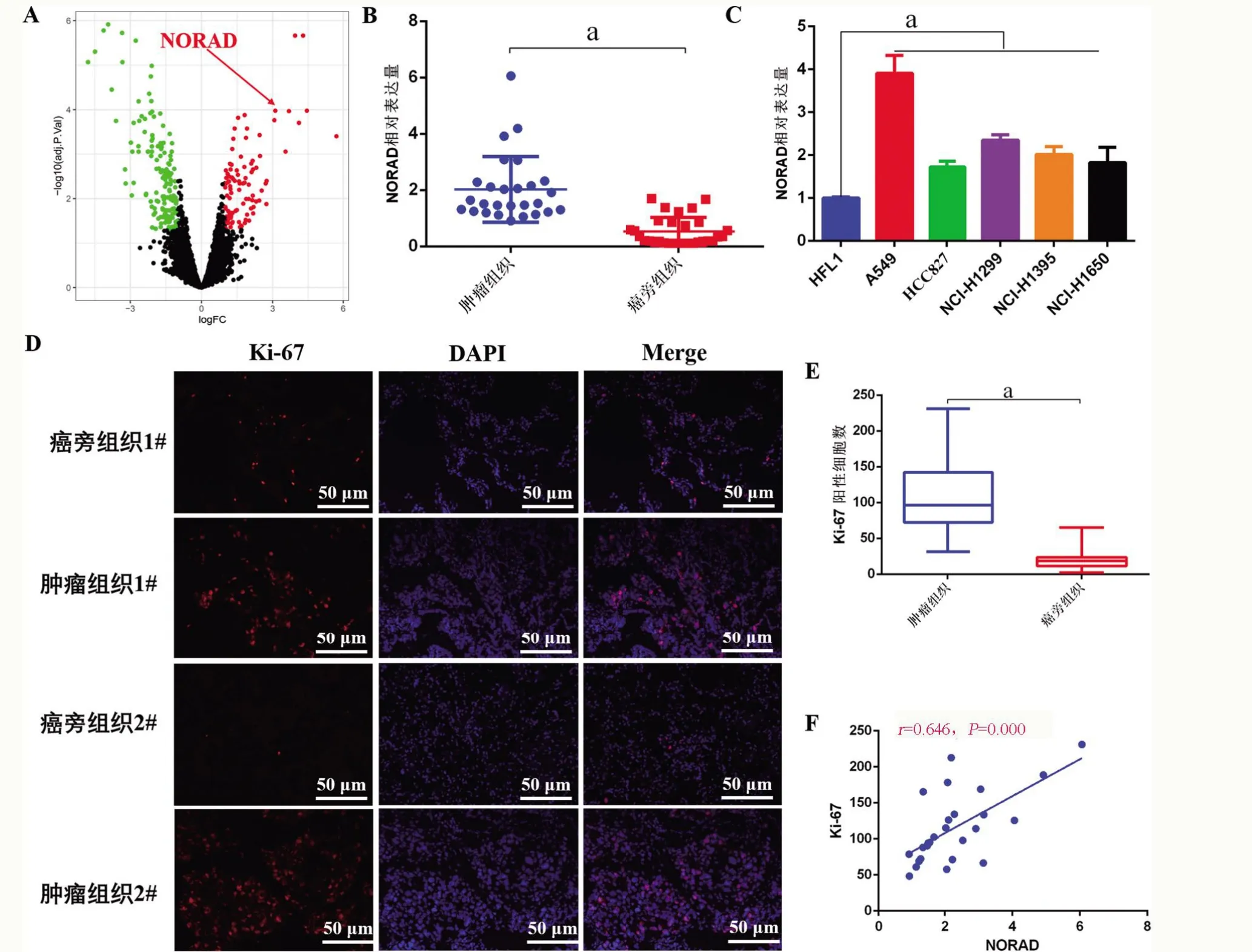
图1 NORAD在肺癌中的表达及其与Ki-67表达的相关性Figure 1 Expression of NORAD in lung cancer and its correlation with Ki-67 expression
2.2 肺癌中NORAD 互做miRNA 筛选及其在肺癌中的表达水平 利用在线分析软件Starbase、Jefferson、miRDB 及miRNA 测序数据联合分析NORAD 可能互做miRNA,结果发现,miR-26b-5p、miR-654-5p为NORAD 候选互做miRNA。RNA-seq 分析发现,miR-26b-5p、miR-654-5p 在肺癌组织中的表达显著降 低(log2FoldChange 分 别 为-3.654、-2.165,均P=0.000),qRT-PCR 检测发现,与癌旁组织相比,肺癌组织 中miR-26b-5p (t=6.821,P=0.000)与miR-654-5p(t=4.075,P=0.000)的表达显著下调;与HFL1 细胞比较,肺癌细胞中miR-26b-5p (F=41.890,P=0.000)与miR-654-5p (F=39.260,P=0.000)的表达显著下调(F=32.010,P=0.000)。直线回归分析结果显示,肺癌组织 中miR-26b-5p (r=-0.403,P=0.000)与miR-654-5p(r=-0.423,P=0.000)的表达与Ki-67 的表达呈负相关,见图2。
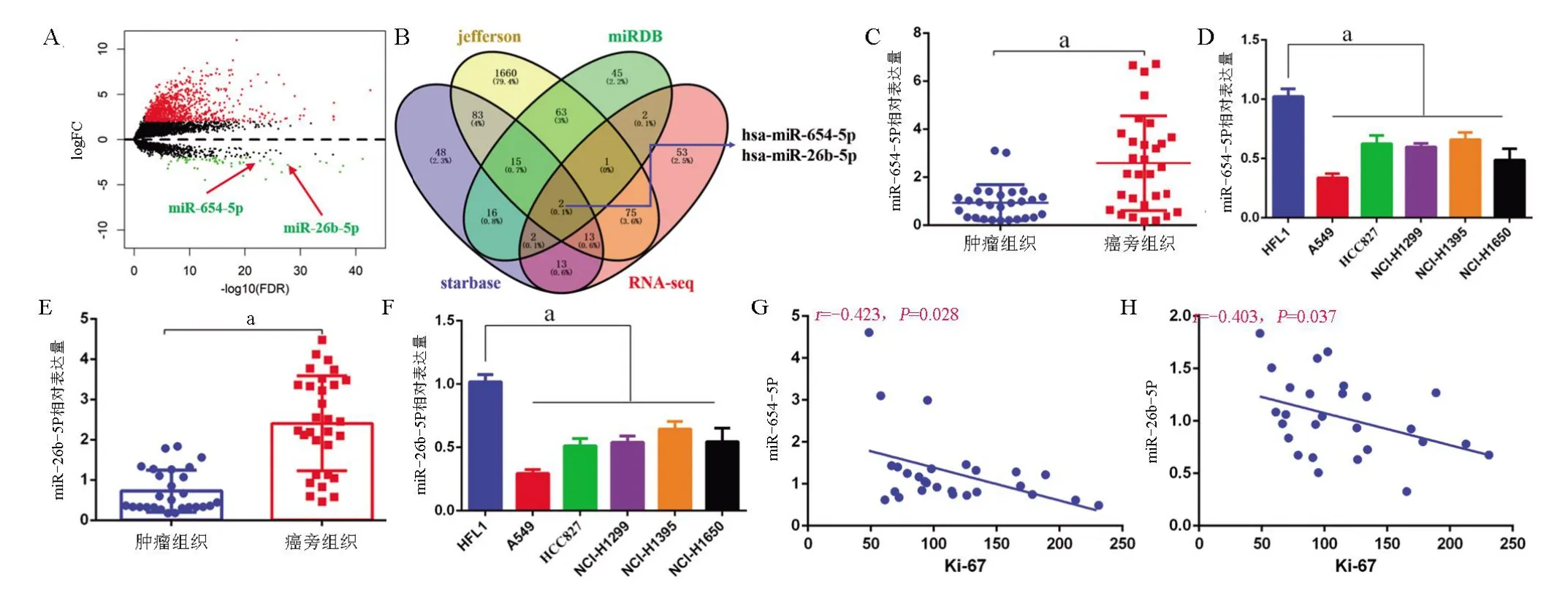
图2 肺癌中NORAD互做miRNA筛选及其在肺癌中的表达水平Figure 2 Screening and expression analysis of NORAD bound miRNA in lung cancer Screening of NORAD interacting miRNA in lung cancerand its expression level in lung cancer
2.3 肺癌中NORAD与miR-26b-5p、miR-654-5p表达的相关性 经直线回归分析结果显示,肺癌组织中,NORAD 与miR-26b-5p (r=-0.435,P=0.023)、miR-654-5p(r=-0.395,P=0.041)的表达呈负相关。荧光素酶检测分析发现,miR-26b-5p mimics(t=14.270,P=0.000)、miR-654-5p mimics (t=13.310,P=0.000)与野生型NORAD 载体(Wt)共转染后,荧光素酶的表达显著降低;而miR-26b-5p mimics (t=1.670,P=0.170)、miR-654-5p mimics (t=13.310,P=0.000)与 突 变 型NORAD载体(Mut)共转染后,荧光素酶的表达无显著变化,见图3。
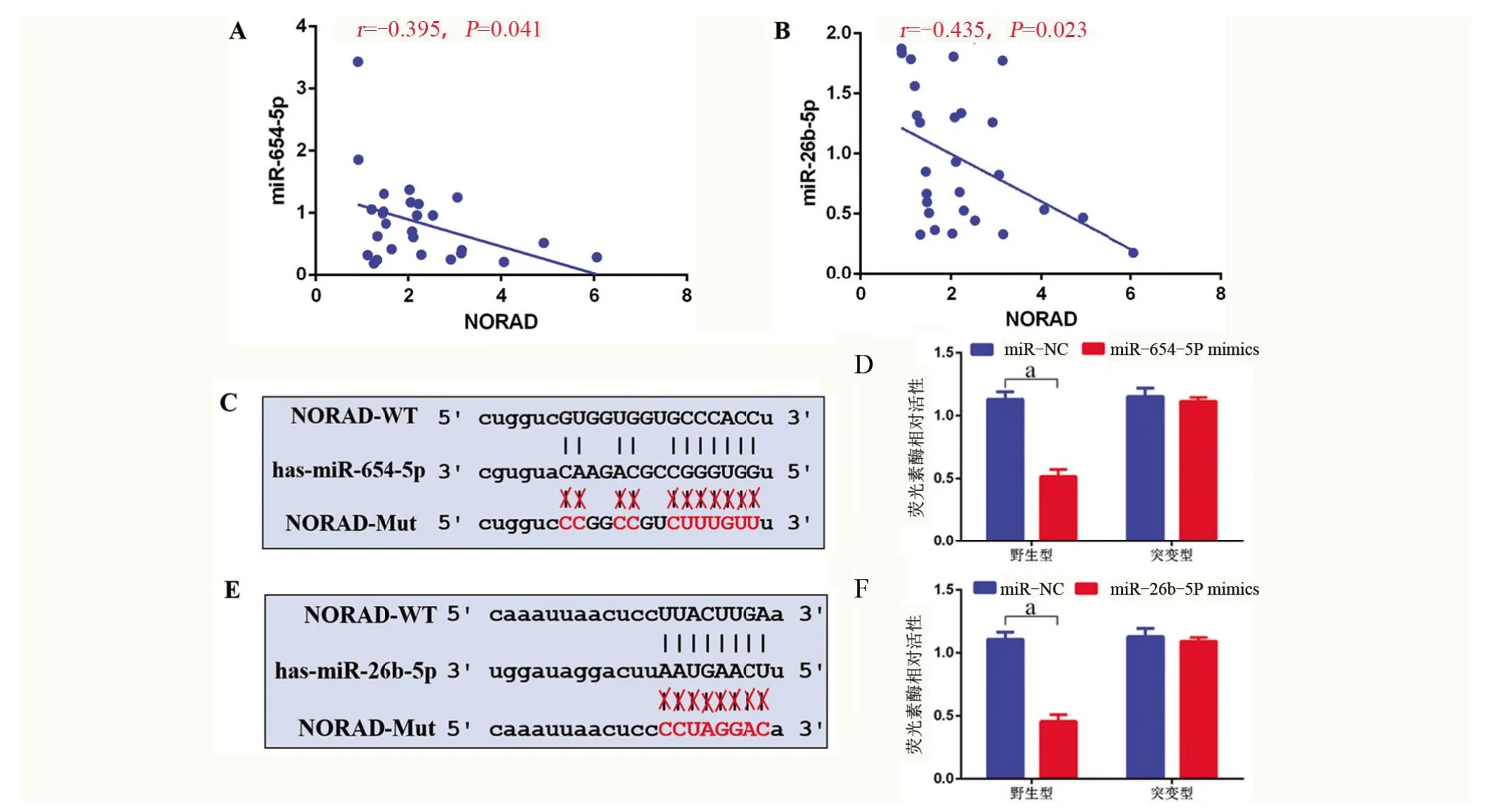
图3 肺癌中NORAD与miR-26b-5p、miR-654-5p表达的相关性Figure 3 Correlation analysis of NORAD expression with miR-26b-5p and miR-654-5p in lung cancer
2.4 NORAD对肺癌细胞增殖及凋亡的影响 与Control组比较,抑制NORAD(si-NORAD)后,A549 细胞的增殖能力显著降低;过表达miR-26b-5p、miR-654-5p 后,A549 细胞的增殖能力显著降低;与si-NORAD 组比较,同时抑制NORAD 及过表达过表达miR-26b-5p、miR-654-5p 后,A549 细胞的增殖能力进一步降低。与Control 组比较,抑制NORAD 后,A549 细胞的凋亡比例显著增加(t=10.250,P=0.000);过表达miR-26b-5p (t=18.56,P=0.000)、miR-654-5p(t=10.030,P=0.000) 后,细 胞 凋 亡 显 著 升 高;与si-NORAD 组比较,同时抑制NORAD 及过表达miR-26b-5p(t=7.960,P=0.001)、miR-654-5p(t=3.704,P=0.020)后,A549细胞的凋亡进一步升高,见图4。
2.5 NORAD抑制后肺癌细胞中凋亡相关蛋白表达的变化 经Western blot 检测,与Control 组比较,si-NORAD 后,A549 细胞中Bad (t=9.498,P=0.000)、Cleaved caspase-3 (t=6.715,P=0.000)相对表达量均显著升高,而Bcl-2 的相对表达量显著降低(t=6.102,P=0.003);miR-654-5p mimics、miR-26b-5p mimics得到类似的结果。si-NORAD 与miR-654-5p mimics、miR-26b-5p mimics 联合后,与si-NORAD 组比较,A549 细 胞 中Bad (t=3.374、5.715,P=0.025、0.005)、Cleaved caspase-3 (t=4.680、6.425,P=0.033、0.000)相对表达量进一步升高,而Bcl-2 的相对表达量显著降低(t=2.946、6.153,P=0.042、0.00),见图5 和表2。
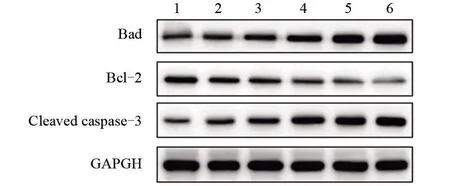
图5 Western blot检测肺癌细胞凋亡相关蛋白表达Figure 5 Expression of apoptosis-related proteins in lung cancer cells detected by Western blot
表2 凋亡相关蛋白的相对表达量(±s,n=3)Table 2 Relative expression of apoptosis-related proteins(±s,n=3)
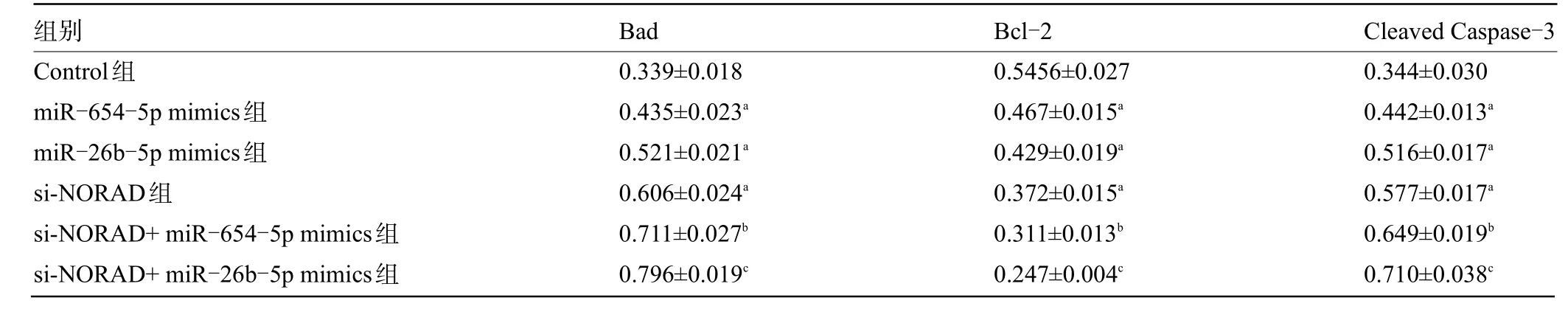
表2 凋亡相关蛋白的相对表达量(±s,n=3)Table 2 Relative expression of apoptosis-related proteins(±s,n=3)
注:与Control组比较,aP<0.01;与si-NORAD组比较,bP<0.05;与si-NORAD组比较,cP<0.01。Note:Compared with the Control group,aP<0.01;Compared with si-NORAD group,bP<0.05;Compared with si-NORAD group,cP<0.01.
组别Control组miR-654-5p mimics组miR-26b-5p mimics组si-NORAD组si-NORAD+miR-654-5p mimics组si-NORAD+miR-26b-5p mimics组Cleaved Caspase-3 0.344±0.030 0.442±0.013a 0.516±0.017a 0.577±0.017a 0.649±0.019b 0.710±0.038c Bad 0.339±0.018 0.435±0.023a 0.521±0.021a 0.606±0.024a 0.711±0.027b 0.796±0.019c Bcl-2 0.5456±0.027 0.467±0.015a 0.429±0.019a 0.372±0.015a 0.311±0.013b 0.247±0.004c
3 讨论
肺癌(lung cancer)是全球最常见的恶性肿瘤之一,其发病率和死亡率均排在恶性肿瘤前列[10],非小细胞肺癌(non-small cell lung cancer,NSCLC)是肺癌的主要病理表型,约占85%[11]。由于缺乏及时、有效的诊断方法,患者确诊时已处于中晚期,与早期NSCLC相比,中晚期NSCLC 的治疗反应性降低且预后差,导致NSCLC患者死亡率较高,5 年生存率约为15%[12]。近年研究认为,LncRNA 作为致癌基因或抑癌基因在肿瘤进展的过程中发挥着至关重要的作用,可调控肿瘤细胞的增殖、迁移、凋亡、侵袭和转移等恶性行为,是肿瘤潜在的诊断和治疗靶点[13-15]。本研究发现,在肺癌组织及人肺癌细胞株中,NORAD 的表达均显著升高,暗示其与肺癌的发生及发展的关系密切。
LncRNAs作为miRNA“分子海绵”,发挥竞争内源性RNA(ceRNAs)的功能来抑制miRNA 介导的靶标mRNA 的表达、调节细胞的增殖等行为[3-4]。LncRNA SNHG12 在肺癌中的表达显著升高,可通过调节miR-320a/β-catenin轴抑制肺癌细胞增殖和侵袭,促进细胞凋亡[16]。肺癌组织中LncRNA HOXA-AS3的表达水平升高,而miR-340-5p 的表达水平降低,抑制HOXA-AS3表达可显著抑制细胞增殖,细胞凋亡显著增加,并增强DMS114/DDP 细胞顺铂敏感性,其作用机制可能与miR-340-5p 的表达上调有关[17]。LncRNA DANCR 在肺癌中的表达显著升高,促进DANCR的表达,可显著促进肺癌细胞的增殖,抑制细胞凋亡,其机制可能通过抑制miR-216a的表达所致[18]。课题组通过RNA-seq 检测分析发现,NORAD 在肺癌组织中的表达显著升高,抑制NORAD 的表达可显著抑制肺癌细胞增殖,增加细胞凋亡。利用在线分析软件Starbase、Jefferson、miRDB 及miRNA测序数据联合分析miR-26b-5p、miR-654-5p 为NORAD 候 选 互 做miRNA。miR-26b-5p、miR-654-5p 在肺癌组织中的表达显著降低,促进miR-26b-5p、miR-654-5p 的表达,可显著抑制肺癌细胞增殖。以上结果暗示NORAD可能通过抑制miR-26b-5p、miR-654-5p的表达而影响肺癌细胞增殖。
研究证实,miRNA 主要通过与靶基因的3'-UTR结合后,抑制靶基因的表达而调控细胞的增殖、分化、凋亡等行为,参与肿瘤的发生及进展,可作为多种肿瘤的诊断及治疗靶点[19]。miRNA-146b-5p在肺癌组织中的表达显著升高,其可能通过上调线皮素-1(LAD-1)的表达来促进细胞增殖,进而促进肺癌进展[20]。miR-520f和miR-143-3p在肺癌患者中表达降低,且与肺癌细胞增殖和侵袭行为以及肺癌患者的不良预后有关[21]。本研究通过RNA-seq 分析发现,miR-26b-5p、miR-654-5p在肺癌中的表达显著降低,与肺癌细胞增殖关系密切。研究发现,在肺癌患者组织及血清中,miR-26b-5p 的表达显著降低,肺癌细胞分泌包含miR-26b-5p的外泌体,调节肺癌放疗敏感性[22]。在结直肠癌中,miR-654-5p 的表达显著降低,导致HAX-1的表达上调,进而促进细胞增殖、侵袭及转移[23]。最近研究报道,包括LncRNA、环状RNA(circRNA)等均可作为miRNA的“分子海绵”,影响miRNA的表达[3-4,24]。通过研究发现,NORAD可作为miR-26b-5p、miR-654-5p的“分子海绵”,抑制NORAD 及促进miR-26b-5p、miR-654-5p 的表达,可显著抑制肺癌细胞增殖。但miR-26b-5p、miR-654-5p 通过调控下游何种基因及通路而影响肺癌细胞增殖的,还需深入探讨。
综上所述,肺癌中NORAD的表达显著上调,可能通过抑制miR-26b-5p、miR-654-5p 的表达而促进肺癌细胞增殖,NORAD 可作为肺癌的诊断标志物。但由于本项目主要集中在细胞水平研究,后期拟通过动物水平进一步明确NORAD 与肺癌细胞增殖的关系;同时,miR-26b-5p、miR-654-5p 所调控的靶基因及下游通路尚需进一步明确。
