交叉引物扩增法检测食品中大肠杆菌不耐热肠毒素的探讨
2023-05-30李伟任重杰
李伟 任重杰
摘 要:CPA技术与常规PCR技术相比,既避免了对昂贵的仪器设备的依赖性,又能减少检测费用,且由于其特异性高、灵敏度高,可大幅度提高检测速度。本文基于交叉引物扩增法技术及应用,设计了使用该方法检测食品中大肠杆菌不耐热肠毒素的实验,以期能够为相关人员提供借鉴与帮助。
关键词:交叉引物扩增法;大肠杆菌;不耐热肠毒素
Detection of Heat Labile Enterotoxin of Escherichia coli in Food by Cross Primer Amplification
LI Wei, REN Zhongjie
(Yuncheng County Inspection and Testing Center, Heze 274700, China)
Abstract: Compared with the conventional PCR technology, CPA technology can not only avoid the dependence on expensive instruments and equipment, but also reduce the detection cost, and because of its high specificity and sensitivity, it can greatly improve the detection speed. Based on the technology and application of cross primer amplification, this paper designed an experiment using this method to detect heat labile enterotoxin of Escherichia coli in food, in order to provide reference and help for relevant personnel.
Keywords: cross primer amplification; Escherichia coli; heat labile enterotoxin
近年来,由于食品行业的迅速发展,食源性致病微生物引发的食物中毒、食源性疾病的发生率不断增加,给人们的健康和生活带来极大的威胁,同时也给我国的公共健康和经济带来了巨大损害。由于食物环境的原因,大肠杆菌不耐热肠毒素一直是引起食物中毒的主要原因。因此,快速、灵敏地检测出大肠杆菌不耐热肠毒素对食品安全管理具有重要意义。
1 交叉引物扩增法技术及应用
1.1 交叉引物扩增方法概述
交叉引物扩增技术是一种新的核酸等温扩增技术。交叉引物扩增技术采用一种DNA聚合酶,在温度为62 ℃的恒温下保温1 h,即可特异、快速、高效地完成核酸的扩增[1]。本技术与快速检测技术(如快速检测纸条、一次性核酸检测设备)的组合,为临床快速检测、分子诊断、检疫和生物医药等领域的发展提供了新的检测方法。
1.2 交叉引物扩增方法特点
交叉引物扩增方法在检验检疫、检测突发传染病和医院的早期篩查中得到了广泛的应用。由于CPA的成本较低,CPA的扩增只能在离心机和诸如水浴、金属浴等简单的恒温装置中进行。由于其操作简单,且对操作者不具备太高的操作水平要求,一般人只要经过简单的训练或自学就可熟练使用,这为推广这项技术创造了良好的条件。该方法具有很好的特异性,能为6个目标基因区设计6~8条特异引物,以确保反应的特异性[2]。同时,其灵敏度高,可从少量复制中分离到目标基因,其敏感性能够达到10个拷贝。产品的检测方法简单,特异性高,可用琼脂糖凝胶电泳法进行鉴定,也可将荧光染料添加到扩增产品中,根据颜色的改变来判断,也可采用一次性的抗污染核酸检测设备进行检测,降低了假阳性的发生概率。
1.3 交叉引物扩增反应原理
CPA扩增系统主要由置换引物、交叉引物和Bst DNA聚合酶组成,通过Bst DNA聚合酶的链替换,可实现DNA的连续重复扩增。CPA的扩增过程包括以下几个步骤。①生成具有交叉引物位点的扩增产物。PFs的5末端和反交引物PRa的杂交序列是一致的。在交叉引物的前面,排列着替代引物。取代引物的浓度比交叉引物要低。BST DNA聚合酶可通过替换的方式,在不同的位置上不断地延伸出不同的交叉引物。固定的前链5末端是由替换引子和交叉引子不断地扩展而形成的。PFa也是同样的原理,它可通过伸展和排列来形成另外一条固定的链条[3]。②扩增交叉引物。该排列链由末端新生成的引物位点构成,并将其3端交叉引物的导入点模板。利用引物的不断杂交、延伸以及扩增产物自身的杂交延伸,可形成多个引物杂交,加快扩增进程。③对产品的生成进行检测。在反应完成后,会产生一种单链、双链、半双链的混合物。
1.4 交叉引物扩增反应产物的检测方法
CPA方法得到的核酸扩增产物在琼脂糖凝胶上显示为一条带状。通过电泳观察,可判断是否出现了一个梯度条。可将嵌入的荧光染料(乙溴锭、SYBR Green I)等加入反应系统,且根据反应溶液中荧光强度的改变判定产品的生成,从而判定是否有扩增反应。若将1 μm SYBR GreenI型荧光染料加入双链DNA的小沟中,在产生扩增产物时,可与DNA双链连接,使荧光染料从橙色转变为绿色[4]。利用一次性的核酸检测仪和核酸膜色谱快速检查纸等产品,对显色试纸进行目视判读,只在C质控区处有一条红线时,判定为阴性,即没有反应;若有两条红线,分别在T检测区和C质控区,判定为阳性,表示有反应,若无红线,则判定为无效。
2 材料与方法
2.1 模板的制备
用麦康凯琼脂平板37 ℃下培养C83903(LT)菌株16~24 h。用LB液为载体,在37 ℃下,用200 r·min-1的振荡试验研究了该菌的生长特性。将5 mL的培养基,在10 000 r·min-1下进行3 min的离心,将上清液作为DNA模板,贮存于-20 ℃的无菌环境下备用。
2.2 生猪肉人工随机污染
用麦康凯培养基C83903(LT'*)菌株在37 ℃下过夜培养,稀释1 000倍后,将其稀释菌液与无LT毒素的猪肉样品进行混匀。在10 000 r·min-1的条件下离心3 min后,将上清液排出,用1 mL 0.9%的生理盐水进行悬浮培养,再用肠毒素大肠埃希氏菌对样本进行人工污染,并进行记录。
2.3 特异性检测
采用14个试验菌(6个大肠杆菌和8个非大肠杆菌),将其与LAMP法进行对比。反应完成后,将预先滴入的SYBR GreenI型荧光染料与所述扩增产品相混合,在自然和紫外线下进行观察,使用浓度为2%琼脂糖凝胶电泳技术对扩增产物进行检测。
2.4 人工污染生猪肉样本的检测
采用CPA法、LAMP法、qPCR法,对人工感染經产肠毒素的大肠埃希氏菌生猪肉样本共计50例进行了检验,采用DNA萃取试剂对猪肉样品进行处理,以DNA基因组为模板,以2%的琼脂糖凝胶电泳法检测CPA、LAMP扩增产物,并与qPCR进行对比。
3 结果与分析
3.1 检测方法的建立与优化
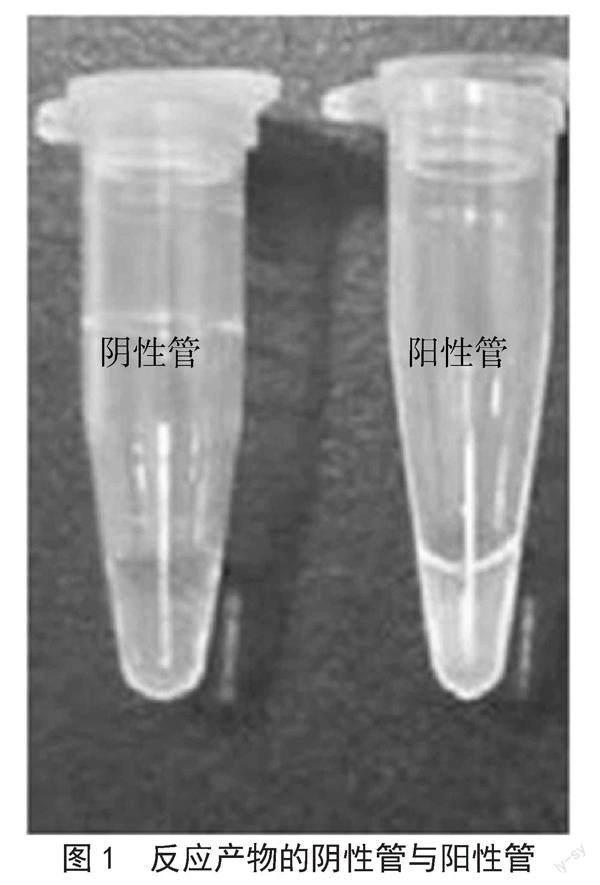
该引物的特异性较强, 在60 ℃、60 min条件下可大量扩增LT毒素,用2%的琼脂糖电泳法检测,其阳性呈不规则的梯形条纹,而在阴性对照组中无条带。用华峰管另一头的SYBR GreenI染料与反应产物进行混合,用肉眼观察,在正试管中呈绿色,阴性试样为橙色;在紫外线的作用下,阳性管的荧光呈绿色,而阴性管则不变,如图1所示。
通过实验,对反应温度、Bst聚合酶、dNTPs、Mg、甜菜碱浓度和扩增时间进行了优化,发现62 ℃、64 ℃、66 ℃是最佳的扩增温度;采用8 U/管Bst聚合酶法进行扩增,得到的条带最明显,最佳的Bst聚合酶浓度是8 U/管;在0.3 mmol·L-1 dNTPs中,dNTPs的扩增条件最为明显;实验结果表明,在45 min内,样品中有一条明显的阶梯状条纹,但随着反应时间的延长,条带的亮度没有显著的改变,因此45 min是最佳的扩增时间。按上述原理进行CPA反应,最佳Mg浓度为2.0 mmol·L-1,甜菜碱浓度为0.8 mol·L-1。
3.2 特异性试验
采用CPA法,对14个不同的细菌进行了特异性测定,并重复了3次。用琼脂糖电泳法测定了2个带有LI+基因的菌株,其余12个是未携带LI+基因的菌株,与LAMP的检测结果相吻合,证明了该方法的特异度较高。
3.3 人工污染生猪肉样本检测结果
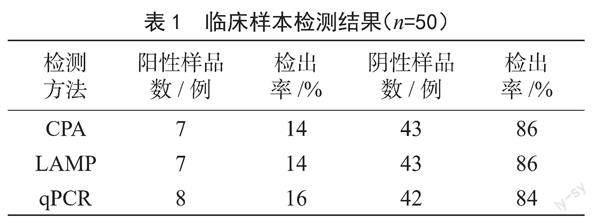
采用CPA法和LAMP法,对50例无菌感染的猪肉样品进行了快速检测。结果表明,CPA、LAMP法各检测到7个带有LT的基因,与qPCR的检测结果基本相符,其检出率为14%。
4 结论与讨论
本文通过优化反应温度、酶浓度、dNTPs浓度等因素,构建了一种快速、特异、灵敏度高的新型CPA探针。与LAMP法比较,该方法特异性强,从加样到反应结束,只需1.5 h就能完成目标基因的特异扩增,而对非携带目标基因的鉴定结果为阴性[5]。本文采用人工污染的生猪肉模拟样品,采用荧光PCR技术,采用CPA、LAMP法进行人工感染,其阳性检出率达到14%(7/50),表明CPA是一种新的检测技术,可满足食品卫生领域微生物质量检验的需要。
CPA扩增时,由于系统中DNA的连续合成,会导致大量的焦磷酸镁沉淀,因此可通过是否有白色沉淀来判断,但当LT毒素基因扩增时,没有发现明显的乳白色沉淀,而用2.0%的琼脂糖凝胶电泳法检测,可看到不同尺寸的区域带阶梯状结构[6]。为了避免在打开瓶盖时产生的大量气溶胶对周围环境的影响,本文选择广州华峰生物科技有限公司生产的华峰管进行可视化检测,将SYBR绿色I型染料和反应系统的混合液加入华峰管,使二者在反应结束后进行混合,以确定反应的效果,有效地防止了气溶胶所致的交叉污染。
综上,产肠毒素大肠杆菌是一种非常危险的病原体,会引起食源性疾病,因此建立一种快速、准确的检测方法,对于保证食物安全和人体的健康非常重要。交叉引物扩增法具有时间短、成本低、特异性高等优点,且无需特殊、昂贵的仪器和实验环境,为食品致病菌的检测开辟了一条新途径。
参考文献
[1]陈欢,黄世旺,徐昌平,等.交叉引物恒温扩增技术快速检测金黄色葡萄球菌[J].中国卫生检验杂志,2019,29(11):1303-1305.
[2]刘文鑫,袁超文,张力国,等.大肠杆菌Ⅱ型不耐热肠毒素快速检测方法的建立与应用[J].黑龙江畜牧兽医,2019(17):7-11.
[3]张晶,吴新伟,陈惠玲,等.交叉引物恒温扩增技术检测创伤弧菌的应用研究[J].中国人兽共患病学报,2019,35(8):711-714.
[4]姜玲玲,杨丽娟,伍春红,等.猪源产肠毒素性大肠杆菌耐热肠毒素STⅡ基因荧光定量PCR检测试剂盒的研制[J].畜牧与兽医,2018,50(10):115-118.
[5]王淑娟,范一灵,冯震,等.多酶恒温核酸快速扩增法检测大肠杆菌O157∶H7[J].上海预防医学,2022,34(6):511-518.
[6]陈安安.如何快速检测食品中大肠杆菌[J].中国食品工业,2022(15):64-66.
作者简介:李伟(1982—),男,山东菏泽人,大专,助理工程师。研究方向:食品检测。
