海南东寨港红树林植物和沉积物真菌多样性及其药用活性
2023-05-30闫璧滢陈渝川雷丽娟王潇解云英赵午莉张晶司书毅陈明华
闫璧滢 陈渝川 雷丽娟 王潇 解云英 赵午莉 张晶 司书毅 陈明华

摘要:目的 对海南东寨港红树林3种植物和沉积物来源真菌多样性进行勘探,旨在发现潜在的真菌新物种和药用真菌。方法 基于内转录间隔区(ITS)序列测定对分离得到的真菌进行初步鉴定,并对真菌发酵粗提物进行抗菌、抗新冠病毒靶标、抗结核、抗动脉粥样硬化,以及抑制胰腺癌细胞增殖的广泛活性筛选。结果 从海南东寨港红树林植物和沉积物中共分离得到164株真菌,鉴定出106株,分布在17个目33个科43个属,其中优势菌群为镰刀菌属(Fusarium)、青霉属(Penicillium)和曲霉属(Aspergillus),分别占总体的12.26%、12.26%和9.43%。结论 初步认知了海南东寨港红树林3种植物及沉积物来源真菌的多样性,发现了一些潜在的能产生活性物质的真菌,为后续研究红树林环境来源的真菌代谢产物的化学多样性及其生物活性奠定了基础。
关键词:红树林来源真菌;抗菌活性;抗冠状病毒活性;细胞毒性;海南东寨港
中图分类号:R978.7 文献标志码:A
Diversity and Bioactivity of fungi isolated from mangrove plants and sediments collected in Dongzhaigang, Hainan Province
Yan Bi-ying, Chen Yu-chuan, Lei Li-juan, Wang Xiao, Xie Yun-ying,
Zhao Wu-li, Zhang Jing, Si Shu-yi, and Chen Ming-hua
(Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050)
Abstract Objective To explore the fungal diversity of mangrove plants and sediments in Dongzhaigang, Hainan Province, and discover the potential new fungal species and bioactive fungi. Methods The isolated fungi were preliminarily identified on the basis of the sequence analysis of the internal transcriptional interval region (ITS), and the crude extracts of the fermentation were screened for their antibacterial, antifugal, anti-coronavirus, anti-tuberculosis, anti-atherosclerosis, and cytotoxicity activities. Results A total of 164 fungi were isolated from the three mangrove plants and sediments, among them of 106 fungi were identified, which were distributed in 17 orders, 33 families, and 43 genera, including the dominant flora were Fusarium, Penicillium, and Aspergillus genus, accounting for 12.26%, 12.26%, and 9.43%, respectively. Conclusion The diversity of fungi from the three mangrove plants and sediments collected in Dongzhaigang, Hainan Province was preliminarily recognized, and some potential bioactive fungal resources were discovered, which laid a foundation for the subsequent study on the chemical diversity and bioactivity of fungal metabolites from mangrove derived fungi.
Key words Mangrove-derived fungi; Antimicrobial activity; Anti-coronavirus; Cytotoxicity; Dongzhaigang, Hainan province
紅树林是处在热带和亚热带海陆交界地带的木本植物群落,是一种由陆地向海洋过渡的特殊生态系统。由于红树林所处环境是一个因周期性潮汐导致盐度和养分供应高度变化的特殊环境,从而为多样化生物群落提供了优越的栖息之地[1-2]。自1955年澳大利亚学者Cribb[3]首次报道了红树林来源真菌以来,其已成为海洋真菌的第二大类群。红树林来源真菌为适应其独特的生存环境,具备特殊的代谢机制,因而有可能产生出独特新颖结构的次级代谢产物以及显示出更加广泛的生物活性[4]。1989年,Poch和Gloer首次从夏威夷红树林来源真菌Helicascus kanaloanus中发现了2个新的α-吡喃酮类化合物[5],红树林来源真菌次级代谢产物自此成为微生物天然产物工作者的研究热点之一。特别是2008年以后,对红树林来源真菌次级代谢产物的研究进入了一个快速发展的时期,至2020年底,各国学者已从中获得了1387个新化合物,包括聚酮类、萜类、生物碱、肽类及二酮哌嗪类化合物等,这些化合物显示出了广泛的生物活性,如细胞毒性、抗病毒、抗细菌和抗真菌、抗炎以及杀虫等活性[6-8]。因此,红树林来源真菌次级代谢产物已成为创新药物先导物的一个重要来源。我国孕育着丰富的红树林资源,主要分布在海南、福建、两广和港澳台等地区。前期有研究表明,海南东寨港红树林中蕴藏着大量的药用放线菌资源[9],而本文我们主要对该国家级保护区的红树林植物内生真菌及沉积物来源真菌的多样性进行了初步勘探,并对其发酵产物进行了广泛的活性筛选,以期筛选出潜在的药源真菌,为进一步开发利用红树林真菌资源,发现具有潜在药用价值的生物活性天然产物奠定基础。
1 材料与方法
1.1 材料
1.1.1 红树林样品
2020年9月采集自海口东寨港红树林保护区(N19°57′33″E110°35′11″)植物样本6份,沉积物3份(表1),其中木榄1-3为不同植株样品;沉积物1-3采自木榄周围土壤。样本装进无菌自封袋中封存,带回实验室后将植物样本放置于4℃冰箱中低温保存,将沉积物样本放置-20℃中保存。
1.1.2 指示菌株
革兰阳性细菌:金黄色葡萄球菌 ATCC 25923、耐甲氧西林金黄色葡萄球菌181223(临床株,MRSA)、耐万古霉素屎肠球菌310682(临床株,VRE);革兰阴性细菌:耐碳青霉烯类鲍曼不动杆菌(临床株,CRAB)、耐碳青霉烯类铜绿假单胞菌181230(临床株,CRPA)、大肠埃希菌ATCC 25922、产超广谱β-内酰胺酶的大肠埃希菌181221(临床株,ESBLS)、耐碳青霉烯类肺炎克雷菌181248(临床株,CRE);真菌:白念珠菌ATCC10231、新型隐球菌ATCC208821;以及海分枝杆菌Mycobacterium marinum BAA-535均为本研究所保藏。
1.1.3 培养基
(1)分离培养基(g/L) 马铃薯葡萄糖琼脂培养基(PDA)2.4、海盐3;察氏培养基4.7、海盐3。纯化培养基采用PDA 2.4、海盐3。
(2)发酵培养基(/袋) 大米50 g、盐水(30 g/L)50 mL。
(3)指示菌株培养基(g/L) 耐药菌采用MH肉汤培养基(2.1);白念珠菌和新型隐球菌采用YPD培养基(酵母提取物10、蛋白胨20、葡萄糖20);大肠埃希菌使用LB培养基(酵母提取物5、氯化钠10、胰蛋白胨10);金黄色葡萄球菌、铜绿假单胞菌采用营养肉汤(NB)(1.8)。
(4)抑制剂(mg/L) 四环素50、硫酸链霉素50。待培养基温度自然冷却至45℃左右时滴入并混匀。
(5)主要试剂及仪器 ITS基因的PCR扩增采用通用引物ITS1(5′- TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)由北京睿博兴科生物技术有限公司合成,超净工作台BCM-1000A(苏州安泰空气技术有限公司)、恒温振荡培养箱HZQ-X100(苏州培英实验设备有限公司)、生化培养箱(中仪国科(北京)科技有限公司)、霉菌培养箱BPMJ-250F(上海一恒科学仪器有限公司)、高压灭菌锅GR60DA(致微(厦门)仪器有限公司)、一次性细胞培养皿(广州洁特生物过滤制品有限公司)、旋转蒸发仪EYELA N-1100(埃朗科技国际贸易(上海)有限公司)、高通量筛选多功能测试仪(PerkinElmer公司)。高效液相色谱-质谱联用仪LC-MSD-Trap/SL 1100系列(美國Agilent公司);LC-20A高效液相色谱仪(日本岛津公司)。
1.2 方法
1.2.1 红树林植物样品的处理
预先在培养皿中放入两层滤纸、两层纱布、镊子、剪刀,用报纸包好后和无菌水一起放入高压菌锅中在121℃灭菌15 min。将植物茎、叶在超净台中放入75%乙醇浸泡约1 min后再放入到无菌水中浸泡约30 s,而后放在垫有滤纸、纱布的培养皿中,使其表面水分被吸干。之后用剪刀将植物的茎、叶剪成小块,分别铺在含有抑制剂的PDA和察氏培养基平板的表面。将平板用封口膜封好后放到28℃培养箱中培养。
1.2.2 土壤样品的处理和涂布
从冷冻的海泥沉积物中取出少许,放入50 mL离心管中,超净台过夜吹风。第二天将干燥的海泥沉积物放入无菌研钵中磨成粉末,倒回50 mL离心管中。分别加入相应体积无菌人工海水(30 g/L),涡旋约
10 min,再超声约15 min。4℃条件下8000 r/min离心
5 min后,将上清液收集在15 mL离心管中。将下层沉淀用人工海水分别稀释成10-1、10-2浓度。分别将上清液、沉淀、10-1沉淀、10-2沉淀直接涂布在预先准备好的含有抑制剂的PDA和察氏培养基平板的表面。将平板用封口膜封好后放到28℃培养箱中培养。
1.2.3 菌落挑选、纯化与保存
将平板置于28℃培养2~6周。2周之后,随时观察分离培养基中菌落形态,在无菌条件下挑取真菌单菌落到新的PDA平板上进行菌株纯化。得到纯化菌株后挑取适量菌丝体放入冻存管中并以20%(体积比)灭菌甘油作为保护剂,置于-80℃冰箱中保存。
1.2.4 菌株的生物学鉴定
用无菌竹签挑取少量真菌菌丝体,置于1.5 mL EP管中,CTAB法提取真菌基因组DNA。采用真菌通用引物ITS1 (5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4 (5′-TCCTCCGCTTATTGATATGC-3′)扩增分离菌株的rDNA ITS区。PCR反应体系 (30 μL):模板DNA 1-2 μL,2×PCR mix 15 μL,Primer F(10 mmol/L),
Primer R(10 mmol/L)1 μL,ddH2O补足至30 μL。PCR反应条件:94℃, 5 min;94℃, 30 s,50℃, 30 s,72℃, 1 min,35个循环;72℃, 7 min。扩增产物2%琼脂糖凝胶电泳检测,产物委托北京睿博兴科生物技术有限公司测序。测序结果在GenBank中进行BLAST分析,检索相似性序列,初步确定分离菌株的种属,并用SnapGene比对序列进行排重。
1.2.5 真菌发酵粗提物的制备
将分离纯化鉴定排重后得到的106株真菌由PDA平板中转接到装有5 mL马铃薯葡萄糖(PDB)培养基的摇菌管中,28℃、160 r/min培养3 d后转接到预先经灭菌处理的大米培养基中,28℃静置培养30 d后用3倍体积的乙醇提取,对粗提物经3倍体积的乙酸乙酯萃取后减压浓缩,得到106份发酵粗提物。
1.2.6 活性测定
(1)发酵粗提物抗菌活性检测 抗菌活性检测:取少量粗提物 (20 mg/mL)用DMSO溶解后转移至96孔板中,将2 μL粗提物加入到100 μL待测细菌液和真菌液中(浓度:105 CFU/mL),细菌和真菌分别在37℃和28℃静置培养,并分别于16 h和10 h后肉眼观察孔的澄清度,肉眼观察为澄清的样品认为具有抑菌效果。
(2)抗新冠病毒靶标活性筛选——Mpro抑制剂荧光偏振模型[10] 将400 nmol/L Mpro以29 μL/孔加入到96孔半底板中,再加入发酵提取物1 μL/孔到96孔半底板中,室温避光孵育35~40 min。化合物孵育完毕后,以20 μL/孔加入60 nmol/L FITC-S-Biotin反应液(用DMSO溶解荧光探针FITC-Substrate-Biotin,再用荧光偏振缓冲液(10 mmol/L Tris、50 mmol/L NaCl、1 mmol/L EDTA、1mmol/L DTT pH 8.0稀释),室温避光继续孵育20~25 min。再以10 μL/孔继续加入300 nmol/L亲和素反应液(Avidin以荧光偏振缓冲液稀释),室温避光孵育5~8 min,用多功能酶标仪检测mP值。苗头发酵提取物抑制率(%)=(mP_Hit-mP_阴性对照)/(mP_阳性对照-mP_阴性对照)×100%,选取抑制率﹥50%的为阳性菌株。
(3)抗结核活性表型筛选(海分枝杆菌) 将海分枝杆菌用7H9培养基(含10% OADC,0.05%吐温80)培养,每孔加入200μL接种有对数期海分枝杆菌的7H9培養液(终浓度A600≈0.1),发酵提取物检测的终浓度为200 μg/mL,异烟肼做阳性对照,30℃静置培养5-7天,观察结果,以完全抑制海分枝杆菌生长的发酵提取物视为阳性菌株。
(4)抗动脉粥样硬化(KLF2上调活性)[11] 利用本实验室前期建立的与动脉粥样硬化相关的KLF2模型对粗提物进行活性筛选。实验对象为KLF2-COS7细胞,利用10%胎牛血清DMEM培养基稀释消化后的处于对数生长期的COS7细胞,调整细胞浓度为5×105个/mL,同时瞬时转染KLF2质粒,接种到96孔板(150 μL/孔),4~6 h待细胞贴壁后,更换为5%胎牛血清DMEM培养基(200 μL/孔),每孔加入1 μL粗提物,18~24 h后检测。以荧光素酶为报告基因,EnVision多功能酶标仪检测荧光素酶与底物反应的发光强度,用相对发光单位(relative luminescence unit, RLU)的数值来表示。实验过程中设置空白对照孔,按公式:上调KLF2的倍数值=加药孔荧光强度/空白对照孔荧光强度得到样品的上调倍数,选取上调倍数大于1.5的样品认定为具有上调KLF2的活性。
(5)体外抑制胰腺癌细胞增殖活性测试[12] 将对数生长期的吉西他滨耐药胰腺癌细胞(Mia-Paca-2)用0.25%胰酶消化,调整细胞浓度为2.5×104个/mL。在96孔板中加入调整好浓度的细胞培养液,每孔
200 μL,用无血清的培养基封闭96孔板的周边,并将96孔板置于恒温培养箱中培养至对数期。用完全培养基将发酵提取物稀释5000倍作为药物溶液,将原培养液弃掉,每孔加入200 μL药物溶液。在细胞培养箱中继续培养48 h后MTT检测细胞存活水平。选取抑制率大于50%的认为具有活性。
1.2.7 发酵粗提物的HPLC及LC-MS检测
选取具有两种活性的菌株YBY-F2和YBY-F63的发酵粗提物进行HPLC和LC-MS检测。粗提物经甲醇溶解,微孔滤膜(0.22 μm)过滤后进行HPLC-DAD及LC-MS检测,观察样品的紫外吸收峰特征及分子量。HPLC分析条件:色谱柱(Cosmosil 5C18-PAQ,
5 μm, 4.6 mm×150 mm),流速(1 mL/min),洗脱条件[5%~50% ACN/H2O (0.1% TFA), 0~10.00 min; 50%~100% ACN/H2O (0.1% TFA), 10.01~35.00 min; 100%ACN, 35.01~40.00 min],时间:40 min;LC-MS分析条件:色谱柱(Cosmosil 5C18-PAQ,
5 μm, 4.6 mm× 150 mm),流速(1 mL/min),洗脱条件[5%~50% ACN/H2O (0.1% TFA), 0~10.00 min; 50%~100%ACN/H2O (0.1% TFA), 10.01~35.00 min; 100%ACN,35.01~40.00 min],时间:40.00 min。
2 结果与分析
2.1 真菌的生物学鉴定结果
从6份植物样品和3份沉积物中一共分离鉴定出164株真菌,通过菌落形态特征对比,BLAST检索相似性序列,以及SnapGene比对序列进行排重等分析测序结果,共鉴定出了106株真菌(图1、表2),它们分布在17个目33个科44个属。其中镰刀菌属(Fusarium)、青霉属(Penicillium)占比例最高,分别有13株,占总数的12.26%;其次是曲霉属(Aspergillus)有10株,占比达9.43%;炭疽菌属(Colletotrichum)共7株,占6.60%;其他属共66株,占59.45%(图1)。
其中菌株YBY-F80与有效发表菌株Guignardia sp.(KX065260.1)的相似度最高为99.64%,与有效发表菌株Phyllosticta carochlae(NR147354.1)的相似度为95.70%。另外,以rDNA- ITS基因序列为基础,采用邻接法(Neighbour Joining,N-J)构建的系统发育树中,菌株YBY-F80与叶点霉属(Phyllosticta sp.)有效发表菌株Phyllosticta alliacea (MT908519.1)、球座菌属(Guignardia sp.)有效发表菌株Guignardia camelliae (GU066668.1/GU066719.1/GU595026.1/JQ086349.1)以及Guignardia alliacea (MUCC0155)聚成一簇并形成一个独立的分支,结果如图2所示,因此推测菌株YBY-F80为叶点霉科球座菌属或叶点霉属的潜在新种。菌株YBY-F148与有效发表菌株Cylindrosympodium sp. (MK018951.1)的相似度最高为96.06%,与有效发表菌株Veronaeopsis simplex (LC632038.1) 的相似度为94.31%。另外,以 ITS rRNA基因序列为基础,采用邻接法构建的系统发育树中,菌株YBY-F148与有效发表菌株Cylindrosympodium variabile (NG 070448.1)聚成一簇并形成一个独立的分支, 结果如图3所示,因此推测菌株YBY-F148为Cylindrosympodium sp.的潜在新种。
2.2 真菌在样品中的分布
从各个样品得到的真菌数量如图4所示,从老鼠簕样本中获得了10株内生真菌;木榄样本1-3中获得内生真菌共44株;弯枝黄檀中得到内生真菌8株;从海泥沉积物样本7-9中共得到了45株真菌。对红树林植物和沉积物分离出的真菌种属和数量分别进行统计,发现从红树林植物中得到的菌株种属更为丰富(表3)。
2.3 活性筛选结果
2.3.1 抗菌活性筛选结果
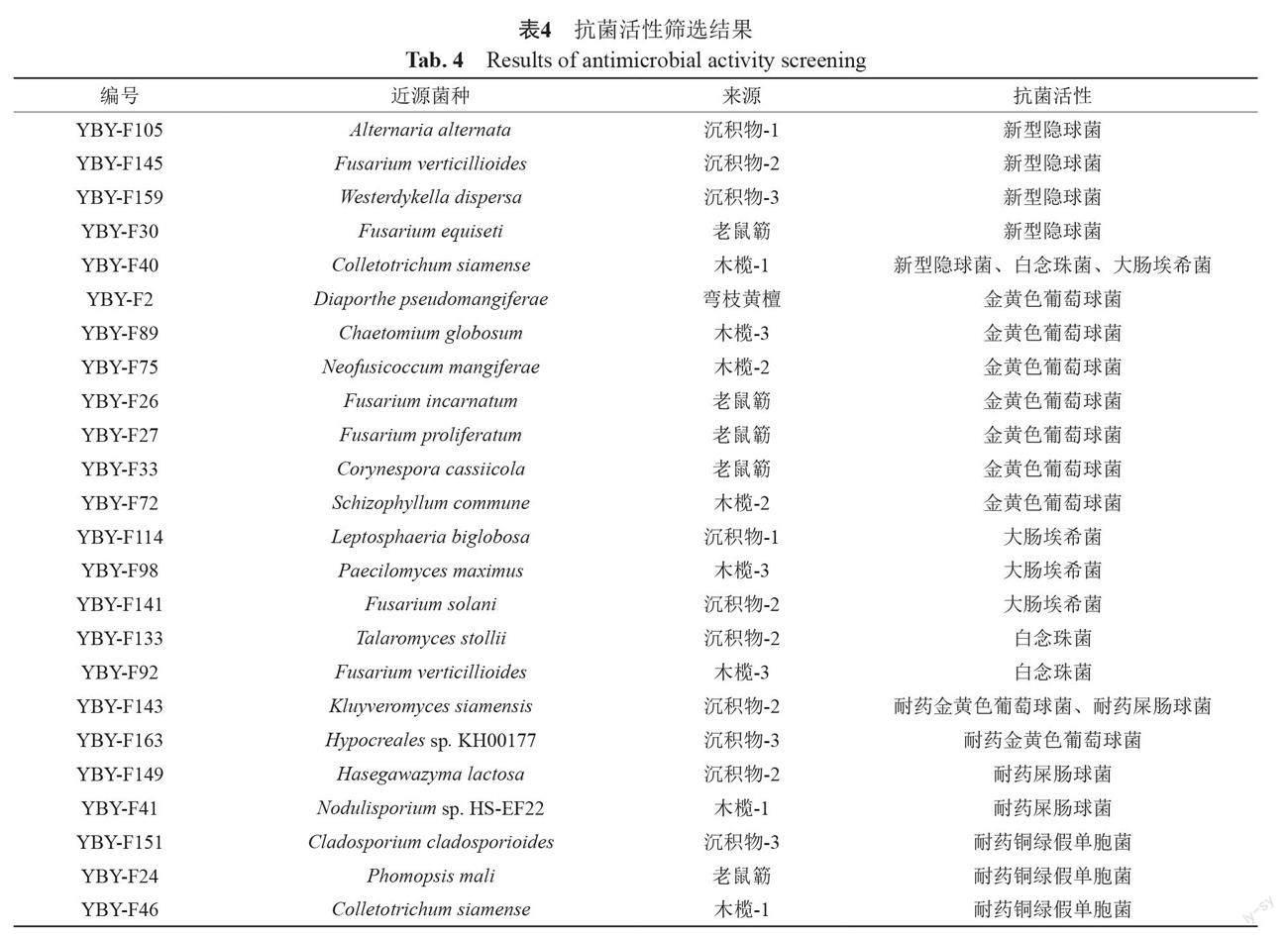
采用2种真菌(白念珠菌、新型隱球菌)、6种耐药菌(金黄色葡萄球菌181223、屎肠球菌310682、鲍曼不动杆菌、铜绿假单胞菌181230、大肠埃希菌181221、肺炎克雷菌181248)以及2种标准菌株(金黄色葡萄球菌ATCC25923、大肠埃希菌ATCC25922)对得到的106份粗提物进行抗菌活性筛选。
结果表明,粗提物在100 μg/mL时,至少对一株检定菌显示活性的共有24株,总阳性率为22.64%,结果如表4和图5所示。其中9株具有抗真菌活性,13株有抗革兰阳性菌活性,9株有抗革兰阴性细菌活性;特别值得关注的是,筛选到了对耐万古霉素屎肠球菌有抑制活性的菌株4株,对碳青霉烯类耐药铜绿假单胞菌具有抑制活性的菌株3株,这些研究结果为抗耐药菌抗生素的发现奠定了基础。
2.3.2 抗新冠病毒靶标筛选结果
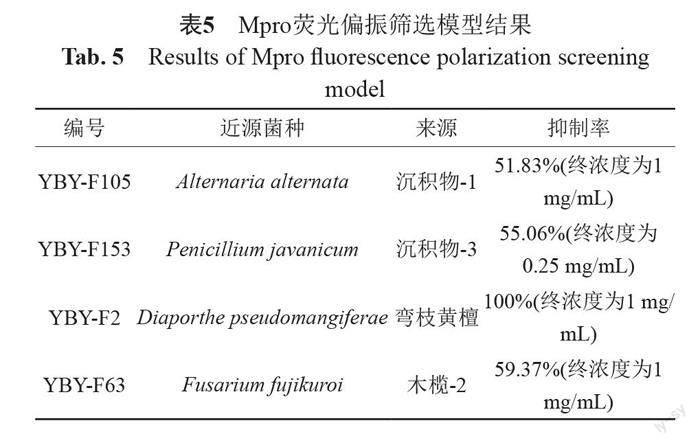
新冠病毒靶标Mpro蛋白抑制剂荧光偏振模型实验结果表明,共有6株真菌的发酵粗提物对Mpro蛋白活性的抑制率在50%以上,占总数的5.66%(表5)。
2.3.3 抗结核活性(海分枝杆菌)筛选结果
实验结果表明,有3株真菌粗提物在200 μg/mL时能够显著抑制海分枝杆菌的生长(肉眼看澄清),占总数的2.83%(表6)。
2.3.4 抗动脉粥样硬化(KLF2上调活性)筛选结果
实验结果表明,共有19株真菌粗提物在100 μg/mL
具有不同程度的KLF2上调活性(上调倍数大于1.5倍),占总数的17.92%,其中有4株的活性较为显著(上调倍数大于2倍),占总数的3.77%(表7)。
2.3.5 体外胰腺癌细胞毒活性筛选结果
实验结果表明,共有4株真菌粗提物在稀释5000倍后,体外对胰腺癌细胞(Mia-paca-2)增殖的抑制率在50%以上,占总数的3.77%(表8)。
2.4 菌株YBY-F2和YBY-F63发酵粗提物的HPLC和LC-MS检测结果
通过对YBY-F2粗提物进行HPLC分析,发现其主要包含3种类型的紫外吸收,即有2个类似吸收峰的最大紫外吸收在200 nm处;有至少2个类似吸收峰的最大紫外吸收在233和278nm处;有多个类似吸收峰的最大紫外吸收在271nm处(图6)。YBY-F63粗提物的HPLC分析结果表明,其主要包含五种类型的紫外吸收,有2个类似吸收峰的最大紫外吸收在230 nm处,有2个类似吸收峰的最大紫外吸收在282 nm处,有至少3个类似吸收峰的最大紫外吸收在260 nm处,有2个类似吸收峰的最大紫外吸收在207 nm处,有2个类似吸收峰的最大紫外吸收在270 nm处(图7)。同时也对该两株菌株粗提物进行了LC-MS分析,发现两株菌株的离子峰还是比较丰富的,YBY-F2在
m/z 300-500区间有多个离子峰(图8),而YBY-F63的LC-MS结果显示,其在m/z 700-800区间有多个离子峰(图9)。从这些结果看出,这两株菌均有丰富的次级代谢产物,值得进一步分离纯化,以期获得活性产物。
3 讨论
2001年,天然产物化学研究者在一株红树林植物来源真菌Xylaria sp.中发现了一类新颖骨架聚酮类化学成分xyloketals[13],以及2003年从一株红树林土壤来源放线菌Salinispora tropica中发现了一个对多株肿瘤细胞具有显著抑制作用的salinosporamide A(marizomib)[14],目前该化合物已先后被FDA批准为治疗多发性骨髓瘤和恶性神经胶质瘤的孤儿药进入Ⅲ期临床试验研究[15]。这些结果预示着红树林微生物中孕育着丰富的新颖独特结构及药用活性成分。近二十年来,人们已从红树林土壤和植物来源的微生物中获得了大量的新颖活性次级代谢产物,数据统计显示,其中85%的化学成分来源于真菌[4,16-18]。
海南东寨港红树林保护区是我国建立的第一个红树林保护区,有学者已从该保护区采集的14种真红树植物中分离得到146株放线菌,分布在18个属,并对部分菌株发酵液进行了抗菌活性测试,得到了40株具有抗菌活性的菌株,充分说明该区域红树林内生放线菌的多样性及药用开发价值[9]。而目前对于该保护区植物的内生真菌研究报道却较少。此前有学者对该保护区的两种红树林植物红海榄和秋茄内生真菌的多样性进行了考察[19],分别从红海榄和秋茄的枝、叶中分离到内生真菌30株和27株,优势属分别是茎点霉属Phoma和拟盘多毛孢属Pestalotiopsis,但文中并没有对所分离菌株进行药用活性的考察。鉴于此,本研究从该保护区采集了另外3种红树林植物(木榄、老鼠簕和弯枝黄檀)和木榄植物周围沉积物共7份样品,从中分离得到164株真菌,鉴定并排重后为106株真菌,它们分布在17个目34个科43个属,其中菌株YBY-F80为叶点霉科球座菌属或叶点霉属的潜在新种,菌株YBY-F148为Cylindrosympodium sp.的潜在新种。
木榄(Bruguiera gymnorrhiza)为我国传统药用红树植物,其树皮、叶和果实均可入药。木榄叶在民间主要用于治疗疟疾,而树皮可用于治疗咽喉肿痛、泄泻腹痛等。现代药理研究表明木榄有抗肿瘤、抗真菌和抗病毒等药理作用[20]。近些年对木榄来源微生物(根际土壤及其内生环境)的次级代谢产物也有研究。Bin-Gui Wan等在木榄叶中发现一株枝状枝孢菌(Cladosporium cladosporioides MA-299),并从中发现了5个新的聚酮类化合物[21]以及4个新的少见的C-2硫取代的十二元环大环内酯类化合物[22],其中新化合物Cladospolide G对两株植物病原菌Glomerella cingulate和Fusarium oxysporum f. sp. Cucumerinum的MIC值均为1 μg/mL[21]。Yue-Wei Guo研究团队从木榄茎中得到一株青霉属真菌Penicillium sp. GD6,发现其乙酸乙酯提取物对Staphylococcus aureus的MIC值为6.4 μg/mL,经过一系列的色谱分离纯化,从中发现了一类新颖骨架的吡咯里西啶类化合物penibruguieramine A,但因为该化合物量少的原因并未进行抗菌活性测试[23]。本研究中对木榄茎、叶和树皮的内生真菌发酵提取物进行了多种抗菌活性测试,共从中得到抗新型隐球菌、抗耐药屎肠球菌和抗耐药铜绿假单胞菌活性菌株各1株,抗白念珠菌和抗大肠埃希菌活性菌株各2株,抗金黄色葡萄球菌活性菌株3株。此外,本研究还从木榄来源内生真菌中发现1株镰刀菌属真菌YBY-F63能够抑制海分枝杆菌的生长和抑制新冠病毒靶标Mpro的活性,以及1株球毛壳属真菌YBY-F97和1株炭角菌属真菌YBY-F90能够抑制胰腺癌细胞(Mia-paca-2)的增殖。
老鼠簕(Acanthus ilicifolius L.)具有清热解毒、消肿散结、止咳平喘之功效,在我国海南民间广泛将其用作治疗乙型肝炎的特效药[24]。老鼠簕提取物具有保肝、抗菌、镇痛、抗肿瘤和抗氧化等药理活性,目前已从中分离鉴定出生物碱、黄酮类、苯乙醇苷、木脂素、三萜和甾醇等近百种成分,并发现部分生物碱具有显著的保肝作用[25]。2007年,洪葵研究团队从老鼠簕中总共分离到27株放线菌、44株细菌以及26株真菌,并从中获得了一些抗细菌、真菌以及细胞毒性菌株[24]。近期,我国学者从中国南海海岸的老鼠簕茎和叶,以及其根际土壤中分离得到102株真菌,优势菌属为青霉属、曲霉属和镰刀菌属,并对其中55份PDA粗提物进行了多株肿瘤细胞的细胞毒性试验,发现31株菌株在50 μg/ml时有细胞毒性。利用活性导向以及指纹分析技术,他们从一株青霉属真菌Penicillium sp. (HS-N-27)中分离得到了一个具有显著细胞毒性的化学成分brefeldin A,其对A549、HeLa和HepG2细胞的IC50值分别为101.2、171.9和239.1 nmol/L [25]。数据统计显示,至2020年12月,共从老鼠簕来源的22株真菌中分离得到了95个新的次级代谢产物[25]。因此,老鼠簕的内生真菌是天然产物研究者比较感兴趣的研究对象之一。本研究从老鼠簕茎和叶中分离得到了10株内生真菌,并对其发酵提取物进行了广泛活性筛选,得到5株具有抗菌活性的菌株,1株抑制海分枝杆菌生长的菌株,以及2株能够上调抗动脉粥样硬化靶标KLF2活性的菌株,但并没有发现对胰腺癌细胞株具有显著细胞毒性的菌株。
此外,弯枝黄檀(Dalbergia candenatensis)为豆科植物,多年生草本,常攀附于红树植物上,有强筋活络、破积止痛之功效[26]。对于该植物的化學成分及其药理活性报道较少,仅有国外学者从泰国的弯枝黄檀分离得到了一些具有抗菌活性的异黄酮类[27],以及具有轻微细胞毒性的黄烷类和其他一些酚类化合物[28]。本研究首次对弯枝黄檀的叶进行了其内生真菌的研究,从中得到7株内生真菌,并发现其中YBY-F2菌株能够抑制金黄色葡萄球菌和抑制新冠病毒靶标Mpro的活性,以及YBY-F4能够上调KLF2的活性。
本研究虽然对海南东寨港红树林保护区的3种红树林植物及木榄植株周围的沉积物进行了真菌的分离,并对菌株的大米发酵粗提物进行了广泛的活性筛选,得到了一些具有药理活性的菌株。研究结果一定程度地表明了海南东寨港红树林保护区中存在种类丰富、活性多样的药用真菌资源,具有发现真菌新物种及新药用活性分子的潜力。但本研究选取的红树林植物和沉积物样本在丰富度上有一定的局限性,因此, 海南东寨港红树林保护区中红树林植物内生真菌的多样性及其药用活性还有很大潜力值得挖掘,为天然产物研究工作者探寻红树林植物及其内生菌的关系提供更多的微生物资源和数据支撑。
參 考 文 献
Wu J, Xiao Q, Xu J, et al. Natural products from true mangrove flora: Source, chemistry and bioactivities[J]. Nat Prod Rep, 2008, 25(5): 955-581.
董治统, 闫晶晶, 彭方, 等. 红树林、海洋沉积物及北极3种不同生境真菌的分离及代谢产物活性筛选[J]. 中国抗生素杂志, 2017, 42(4): 277-283.
Cribb A B, Cribb J W. Marine Fungi from Queensland[M]. Brisbane: University of Queensland Press, 1955: 10-21.
Ancheeva E, Daletos G, Proksch P. Lead compounds from mangrove-associated microorganisms[J]. Mar Drugs, 2018, 16(9): 319-350.
Poch G K, Gloer J B. Helicascolides A and B: New lactones from the marine fungus Helicascus kanaloanus[J]. J Nat Prod, 1989, 52(2): 257-260.
Chen S, Cai R, Liu Z, et al. Secondary metabolites from mangrove-associated fungi: source, chemistry and bioactivities[J]. Nat Prod Rep, 2022, 39(3): 560-595.
Cadamuro R D, Da Silveira Bastos I M A, Silva I T, et al. Bioactive compounds from mangrove endophytic fungus and their uses for microorganism control[J]. J Fungi (Basel), 2021, 7(6): 455.
Nicoletti R, Salvatore M M, Andolfi A. Secondary metabolites of mangrove-associated strains of Talaromyces[J]. Mar Drugs, 2018, 16 (1): 12.
李静, 戴素娟, 庹利, 等. 海南东寨港真红树植物内生放线菌多样性及其抗菌活性[J]. 微生物学通报, 2016, 43(8): 1753-1765.
Yan G, Li D, Lin Y, et al. Development of a simple and miniaturized sandwich-like fluorescence polarization assay for rapid screening of SARS-CoV-2 main protease inhibitors[J]. Cell Biosci, 2021, 11(1): 199.
肖同美, 毛梦佳, 雷丽娟, 等. 多枝柽柳内生真菌Talaromyces stollii的次级代谢产物研究[J]. 中国抗生素杂志, 2022, 47(5): 474-480.
Wang J, Chen M, Wang M, et al. The novel ER stress inducer Sec C triggers apoptosis by sulfating ER cysteine residues and degrading YAP via ER stress in pancreatic cancer cells[J]. Acta Pharm Sin B, 2022, 12(1): 210-227.
Lin Y, Wu X, Feng S, et al. Five unique compounds: xyloketals from mangrove fungus Xylaria sp. from the South China Sea coast[J]. J Org Chem, 2001, 66(19): 6252-6256.
Feling R H, Buchanan G O, Mincer T J, et al. Salinosporamide A: A highly cytotoxic proteasome inhibitor from a novel microbial source, a marine bacterium of the new genus Salinospora[J]. Angew Chem Int Ed, 2003, 42, 355-357.
Bauman K D, Shende V V, Chen P Y T, et al. Enzymatic assembly of the salinosporamide γ-lactam-β-lactone anticancer warhead[J]. Nat Chem Biol, 2022, 18(5): 538-546.
Wang K W, Wang S W, Wu B, et al. Bioactive natural compounds from the mangrove endophytic fungi[J]. Mini Rev Med Chem, 2014, 14(4): 370-391.
Nicoletti R, Salvatore M M, and Andolfi A. Secondary metabolites of mangrove-associated strains of Talaromyces[J]. Mar Drugs, 2018, 16: 12.
Deshmukh S K, Gupta M K, Prakash V, et al. Mangrove-associated fungi: A novel source of potential anticancer compounds[J]. J Fungi (Basel), 2018, 4(3): 101.
吳尚英, 张洋, 刘爱荣, 等. 红树林植物红海榄和秋茄的内生真菌多样性[J]. 浙江林学院学报, 2010, 27(4): 489-493.
谢蕾卉, 侯小涛, 邓家刚, 等. 木榄化学成分和药理活性研究进展[J]. 中国实验方剂学杂志, 2018, 24(21): 10.
Zhang F Z, Li X M, Li X, et al. Polyketides from the mangrove-derived endophytic fungus Cladosporium cladosporioides[J]. Mar Drugs, 2019, 17, 296.
Zhang F Z, Li X M, Yang S Q, et al. Thiocladospolides A-D, 12-membered macrolides from the mangrove-derived endophytic fungus Cladosporium cladosporioides MA-299 and structure revision of pandangolide 3[J]. J Nat Prod, 2019, 82, 1535-1541.
Zhou Z F, Kurtán T, Yang X H, et al. Penibruguieramine A, a novel pyrrolizidine alkaloid from the endophytic fungus Penicillium sp. GD6 associated with Chinese mangrove Bruguiera gymnorrhiza[J]. Org Lett, 2014, 16(5): 1390-1393.
王蓉, 洪葵. 老鼠簕根际内生菌分离与活性评价[J]. 微生物学杂志, 2007, 27(3): 24-26.
李元跃, 刘韶松, 高苏蕊, 等. 红树植物老鼠簕的化学成分和药理活性研究进展[J]. 集美大学学报(自然科学版), 2021, 26(6): 489-500.
王文卿, 张琳婷, 钟才荣. 海南红树林植物图谱[M]. 海南东寨港国家级自然保护区管理局. 2015.
Cheenpracha S, Karalai C, Ponglimanont C, et al. Candenatenins A-F, phenolic compounds from the heartwood of Dalbergia candenatensis[J]. J Nat Prod, 2009, 72(8): 1395-1398.
Hamburger M O, Cordell G A, Tantivatana P, et al. Traditional medicinal plants of Thailand, Ⅷ. Isoflavonoids of Dalbergia candenatensis[J]. J Nat Prod, 1987, 50(4): 696-699.
Hu Z, Ye Y, Zhang Y. Large-scale culture as a complementary and practical method for discovering natural products with novel skeletons[J]. Nat Prod Rep, 2021, 38(10): 1775-1793.
收稿日期:2022-09-07
基金项目:中国医学科学院医学与健康科技创新工程经费资助(No. 2021-I2M-1-028);国家自然科学基金(No. 81302675)
作者简介:闫璧滢,女,生于1997年,在读硕士研究生,E-mail: yanbiying@163.com
通讯作者,E-mail: chenminghua@imb.pumc.edu.cn
