细菌生物膜抵抗消毒剂的研究进展
2023-05-30罗欢王炜捷李玮玮郭银莉刘伟佳卢嵘薛云新王岱赵西林
罗欢 王炜捷 李玮玮 郭银莉 刘伟佳 卢嵘 薛云新 王岱 赵西林

摘要:细菌生物膜(biofilm)是一種被自身细胞外基质包裹在内的细菌群落。生物膜可增加细菌对传统消毒剂的抗性,是导致院内患者反复感染、威胁食品工业安全的主要原因之一,对公共卫生健康造成了严重影响。尽管现有研究对细菌生物膜介导的消毒剂抗性进行了大量报道,但研究的系统性和深度仍有待加强。为此,本文将细菌生物膜通过限制消毒剂扩散、细菌适应性调节、群体感应等方式对消毒剂产生抗性的机制进行综述,并总结概括了目前较有应用前景的生物膜消除策略,以期为后续深入研究及策略设计提供思路。
关键词:细菌生物膜;消毒剂;抗性
中图分类号:R978.1文献标志码:A
Research progress on the resistance of bacterial biofilms to disinfectants
Luo Huan, Wang Wei-jie, Li Wei-wei, Guo Yin-li, Liu Wei-jia, Lu Rong, Xue Yun-xin, Wang Dai, and Zhao Xi-lin
(State Key Laboratory of Molecular Vaccinology and Molecular Diagnostics, School of Public Health, Xiamen University, Xiamen 361102)
Abstract Bacterial biofilm is a micro-community of bacteria surrounded by their own extracellular polymeric substrates (EPS). Biofilm can increase the resistance/tolerance of bacteria to traditional disinfectants, and is one of the main reasons that cause recurring infections of hospital patients and threaten the safety of the food industry, thus causing serious impacts on public health. Although existing studies have reported a large number of bacterial biofilm-mediated resistance/tolerance to disinfectants, the scope and the depth of research still need to be strengthened. To this end, this article reviews the mechanisms by which bacterial biofilms resist/tolerate disinfectants by restricting the diffusion of disinfectants, adaptive adjustment of bacteria, quorum sensing, etc., and summarizes some promising strategies currently under exploration for biofilm elimination, with the hope to provide guidance for follow-up, in-depth research and strategic designs.
Key words Bacterial biofilm; Disinfectant; Resistance
消毒是限制和减少细菌传播、控制病原微生物感染的主要策略之一,在医疗、食品、工业生产、生活环境等方面都起到了重要作用。消毒剂产品一直是医疗卫生、工农业生产和日常生活的必需品,目前由于新型冠状病毒(COVID-19)在全球范围内肆虐,其需求量加大[1-2],这必然会造成消毒剂大量使用甚至滥用,促使消毒剂抗性细菌的产生及传播,反而对公共医疗卫生产生一定威胁[3]。消毒剂使用过程中,细菌可通过一系列机制抵抗应对消毒剂的作用,包括形成生物膜、改变膜表面渗透性、多药外排泵的主动外排、酶失活、靶基因修饰或产物过度表达、获得新的代谢途径、质粒介导等[4]。细菌因生物膜形成而导致的消毒剂抗性已造成多方面的经济损失和环境影响,食品工业和医疗环境中的生物膜控制对于公共卫生是一项艰巨任务[5],尤其是可产生生物膜的病原菌被认为是慢性和急性感染发生的主要原因[6]。研究表明,细菌生物膜(简称生物膜)可通过多种机制抵御消毒剂的杀伤作用,本文将对目前生物膜产生消毒剂抗性的机制进行综述,并概括较有应用前景的抗生物膜策略,为寻找合理有效的生物膜预防和临床治疗方法提供思路。
1 生物膜的形成及其影响因素
细菌生物膜的形成是自然界普遍存在的一种现象,据估计超过90%的细菌存在于生物膜中[7]。生物膜泛指微生物附着于接触表面,通过分泌多糖、脂质、蛋白质、多肽和胞外DNA等组成细胞外聚合物基质(Extracellular polymeric substrates, EPS),并将自身包裹在其中的一种群落聚集体[5]。生物膜的形成周期涉及3个主要阶段:①游离细菌的初始附着;②生物膜形成并进入成熟阶段,开始产生EPS,促进多层细胞簇形成;③细菌从生物膜分散、进入游离状态,在别处启动新的一轮生物膜生成循环[8]。一方面,生物膜形成过程受pH、温度、湿度、营养条件、氧化压力和NaCl浓度等多种环境因素的调节;另一方面,生物膜固有的生活方式及结构形态可为细菌提供多种生长优势,如帮助自身平衡温度、pH和渗透压,减弱紫外线照射,增加养分可用性,增强代谢和促进基因转移等。因此,与游离状态相比,细菌形成生物膜后能更好适应环境[9]。
2 生物膜对消毒剂的抵抗机制
目前常用于清除生物膜的消毒剂包括应用最广的季铵盐类,以及卤素类、过氧化物类、醛类、酚类和醇类[10]。与具有特定靶标的抗生素不同,消毒剂往往可针对多种细胞组分同时发生作用,根据消毒剂各自特性,包括破坏细胞壁和细胞膜、蛋白质变性与酶失活、干扰代谢和电荷相互作用等(表1)[11-12]。一般认为,生物膜内细菌对消毒剂的抵御能力由多种因素造成,但抗性(resistance)和耐受(tolerance)机制会因消毒剂类别、细菌种类、生物膜厚度、生长阶段及环境的不同而变化[13-14]。另一方面,细菌对消毒剂和抗生素的耐受往往具有共性,即当对消毒剂产生耐受时也能对抗生素耐受,这将促进多重耐药菌的产生,进一步增加了清除生物膜的难度[15-16]。
关于细菌对消毒剂抗性的概念目前有很多描述,通常是指出现了某些对常用浓度不再敏感,处理后仍能存活或繁殖的菌株,但尚未形成统一和明确的定义。就已有的研究报道,细菌生物膜对消毒剂的抗性不仅指细菌发生了遗传性变化,而且对外界刺激也表现出一定的耐受性,因此,生物膜抗性是一种细菌在特定环境下繁殖时暂时或永久获得的能力[5,17]。生物膜对消毒剂的抗性机制目前有如下解释。
2.1 消毒剂在生物膜中的扩散限制
2.1.1 物理条件
初始表面附着是细菌从游离态过渡到生物膜的转折点,分可逆和不可逆两个阶段;在可逆附着中,生物膜细胞通过静电、范德华力和氢键力与固体表面的内聚力和黏附力进行单极松散连接,并且很容易分离并返回到游离状态[5,7],此时阳离子消毒剂对带负电荷的生物膜有较好的亲和力,由于电荷相互作用,消毒剂仅聚集于生物膜外层,不能完全进入整个生物膜到达靶标部位发挥有效作用[18]。生物膜的厚度也是限制消毒剂分子扩散的一种因素,这主要是因为生物膜形成的三维结构促使细菌直径厚度增大,导致消毒剂分子渗透生物膜的时间加长或无法进一步渗透而使得消毒剂功效受限[19]。由阻碍渗透引起的耐受性可能只是暂时的,但是它可能让细菌有足够的时间适应更耐受的状态。在不可逆黏附阶段,细菌逐步进入成熟和脱离状态,附着的细菌开始分泌細胞外基质与黏附载体共价结合,逐渐形成牢固的附着。此外,细菌其他特殊结构如肽聚糖、蛋白质、菌毛和荚膜等也可能限制消毒剂的膜内扩散,构成了影响消毒剂进入生物膜的第一道关卡[20]。
2.1.2 细胞外基质
成熟生物膜的形成和维持与过程中产生的EPS密切相关,EPS一般包含胞外多糖、脂质、蛋白质、磷壁酸和胞外DNA等成分,且会随着菌株类型和环境条件而不同[21]。EPS具有多种生物学功能,可帮助生物膜抵抗多种外界不利环境以及消毒剂等抗菌剂,例如可减轻宿主细胞内对细菌有毒物质的作用(胆汁盐、水解酶、溶菌酶、胃酶/胰酶、金属离子、抗菌剂等)和环境压力(温度、pH、渗透压变化等),也有助于细菌逃避免疫反应和噬菌体攻击等[22]。
EPS参与生物膜抵抗性的具体机制包括:①生物膜的多层细胞和EPS可构成一个复杂而紧凑的结构,在该结构中,EPS进一步阻碍消毒剂渗透到达内层,从而削弱其功效[14,17];②EPS中的糖被是一种阴离子聚合物,其作用类似于离子交换树脂,厚度在0.2到1.0 μm不等[22]。糖被中的糖蛋白及多糖的多种结构、特性和作用对于生物膜的形成有许多益处,包括帮助细菌黏附、提供养分、保护生物膜结构进而抵抗各种消毒剂压力[23];③EPS中酶催化机制,如过氧化氢酶和超氧化物歧化酶,这些酶通常可针对某种或某类消毒剂起作用,尤其是氧化剂类、醛类和重金属类的消毒剂[24-26]。这种酶促机制,在消毒剂发挥作用之前将其分解,从而降低抗菌剂的活性。因此,阻断这种酶促过程可能会抑制生物膜的产生,使生物膜细胞重新对消毒剂敏感[27]。
EPS的基质成分还可能通过对细菌表面进行修饰、阻碍细菌初始附着,或充当信号分子调控参与生物膜形成的基因表达来干扰生物膜活性[28-29],并且在混合物种产生的生物膜中,EPS成分不仅可以增强自身的消毒剂抗性,还可为它们的伴生共存菌株提供保护。因此,EPS成分的存在极大地助力了生物膜对消毒剂抗性的产生。
2.1.3 多物种混合生物膜
生物膜存在的外界环境往往很复杂,自然环境中不同种群细胞间的相互作用很可能会影响生物膜群落各成员的生长、存活,以及它们潜在的毒力,进而影响这些结构的整体致病性[30]。多物种生物膜通常对消毒剂具有同等或更高的抵抗力,例如在慢性感染相关疾病中,囊性纤维化患者的肺、慢性伤口或泌尿道等天然组织中多种病原菌的定植,经常会引起更严重和顽固的感染[31];铜绿假单胞菌或白念珠菌的存在会诱导金黄色葡萄球菌毒力因子的上调[32-33]。但并非所有物种间的组合都是有利的,如Maricarmen等[34]发现金黄色葡萄球菌的存在会促使沙门菌生物膜的形成,但采用常用的过氧乙酸、次氯酸钠等处理时,双物种形成的生物膜反而对消毒剂更敏感。
整体而言,消毒剂对生物膜的效率会因消毒剂特性、生物膜形成表面的性质、微生物类型以及其他因素(如温度和暴露时间)而有很大差异。具体到多物种生物膜较单一物种生物膜对消毒剂的抗性优势[35-36]原因包括以下3点:一是因为多种菌群共存时物种的差异性可能会改变EPS基质的组成和黏度,有利于EPS形成更加致密的结构,使消毒剂扩散反应进一步受限,更难透过复杂的EPS基质进入生物膜的最深层[14,37],比如产志贺毒素的大肠埃希菌和鼠伤寒沙门菌混合形成的生物膜增强了对季铵化合物或氯消毒剂的抵抗力[38-39];二是与某一物种产生有益于整个种群的特定成分有关[40],例如铜绿假单胞菌分泌的特定水解酶赋予混合群落对SDS(一种阴离子表面活性剂)的耐受性[41];三是物种之间存在代谢交叉供给,可以促进生物膜细胞的生长并提高它们的存活率,推动生物膜的生态优势[42]。例如好氧硝化菌和厌氧反硝化菌的空间组织和分层帮助它们共同代谢和降解有毒化合物[43]。
此外,多物种病原菌间的相互作用会促进基因水平转移,导致新的基因组合并促进抗性基因的传播。解决多物种形成的混合生物膜已成为疾病治疗及食品安全的挑战性难题[30]。
2.2 生物膜内细菌的适应性机制
生物膜内的细菌采用一系列利己生存机制来抵抗消毒剂的致死作用,包括遗传性和非遗传性(适应性)耐药/耐受机制,其中“缓慢”增殖导致的持留现象[44]、亚抑制浓度药物引发的表型适应性,以及在DNA损伤修复过程中阻止细胞分裂的SOS反应、氧化应激反应等均是生物膜细菌常见的适应性机制。这些机制单独或协同作用,导致生物膜细胞对消毒剂的反应方式与游离菌截然不同,保护细菌免受各种不同的外界压力[45]。
2.2.1 亚致死浓度药物下的表型适应性
亚致死浓度下的消毒剂不能有效去除生物膜,甚至生物膜内细菌在长期低浓度消毒剂的刺激下会产生适应性[46],如亚抑制浓度的苯扎氯铵可刺激金黄色葡萄球菌、无乳链球菌和单核细胞增生李斯特菌的抗性,提高生物膜的形成能力[47-48]。这些表型适应可能源于特定基因对其所处微环境的直接反应,导致在持续暴露后,生物膜细菌对消毒剂的适应性比游离菌更好,在这种情况下,脂肪酸组成发生变化,参与能量代谢、蛋白质生物合成、适应和解毒的特定蛋白质会上调[45,49]。尽管已有大量研究表明亚致死浓度的抗生素或消毒劑会促使细菌耐药性及生物膜的产生,但在过去的几年里,研究更多地集中在抗菌剂的杀菌活性及产生耐药性的机制方面,而对于亚抑制状态下的生物膜耐受机制研究相对较少。
2.2.2 生物膜内细菌的持留现象
细菌对消毒剂的敏感性还取决于所处的生理状态。持留菌是常规细菌细胞的休眠变体,该细胞亚群表现出短暂的可逆表型,可在持久性状态和易感状态相互转换,在消毒剂处理下既不生长也不死亡,而最小抑菌浓度(minimum inhibitory concentration,MIC)保持不变[45]。持久性机制受多种环境条件的影响,例如营养缺乏、高温、极端pH值和群体感应信号诱导等[50]。因此生物膜内很可能同时包含处于多种状态的细胞(例如生长期、静止期、滞后期、应激适应、休眠期)。
细菌对消毒剂的敏感性取决于所处的生理状态,持留现象与生物膜内抵抗力的增加相关,是导致医疗环境中严重慢性、复发性疾病的重要原因。Soares等[51]研究发现铜绿假单胞菌的耐受性是由处于持留状态的耐受细胞亚群介导,而不是抗性突变体。研究表明,这种生物膜细胞的代谢状态和增长率的异质性是生物膜对消毒剂耐受性的重要因素,与生物体中特定基因组的差异表达有关[52]。并且细菌的生长速度和代谢活动受到生物膜内营养物质和氧气可用性差异的影响,一般消毒剂会优先杀死代谢活跃的细菌。而在生物膜内部,细菌生长速度缓慢或处于休眠状态,其细胞酶合成受阻,导致细菌对消毒剂不太敏感,进而保护它们免受消毒剂的杀灭作用,当生物膜中的敏感细菌被杀死时,部分休眠体持续存在,这些持留菌在恢复生长后将再次形成生物膜[45]。
2.2.3 应激反应
应激反应是细菌的另一种适应性策略,使细菌能够快速应对不断变化的环境条件并确保其生存。其主要方式包括:细胞中的结构修饰,遗传调节机制介导的遗传物质交换和基因变异、多药外排、启动稳态系统、诱导损伤修复蛋白的合成、激活特定应激酶系统,以及改变胞膜通透性和促进生物膜的形成等[53]。营养缺乏、高低温、厌氧环境、较高的渗透压和酸性环境及活性氧的产生都会诱导细菌应激反应,影响细菌的代谢活动。应激条件下氧化应激反应蛋白水平升高,可能导致生物膜对消毒剂作用的抵抗力增加[5,54],表明生物膜可能是一个比外界游离菌更耐受氧化应激的环境,这在单核李斯特菌、铜绿假单胞菌、大肠埃希菌等的生物膜抗性研究中均得到证实[17,53,55]。
细菌调节基因表达并介导生物膜形成也是生物膜内在抗性的标志机制之一,同时在生物膜生长的过程中,生物膜也为遗传物质交换提供了最佳环境。研究表明,生物膜环境中的高密度细胞、EPS成分、大量DNA的释放或膜内的营养条件会促进基因表达或基因突变[56],如Pang等[57]研究发现,在季铵类消毒剂的压力作用下,沙门菌生物膜细胞发生应激反应导致EPS成分多糖产量增加,调控纤维素的基因(csgD、adrA和bcsA)表达量上调,以此形成更加致密结实的生物膜。应激反应也是增强特定毒力因子表达的一个重要因素,参与调节某些食源性病原体的致病性状[58]。全局应激调节子RpoS可调节菌毛操纵子CsgD在生物膜形成中的表达,这些是影响生物膜形成和表面黏附、毒力的重要因素,并进一步影响生物膜对消毒剂的抗性[59-60]。另外,不同的应激环境促使的遗传突变会诱导生成更具抗性的亚群,这将增强整个种群在压力条件下的适应性。Veen等[61]研究发现主要转录调节因子sigB突变后细菌对消毒剂苯扎氯铵和过氧乙酸具有明显抵抗力,Luján等[62]研究发现铜绿假单胞菌错配修复系统缺陷后,其生物膜的形态变异介导对消毒剂更高的耐受性,且这种由基因变异引起的生物膜表型差异在各类菌株中普遍存在。此外,对于具有特定作用靶标的消毒剂,应激环境下靶基因的突变也会改变菌群的敏感性,使得大多数消毒剂对其功能失效,如三氯生靶向FabI酶,fabI基因突变导致其编码蛋白不能与三氯生有效结合介导了突变株对三氯生的高水平抗性[63]。
多药外排作为细菌应激的一般作用方式,是细菌最普遍的内在耐药机制之一。通常,外排泵通过从细胞中排出药物,将细胞内药物浓度降低到亚抑制浓度,使细菌可在常规治疗剂量下生长[64]。外排泵底物多样,包括抗生素、消毒剂、染料、毒素和有害产物等,外排泵的正常表达有利于维持生物膜的形成[65]。据目前研究,外排泵在生物膜形成中至少发挥四种不同的作用:促进EPS形成和调节群体感应;间接调控参与生物膜形成的基因;控制有害物质的流出,如抗菌剂和代谢产物;并通过促进或阻止自身细胞或其他细胞与接触表面的黏附来影响胞膜聚集[66]。有研究发现,大肠埃希菌多耐药转运蛋白(multidrug resistance transporters)外排基因acrA、acrB和tolC缺失时,EPS生成量降低,生物膜的形成能力明显减弱,而acrD、acrE、emrA等基因缺失时其生物膜生长和抗菌素耐药性能力增强[67],耐苯扎氯铵的鼠伤寒沙门菌耐受突变体中检测到外排蛋白AcrAB或AcrEF的过表达[68]。但并不是所有情况下外排泵的缺失或过表达均会对生物膜形成有利,这取决于外排泵基因在生物膜的形成过程中是否起关键作用。部分外排泵基因的缺失、突变或过表达会减弱生物膜的形成能力,如铜绿假单胞菌MexEF-OprN外排泵的过表达可能会降低细胞中群体感应信号的胞内浓度,从而降低其群体反应,导致生物膜形成能力减弱[67]。这些研究表明,一些外排泵可能通过调控参与生物膜形成的外排基因的表达来影响生物膜的形成[69]。
整体而言,外排泵对生物膜介导的抵抗力是通过多种因素实现的,生物膜的形成过程中需要不同的外排系统参与调控,因为抑制了一种外排泵会导致其他外排泵的补偿性表达。外排泵是否是细胞初始附着、生物膜成熟或生物膜维持所必需的,仍存在争议,有待进一步研究[66]。
2.3 群体感应
群体感应(quorum sensing,QS)信号,又称为自诱导剂(autoinducer),是细菌调节行为和细胞间通讯的一种信号方式。通常发生在细菌物种内部以及细菌和其他微生物之间,对于细菌在各种环境中的生存至关重要[5,14,70-71],也是调节生物膜生成的重要因素。革兰阴性菌和革兰阳性菌具有一系列不同的QS系统,革兰阴性菌通常使用酰基高丝氨酸内酯(acyl homoserine lactone,AHL)或其他衍生自S-腺苷甲硫氨酸的分子作为群体感应信号[72]。革兰阳性细菌通常使用分泌的寡肽,统称为自诱导肽(autoinducing peptides),作为QS的信号分子[66]。
这些QS信号通过控制与生物膜形成、黏附、代谢和毒力相关的基因表达来调节生物膜的抵抗抗菌剂能力[70-71]。在生物膜形成过程中,其第二信使腺苷-3',5'-环化一磷酸(cAMP)和双-(3'-5')-环状二聚鸟苷单磷酸(c-di-GMP)是将环境因素与基因调控联系起来的关键信号因素,各种环境因素和QS交流机制会促使细胞中c-di-GMP水平升高[73],产生黏附素并降低生物膜扩散,有助于EPS的分泌,增加生物膜的产生,从而对消毒剂产生高抗性[74]。
在生物膜成熟和毒力因子方面,抗菌剂会影响QS基因的表达水平[75]。有研究发现QS基因缺陷菌株可能会增强生物膜以及毒力的表达,不仅能够加强感染力,且对抗菌剂变得不太敏感[76]。QS系统还介导降解酶的合成,如在铜绿假单胞菌细胞间信号传导机制中,控制超氧化物歧化酶和过氧化氢酶基因的表达,介导对过氧化氢的抗性[77]。此外,在合适的营养供应和环境中,群体感应介导的基因表达在细胞迁移中至关重要,并且还可以保护细菌细胞免受有害环境的影响,这些研究表明,群体感应系统对生物膜抵抗消毒剂有着直接或间接作用[5]。
3 消除生物膜的新策略
综上所述,导致生物膜对消毒剂产生抗性的原因复杂多样,传统的消毒剂存在细菌泛耐药、清除生物膜不彻底、稳定性差、严重污染环境等缺点,在临床及生活环境应用中极其受限。一方面需要合理规范使用消毒剂,另一方面为了应对多种生物膜感染并提高消毒剂的效率,研究者们也提出了新的方法来控制和根除生物膜[78]。目前有前景的提高消毒剂抗生物膜效率的方法主要是给消毒剂添加辅助剂或联合用药,以弥补当前单一消毒剂的用药缺陷[79],包括有消毒剂与酶[80]、天然植物分子[81-82]、纳米材料[83-84]及与其他消毒剂[85-86]的联合应用。
其中消毒剂与一些天然植物化学物质结合,开发设计群体感应抑制剂(quorum sensing inhibitors, QSIs)被认为是开发新型抗生物膜药物的突破口。当前天然植物化学物质(如酚类、精油、萜类、凝集素、生物碱、多肽和黄酮类等)已成为干扰群体感应系统的新治疗靶点[87-89]。研究表明阻断群体感应系統,通过抑制群体感应基因表达,阻断EPS的形成或扩散、减少毒力因子的产生,这将阻碍生物膜结构的早期黏附和后期的成熟脱落,从而阻断生物膜的发展[90-91],并提高消毒剂的作用效果,如桉油与氯己定、次氯酸钠与鼠尾草等植物精油结合对杀菌及清除生物膜具有协同作用[92-93]。天然药物成分结构复杂,具有多组分和多靶点的特性,有助于恢复传统消毒剂的杀菌作用以及降低生物膜形成能力。将天然药物与常规消毒剂联合使用,可以发挥互补和替代作用,是一种很有价值的生物膜感染治疗策略。
纳米材料与消毒剂结合,开发外排泵抑制剂(efflux pump inhibitor,EPI),是另一种很有前景的抗生物膜策略。金属纳米颗粒具有尺寸小、比表面积大,毒性低、生物稳定性高且有抗菌活性等优点,非常适合成为外排泵结合位点的竞争性抑制剂[94-95]。研究表明外排泵的遗传失活和化学抑制都会导致生物膜EPS的转录受控和生物膜形成条件的缺乏。如Ahmed等[83]用金纳米颗粒包覆的氯己定完全抑制了细菌黏附、定植和释放EPS,抑制了生物膜形成,Vieira等[84]采用纳米-壳聚糖-氯己定的组合方式能够减少或抑制单一或混合生物膜的形成。
而单独的QSIs或EPI不足以彻底消除生物膜的形成,因此需要努力研究QSIs与外EPI联合治疗的疗效或使用抑制剂破坏生物膜形成,然后使用消毒剂根除游离细菌。目前大多数联合用药的研究是在体外进行的,因此迫切需要进行体内实验以确定联合用药的可靠性。
4 展望
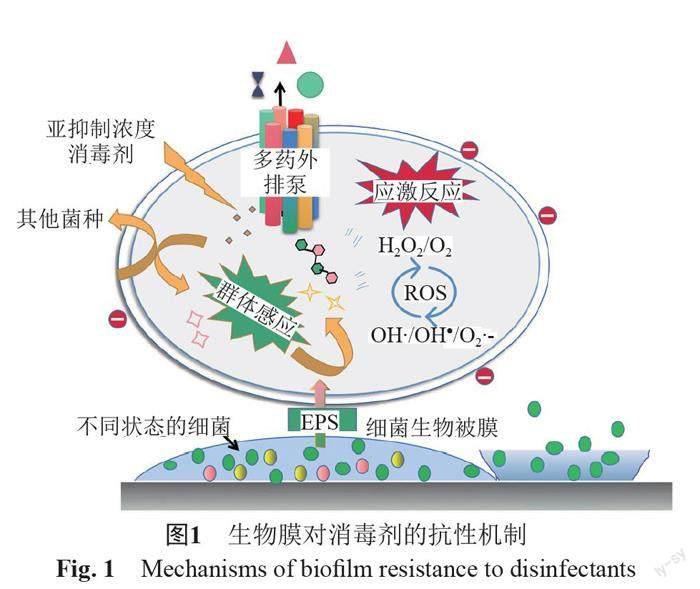
严重生物膜感染问题的出现及其对消毒剂的耐药性或表观抗性,给医疗卫生领域带来了巨大挑战。迄今为止,研究者针对细菌生物膜对消毒剂处理产生抗性的现象进行了大量报道和探究。本文综述了影响生物膜对消毒剂敏感性的主要因素,包括物理条件、细胞外基质、混合生物膜、适应性机制、群体感应等(图1),但造成生物膜消毒剂抗性的因素交叉混合、错综复杂,其中涉及的很多机制仍需进一步的探究。如目前生物膜中持留菌介导的消毒剂抗性确切分子机制仍不全面,仍需要进一步探究;细菌的应激反应是促使生物膜抗性生成的一种重要的适应性机制,深入探究这种生物体内代谢途径的变化也可能成为药物研发的新思路。
除了合理应用消毒剂外,寻找可有效清除或降低生物膜产生的新策略也对解决生物膜抗性至关重要。目前改善消毒剂抗性缺陷的方法主要是采用联合用药的方式,其中发现合适的QSIs和EPI是针对两种靶点的有效前景策略,尤其是在纳米材料及天然植物抑制剂方面,需加强机制及临床试验方面的研究,以期尽早投入实际应用。
参 考 文 献
Subpiramaniyam S. Outdoor disinfectant sprays for the prevention of COVID-19: Are they safe for the environment?[J]. Sci Total Environ, 2021, 759: 144289.
Choi H, Chatterjee P, Lichtfouse E, et al. Classical and alternative disinfection strategies to control the COVID-19 virus in healthcare facilities: A review[J]. Environ Chem Lett, 2021: 1-7.
Guo W, Shan K, Xu B, et al. Determining the resistance of carbapenem-resistant Klebsiella pneumoniae to common disinfectants and elucidating the underlying resistance mechanisms[J]. Pathog Glob Health, 2015, 109(4): 184-192.
张弟强, 张娟胜, 王国庆. 细菌对消毒剂抗性机制的研究进展[J]. 中国消毒学杂志, 2017, 34(7): 675-679.
Singh S, Singh S K, Chowdhury I, et al. Understanding the mechanism of bacterial biofilms resistance to antimicrobial agents[J]. Open Microbiol J, 2017, 11: 53-62.
Jamal M, Ahmad W, Andleeb S, et al. Bacterial biofilm and associated infections[J]. J Chin Med Assoc, 2018, 81(1): 7-11.
Petrova OE, Sauer K. Sticky situations: Key components that control bacterial surface attachment[J]. J Bacteriol, 2012, 194(10): 2413-2425.
Samrot A V, Abubakar Mohamed A, Faradjeva E, et al. Mechanisms and impact of biofilms and targeting of biofilms using bioactive compounds-A review[J]. Medicina, 2021, 57(8): 839.
Lianou A, Koutsoumanis K P. Strain variability of the biofilm-forming ability of Salmonella enterica under various environmental conditions[J]. Int J Food Microbiol, 2012, 160(2): 171-178.
Hua Z, Korany A M, El-Shinawy S H, et al. Comparative evaluation of different sanitizers against Listeria monocytogenes biofilms on major food-contact surfaces[J]. Front Microbiol, 2019, 10: 2462.
Corcoran M, Morris D, De Lappe N, et al. Commonly used disinfectants fail to eradicate Salmonella enterica biofilms from food contact surface materials[J]. Appl Environ Microbiol, 2014, 80(4): 1507-1514.
鄭举, 刘红云, 陈静, 等. 消毒剂的作用机理及在养殖业中的应用[J]. 现代农业科技, 2021, (10): 179-181.
Hall C W, Mah T F. Molecular mechanisms of biofilm-based antibiotic resistance and tolerance in pathogenic bacteria[J]. FEMS Microbiol Rev, 2017, 41(3): 276-301.
Sanchez-Vizuete P, Orgaz B, Aymerich S, et al. Pathogens protection against the action of disinfectants in multispecies biofilms[J]. Front Microbiol, 2015, 6: 705.
Perumal P K, Wand M E, Sutton J M, et al. Evaluation of the effectiveness of hydrogen-peroxide-based disinfectants on biofilms formed by Gram-negative pathogens[J]. J Hosp Infect, 2014, 87(4): 227-233.
Han X, Zhang T, Biset-Peiró M, et al. Tolerance to disinfectants (chlorhexidine and isopropanol) and its association with antibiotic resistance in clinically-related Klebsiella pneumoniae isolates[J]. Pathog Glob Health, 2021, 115(1): 53-60.
Bridier A, Briandet R, Thomas V, et al. Resistance of bacterial biofilms to disinfectants: A review[J]. Biofouling, 2014, 27(9): 1017-1032.
Campanac C, Pineau L, Payard A, et al. Interactions between biocide cationic agents and bacterial biofilms[J]. Antimicrob Agents Chemother, 2002, 46(5): 1469-1474.
Jang A, Szabo J, Hosni A A, et al. Measurement of chlorine dioxide penetration in dairy process pipe biofilms during disinfection[J]. Appl Microbiol Biotechnol, 2006, 72(2): 368-376.
Steenackers H, Hermans K, Vanderleyden J, et al. Salmonella biofilms: An overview on occurrence, structure, regulation and eradication[J]. Food Res Int, 2012, 45(2): 502-531.
Arciola C R, Campoccia D, Speziale P, et al. Biofilm formation in Staphylococcus implant infections. A review of molecular mechanisms and implications for biofilm-resistant materials[J]. Biomaterials, 2012, 33(26): 5967-5982.
Abdalla A K, Ayyash M M, Olaimat A N, et al. Exopolysa-ccharides as antimicrobial agents: Mechanism and spectrum of activity[J]. Front Microbiol, 2021, 12: 664395.
Limoli D H, Jones C J, Wozniak D J. Bacterial extracellular polysaccharides in biofilm formation and function[J]. Microbiol Spectr, 2015, 3(3): 10.
Ahmed M N, Porse A, Abdelsamad A, et al. Lack of the major multifunctional catalase katA in Pseudomonas aeruginosa accelerates evolution of antibiotic resistance in ciprofloxacin-treated biofilms[J]. Antimicrob Agents Chemother, 2019, 63(10): e00766-19.
Hahn M M, González J F, Gunn J S. Salmonella biofilms tolerate hydrogen peroxide by a combination of extracellular polymeric substance barrier function and catalase enzymes[J]. Front Cell Infect Microbiol, 2021, 11: 683081.
Lim E S, Koo O K, Kim M J, et al. Bio-enzymes for inhibition and elimination of Escherichia coli O157:H7 biofilm and their synergistic effect with sodium hypochlorite[J]. Sci Rep, 2019, 9: 9920.
Ortega-Ramirez L A, Gutiérrez-Pacheco M M, Vargas-Arispuro I, et al. Inhibition of glucosyltransferase activity and glucan production as an antibiofilm mechanism of lemongrass essential oil against Escherichia coli O157: H7[J]. Antibiotics (Basel), 2020, 9(3): 102.
Zhou Y, Cui Y, Qu X. Exopolysaccharides of lactic acid bacteria: Structure, bioactivity and associations: A review[J]. Carbohydr Polym, 2019, 207: 317-332.
Hahn M M, Gunn J S. Salmonella extracellular polymeric substances modulate innate phagocyte activity and enhance tolerance of biofilm-associated bacteria to oxidative stress[J]. Microorganisms, 2020, 8(2): 253.
Giaouris E, Heir E, Desvaux M, et al. Intra-and inter-species interactions within biofilms of important foodborne bacterial pathogens[J]. Front Microbiol, 2015, 6: 841.
Wolcott R, Costerton J W, Raoult D, et al. The polymicrobial nature of biofilm infection[J]. Clin Microbiol Infect, 2013, 19(2): 107-112.
Pastar I, Nusbaum A G, Gil J, et al. Interactions of methicillin resistant Staphylococcus aureus USA300 and Pseudomonas aeruginosa in polymicrobial wound infection[J]. PLoS One, 2013, 8(2): e56846.
Peters B M, Jabra-Rizk M A, Scheper M A, et al. Microbial interactions and differential protein expression in Staphylococcus aureus-Candida albicans dual-species biofilms[J]. FEMS Immunol Med Microbiol, 2010, 59(3): 493-503.
I?iguez-Moreno M, Gutiérrez-Lomelí M, Guerrero-Medina P J, et al. Biofilm formation by Staphylococcus aureus and Salmonella spp. under mono and dual-species conditions and their sensitivity to cetrimonium bromide, peracetic acid and sodium hypochlorite[J]. Braz J Microbiol, 2018, 49(2): 310-319.
Behnke S, Parker A E, Woodall D, et al. Comparing the chlorine disinfection of detached biofilm clusters with those of sessile biofilms and planktonic cells in single- and dual-species cultures[J]. Appl Environ Microbiol, 2011, 77(20): 7176-7184.
Pang X Y, Yang Y S, Yuk H G. Biofilm formation and disinfectant resistance of Salmonella sp. in mono- and dual-species with Pseudomonas aeruginosa[J]. J Appl Microbiol, 2017, 123(3): 651-660.
Behnke S, Camper A K. Camper chlorine dioxide disinfection of single and dual species biofilms, detached biofilm and planktonic cells[J]. Biofouling, 2012, 28(5-6): 635-647.
Schaefer L M, Br?zel V S, Venter S N. Venter fate of Salmonella typhimurium in laboratory-scale drinking water biofilms[J]. J Water Health, 2013, 11(4): 629-635.
Wang R, Kalchayanand N, Schmidt J W, et al. Mixed biofilm formation by Shiga toxin-producing Escherichia coli and Salmonella enterica serovar typhimurium enhanced bacterial resistance to sanitization due to extracellular polymeric substances[J]. J Food Prot, 2013, 76(9): 1513-1522.
Kobayashi K, Iwano M. BslA(YuaB) forms a hydrophobic layer on the surface of Bacillus subtilis biofilms[J]. Mol Microbiol, 2012, 85(1): 51-66.
Lee K W, Periasamy S, Mukherjee M, et al. Biofilm development and enhanced stress resistance of a model, mixed-species community biofilm[J]. ISME J, 2014, 8(8): 894-907.
Ramsey M M, Rumbaugh K P, Whiteley M. Metabolite cross-feeding enhances virulence in a model polymicrobial infection[J]. Plos Pathogens, 2011, 7(3): e1002012.
Pourbavarsad M S, Jalalieh B J, Harkins C, et al. Nitrogen oxidation and carbon removal from high strength nitrogen habitation wastewater with nitrification in membrane aerated biological reactors[J]. J Environm Chem Eng, 2021, 9(5): 106271.
Lewis K. Persister cells, dormancy and infectious disease[J]. Nature Rev Microbiol, 2007, 5: 48-56.
Mangalappalli-Illathu A K, Vidovic S, Korber D R. Differential adaptive response and survival of Salmonella enterica serovar enteritidis planktonic and biofilm cells exposed to benzalkonium chloride[J]. Antimicrob Agents Chemother, 2008, 52(10): 3669-3680.
Houari A,Martino P D. Effect of chlorhexidine and benzalkonium chloride on bacterial biofilm formation[J]. Lett Appl Microbiol, 2007, 45(6): 652-656.
Ortiz S, López V, Martínez-Suárez J V. The influence of subminimal inhibitory concentrations of benzalkonium chloride on biofilm formation by Listeria monocytogenes[J]. Int J Food Microbiol, 2014, 189(17): 106-112.
Ebrahimi A, Hemati M, Shabanpour Z, et al. Effects of benzalkonium chloride on planktonic growth and biofilm formation by animal bacterial pathogens[J]. Jundishapur J Microbiol, 2015, 8(2): e59764.
Bansal M, Nannapaneni R, Kode D, et al. Rugose morphotype in Salmonella Typhimurium and Salmonella Heidelberg induced by sequential exposure to subinhibitory sodium hypochlorite aids in biofilm tolerance to lethal sodium hypochlorite on polystyrene and stainless steel surfaces[J]. Front Microbiol, 2019, 10: 2704.
Carvalho G, Balestrino D, Forestier C, et al. How do environment-dependent switching rates between susceptible and persister cells affect the dynamics of biofilms faced with antibiotics?[J]. NPJ Biofilms Microbiomes, 2018, 4: 6.
Soares A, Alexandre K, Etienne M. Tolerance and persistence of Pseudomonas aeruginosa in biofilms exposed to antibiotics: molecular mechanisms, antibiotic strategies and therapeutic perspectives[J]. Front Microbiol, 2020, 11: 2057.
Stewart P S. Antimicrobial tolerance in biofilms[J]. Microbiol Spectr, 2015, 3(3): 10.1128/microbiolspec.MB-0010-2014.
Holder D, Berry D, Dai D, et al. A dynamic and complex monochloramine stress response in Escherichia coli revealed by transcriptome analysis[J]. Water Res, 2013, 47(14): 4978-4985.
Qian H, Li W, Guo L, et al. Stress response of Vibrio parahaemolyticus and Listeria monocytogenes biofilms to different modified atmospheres[J]. Front Microbiol, 2020, 11: 23.
何榮攀, 马久红. 铜绿假单胞菌生物膜对消毒剂抗性研究进展[J]. 中国消毒学杂志, 2019, 36(4): 4.
Savage V J, Chopra I, O'Neill A. Population diversification in Staphylococcus aureus biofilms may promote dissemination and persistence[J]. PLoS One, 2013, 8(4): e62513.
Xpa B, Lin C B, Hgy C. Stress response and survival of Salmonella enteritidis in single and dual species biofilms with Pseudomonas fluorescens following repeated exposure to quaternary ammonium compounds[J]. Int J Food Microbiol, 2020, 325: 108643.
Alvarez-Ordó?eza A, Broussollebc V, Colind P, et al. The adaptive response of bacterial food-borne pathogens in the environment, host and food: Implications for food safety[J]. Int J Food Microbiol, 2015, 213: 99-109.
Liu X, Wu Y, Chen Y, et al. RpoS differentially affects the general stress response and biofilm formation in the endophytic Serratia plymuthica G3[J]. Res Microbiol, 2016, 167(3): 168-177.
Feng Z, El Hag M, Qin T, et al. Residue L193P mutant of RpoS affects its activity during biofilm formation in Salmonella pullorum[J]. Front Vet Sci, 2020, 7: 571361.
van der Veen S, Abee T. Importance of SigB for Listeria monocytogenes static and continuous-flow biofilm formation and disinfectant resistance[J]. Appl Environ Microbiol, 2010, 76(23): 7854-7860.
Luján A M, Maciá M D, Yang L, et al. Evolution and adaptation in Pseudomonas aeruginosa biofilms driven by mismatch repair system-deficient mutators[J]. PLoS One, 2011, 6(11): e27842.
Webber M A, Buckner M M C, Redgrave L S, et al. Quinolone-resistant gyrase mutants demonstrate decreased susceptibility to triclosan[J]. J Antimicrob Chemother, 2017, 72(10): 2755-2763.
Piddock L J V. Multidrug-resistance efflux pumps-not just for resistance[J]. Nat Rev Microbiol, 2006, 4: 629-636.
Soto S M. Role of efflux pumps in the antibiotic resistance of bacteria embedded in a biofilm[J]. Virulence, 2013, 4(3): 223-229.
Alav I, Sutton J M, Rahman K M. Role of bacterial efflux pumps in biofilm formation[J]. J Antimicrob Chemother, 2018, 73(8): 2003-2020.
Bay D C, Stremick C A, Slipski C J, et al. Secondary multidrug efflux pump mutants alter Escherichia coli biofilm growth in the presence of cationic antimicrobial compounds[J]. Res Microbiol, 2016, 168(3): 208-221.
Guo W, Cui S, Xu X, et al. Resistant mechanism study of benzalkonium chloride selected Salmonella Typhimurium mutants[J]. Microb Drug Resist, 2014, 20(1): 11-16.
Yamasaki S, Wang L Y, Hirata T, et al. Multidrug efflux pumps contribute to Escherichia coli biofilm maintenance[J]. Int J Antimicrob Agents, 2015, 45(4): 439-441.
Cadena M, Kelman T, Marco M L, et al. Understanding antimicrobial resistance (AMR) profiles of Salmonella biofilm and planktonic bacteria challenged with disinfectants commonly used during poultry processing[J]. Foods, 2019, 8(7): 275.
Lazar V. Quorum sensing in biofilms-How to destroy the bacterial citadels or their cohesion/power?[J]. Anaerobe, 2011, 17(6): 280-285.
Guo M, Fang Z, Sun L, et al. Regulation of thermostable direct hemolysin and biofilm formation of Vibrio parahaemolyticus by quorum-sensing genes luxM and luxS[J]. Current Microbiology, 2018, 75: 1190-1197.
Toyofuku M, Inaba T, Kiyokawa T, et al. Environmental factors that shape biofilm formation[J]. Biosci Biotechnol Biochem, 2015, 80(1): 7-12.
Gupta K, Liao J, Petrova O E, et al. Elevated levels of the second messenger c-di-GMP contribute to antimicrobial resistance of Pseudomonas aeruginosa[J]. Mol Microbiol, 2014, 92(3): 488-506.
Uzunbayir-Akel N, Tekintas Y, Yilmaz F F, et al. Effects of disinfectants and ciprofloxacin on quorum sensing genes and biofilm of clinical Pseudomonas aeruginosa isolates[J]. J Infect Public Health, 2020, 13(12): 1932-1938.
Lee D J, Jo A R, Jang M C, et al. Analysis of two quorum sensing-deficient isolates of Pseudomonas aeruginosa[J]. Microb Pathog, 2018, 119: 162-169.
Hassett D J, Ma J F, Elkins J G, et al. Quorum sensing in Pseudomonas aeruginosa controls expression of catalase and superoxide dismutase genes and mediates biofilm susceptibility to hydrogen peroxide[J]. Mol Microbiol, 2010, 34(5): 1082-1093.
陳瑶, 刘张玲, 汤荣睿. 金黄色葡萄球菌生物膜预防和治疗的研究进展[J]. 中国抗生素杂志, 2021, 46(1): 7.
Zhang L, Liang E, Cheng Y, et al. Is combined medication with natural medicine a promising therapy for bacterial biofilm infection?[J]. Biomed Pharmacother, 2020, 128: 110184.
Rodríguez-López P, Carballo-Justo A, Draper L A, et al. Removal of Listeria monocytogenes dual-species biofilms using combined enzyme-benzalkonium chloride treatments[J]. Biofouling, 2016, 33(1): 45-58.
Mishra R, Panda A K, De Mandal S, et al. Natural anti-biofilm agents:strategies to control biofilm forming pathogens[J]. Front Microbiol, 2020, 11: 566325.
Walsh D J, Livinghouse T, Durling G M, et al. Sulfenate esters of simple phenols exhibit enhanced activity against biofilms[J]. ACS Omega, 2020, 5(11): 6010-6020.
Ahmed A, Khan A K, Anwar A, et al. Biofilm inhibitory effect of chlorhexidine conjugated gold nanoparticles against Klebsiella pneumoniae[J]. Microb Pathog, 2016, 98: 50-56.
Vieira A P M, Arias L S, de Souza Neto F N, et al. Antibiofilm effect of chlorhexidine-carrier nanosystem based on iron oxide magnetic nanoparticles and chitosan[J]. Colloids Surf B Biointerfaces, 2018, 174: 224-231.
Chiang S R, Jung F, Tang H J, et al. Desiccation and ethanol resistances of multidrug resistant Acinetobacter baumannii embedded in biofilm: The favorable antiseptic efficacy of combination chlorhexidine gluconate and ethanol[J]. J Microbiol Immunol Infect, 2018, 51(6): 770-777.
Sivaranjani M, Liu F, White A P. Synergistic activity of tetrasodium-EDTA, ethanol and chlorhexidine hydrochloride against planktonic and biofilm cells of clinically relevant pathogens[J]. J Glob Antimicrob Resist, 2021, 24: 148-157.
Yong Y Y, Dykes G A, Choo W S. Biofilm formation by staphylococci in health-related environments and recent reports on their control using natural compounds[J]. Crit Rev Microbiol, 2019, 45(2): 201-222.
Geng Y F, Yang C, Zhang Y, et al. An innovative role for luteolin as a natural quorum sensing inhibitor in Pseudomonas aeruginosa[J]. Life Sci, 2021, 274: 119325.
Alva P P, Suresh S, Nanjappa D P, et al. Isolation and identification of quorum sensing antagonist from Cinnamomum verum leaves against Pseudomonas aeruginosa[J]. Life Sci, 2021, 267: 118878.
Kalaiarasan E, Thirumalaswamy K, Harish B N, et al. Inhibition of quorum sensing-controlled biofilm formation in Pseudomonas aeruginosa by quorum-sensing inhibitors[J]. Microb Pathog, 2017, 111: 99-107.
Paluch E, Rewak-Soroczyńska J, Jedrusik I, et al. Preven-tion of biofilm formation by quorum quenching[J]. Appl Microbiol Biotechnol, 2020, 104(5): 1871-1881.
Hendry E, Conway B, Worthington T. Worthington Antimicrobial efficacy of a novel eucalyptus oil, chlorhexidine digluconate and isopropyl alcohol biocide formulation[J]. Int J Mol Sci, 2012, 13(11): 14016-14025.
Vetas D, Dimitropoulou E, Mitropoulou G, et al. Disinfection efficiencies of sage and spearmint essential oils against planktonic and biofilm Staphylococcus aureus cells in comparison with sodium hypochlorite[J]. Int J Food Microbiol, 2017, 257: 19-25.
Gupta D, Singh A, Khan A U. Khan Nanoparticles as efflux pump and biofilm inhibitor to rejuvenate bactericidal effect of conventional antibiotics[J]. Nanoscale Res Lett, 2017, 12(1): 454.
Li X, Wong C H, Ng T W, et al. The spherical nanoparticle-encapsulated chlorhexidine enhances anti-biofilm efficiency through an effective releasing mode and close microbial interactions[J]. Int J Nanomedicine, 2016, 11: 2471-2480.
收稿日期:2021-02-14
基金項目:国家自然科学基金(No. 81971905和No. 82172316)
作者简介:罗欢,女,生于1996年,在读硕士研究生,研究方向为抗生素联合用药对金黄色葡萄球菌的杀菌作用。
E-mail: 1374570956@qq.com
通讯作者,E-mail: zhaox5@xmu.edu.cn
