DTI成像在早期诊断脑室周围白质软化症患儿发生痉挛型脑瘫中的应用
2023-05-30黄婷婷吴云虎
周 舟 黄婷婷 黄 莹 邢 威 吴云虎 张 刚
河南中医药大学第一附属医院,河南 郑州 450000
脑室周围白质软化症(periventricular leukomalacia,PVL)是引起痉挛型脑瘫(cerebral palsy,CP)的主要原因[1-3]。其病理学机制包括缺氧缺血后的谷氨酸兴奋性毒性和氧自由基损伤未成熟的少突胶质细胞,导致神经元坏死和胶质增生[4-5]。研究表明[6-10]早期识别CP 高危风险患儿并在2 岁前实施干预可以显著提升神经可塑性并改善患儿的预后。然而CP 患儿早期症状不显著且难以配合临床评估,给早期诊断带来困难[11-12]。
常规MRI 可以客观显示脑部的损伤病灶,已被国际指南推荐为CP诊断的标准化评估工具[12],但仍有10%~20% CP患儿的常规MRI为阴性[12],难以精确显示病灶与白质纤维束的空间构象及微观结构异常,因此在CP 的精确诊断中仍然存在一定的局限性。扩散张量成像(diffusion tensor imaging,DTI)可以定量评估脑白质纤维束的结构完整性并发现细微损伤,主要参数各项异性分数(fractional anisotropy,FA)及表观扩散系数(apparent diffusion coefficient,ADC)值可作为判断大脑损伤的有效指标[13-15]。研究表明皮质脊髓束(corticospinal tract,CST)、内囊后肢(posterior limb of capsual,PLIC)、丘脑后辐射(posterior thalamic radiation,PTR)、胼胝体压部、额顶叶白质及深部灰质核团FA值下降均与CP的发生密切相关[16-22],CP 患儿复杂的运动功能障碍是多个纤维束受损共同作用的结果[23],联合多个纤维束分析将有助于提高诊断的准确性。因此本研究采用DTI技术,分析PVL 患儿发生痉挛型CP 的特异性白质纤维束损伤,为精准诊断提供客观依据,促进早期干预。
1 资料与方法
1.1 研究对象前瞻性纳入河南中医药大学第一附属医院2016 -12—2020-11 因运动发育落后行常规MRI和DTI检查的患儿。纳入标准:(1)经常规MRI诊断为PVL,PVL 的诊断标准包括[24]:脑室周围白质T2WI 和T2-FLAIR 异常高信号、白质减少、侧脑室扩张、胼胝体变薄;(2)校正年龄6~24月;(3)于校正年龄2岁时行运动发育评估,并随访至5 岁。排除标准:(1)进行性加重的中枢性瘫痪;(2)遗传代谢性疾病、神经肌肉源性疾病导致的运动障碍;(3)合并有颅脑发育畸形[25]、脑积水、颅脑感染。本研究经医院伦理委员会审核通过,检查前患儿家长签署知情同意书。
1.2 运动发育评估所有入组患儿均随访至2~5岁时由1名儿科神经医生(具有15 a儿科诊断经验)行标准化的神经发育评估测试(包括运动、肌张力、反射、姿势异常及运动里程碑落后),CP的诊断参照美国脑瘫国际执行委员会制定的标准[26]。根据CP的诊断,排除非痉挛型CP,分为PVL-痉挛型CP组和PVL-非CP 组。CP 的严重程度由1 名儿科康复治疗师在不知道患儿MRI检查结果的情况下对患儿进行粗大运动功能分级(gross motor function classification system,GMFCS)[27],其观察指标包括竖头、翻身、独坐、爬行、站立和行走。其中GMFCSⅠ、Ⅱ级为轻度运动功能障碍,Ⅲ级为中度运动功能障碍,Ⅳ、Ⅴ级为重度运动功能障碍[28]。
1.3 MRI检查图像的采集使用3.0 T 磁共振扫描仪(Ingenia,飞利浦,荷兰)和32 通道头颅联合线圈。对于不能配合检查的患儿给予镇静,外耳道内塞入海绵耳塞以保护听力,所有程序的执行严格参照婴幼儿MRI检查的国际指南标准[29]。常规扫描序列及参数包括3D-T1WI:重复时间(repetition time,TR)7.7 ms,回波时间(echo time,TE)3.7 ms,层厚2 mm,层间距1 mm,扫描视野(field of view,FOV)180×240×120,矩阵260×260;轴位2D T2WI(TR 4 000 ms,TE 93 ms,层厚6 mm,层间隔0.6 mm,FOV 230×220×220,矩阵256×256);轴位T2-FLAIR(TR 7 000 ms,TE 120 ms,层 厚6 mm,层 间 隔0.6 mm,FOV 230×184×118,矩阵320×320);矢状位2D T2WI(TR 2 500 ms,TE 225 ms,层厚2 mm,层间隔0 mm,FOV 240×219×120,矩阵384×384)。DTI扫描参数:TR 4262 ms,TE 99 ms,FOV 224×224×120,层厚2 mm,层数60,间隔0 mm,32个方向,b值800 s/mm2,激励2次。
1.4 图像处理将原始数据传至PHILIPS Portal 星云工作站生成FA彩色编码图及彩色张量图,感兴趣区(regions of interest,ROI)的选择参考人脑白质MRI图谱[29]及相关文献[14-18],选择与运动功能相关的区域进行勾画(图1),包括:双侧PLIC、大脑脚、半卵圆中心、CST、PTR、胼胝体膝部、胼胝体体部、胼胝体压部、额叶白质、顶叶白质、尾状核、豆状核、丘脑,记录各区域的FA及ADC值。勾画完成后点击Fiber对选定ROI 区域三维重建白质纤维束,FA 选择的阈值为0.15,角度60°。同时穿过靶区和种子区域的纤维束被确定为感兴趣纤维束,纤维束数量越多代表白质纤维束的连接性越高。
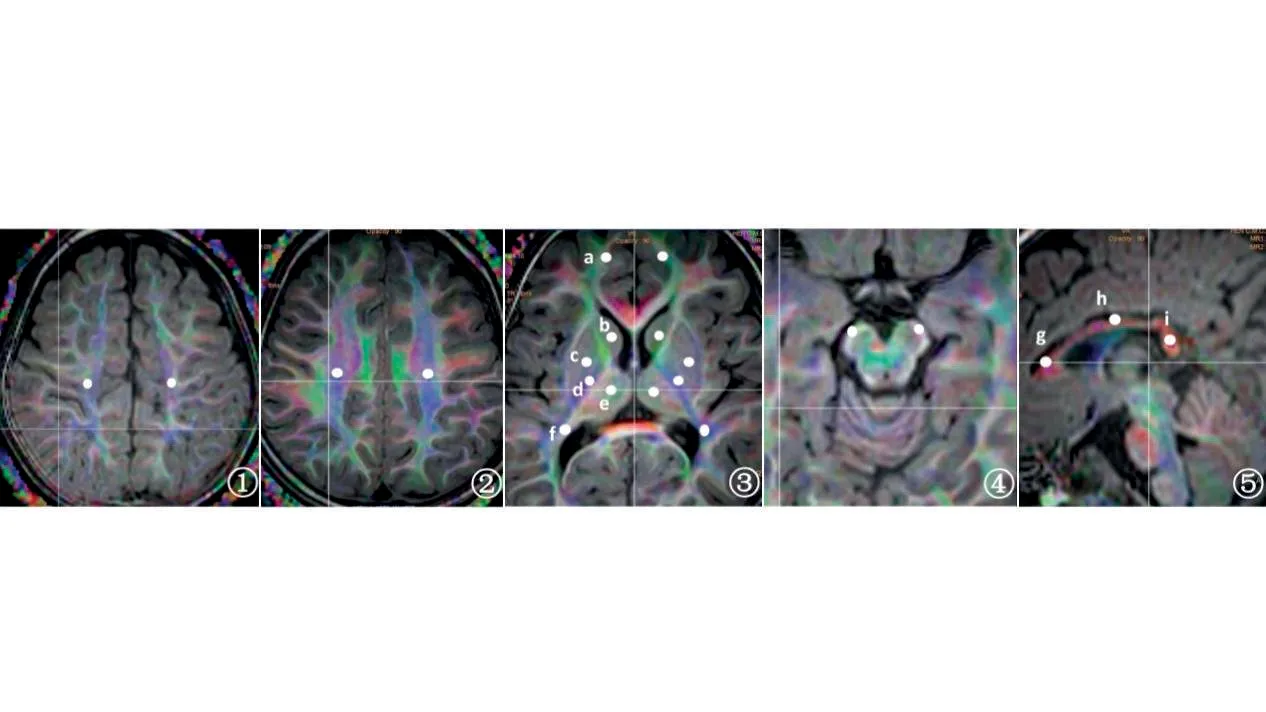
图1 ROI标注示意图(FA-DTI 彩色张量图)Figure 1 The diagrammatic sketch of ROI mask(FA-DTI color tensor diagram)
手动勾画ROI在FA-DTI 彩色张量图上进行,为避免邻近正常组织的影响,尽量将ROI 放置在测量的解剖结构内并避开囊变坏死区域,每个ROI 大小约(10±2)mm2,测量2次取平均值。所有ROI勾画由两位经过培训的医师(具有6 a 及10 a 儿科影像诊断经验)在不知道患儿临床资料及诊断结果的情况下独立完成,两位医师的测量结果用来评估观察者间的一致性;间隔一月后由低年资医师再次勾画所有图像的ROI 用来评估观察者内部的一致性,意见不一致时经讨论确定最终的结果用于下一步分析。
1.5 统计学分析统计学分析应用SPSS(version 22.0,IBM,Chicago,IL,USA)及Medcalc(Version 13.0.0.0,Medcalc software bvba,Belgium)软件。观察者间及观察者内部ROI测量的一致性采用组内相关系数(intraclass correlation efficient,ICC)分析。当ICC>0.7代表具有良好的一致性。
2 结果
2.1 一般资料最终纳入20 例PVL-痉挛型CP 患儿[年龄(14±6)月,范围6~24 月]及年龄与之匹配的20 例PVL-非CP 患儿[年龄(14±5)月,范围6~24月]。2 组一般资料比较差异无统计学意义(P>0.05),见表1。
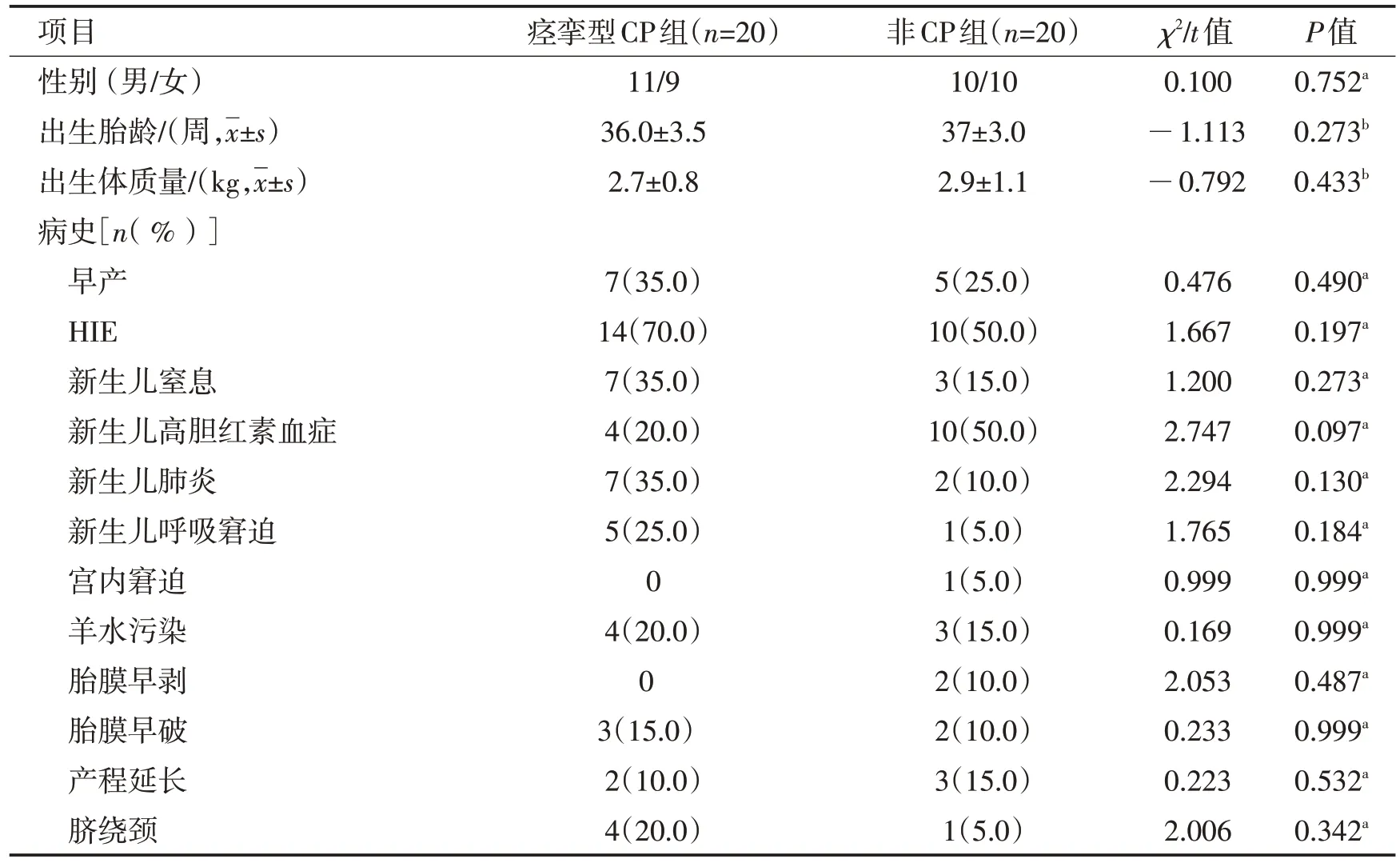
表1 PVL-痉挛型CP组和PVL-非CP组一般资料比较Table 1 Comparison of demographic data between spastic CP and non CP group in children with PVL
2.2 运动发育结局20 例诊断为痉挛型CP 的患儿中,最常见的为痉挛型双瘫13例(65.0%),痉挛型偏瘫6 例(30.0%),痉挛型四肢瘫1 例(5.0%)。GMFCSⅠ级6 例(30.0%),Ⅱ级2 例(10.0%),Ⅲ级9 例(45.0%),Ⅳ级3例(15.0%)。
2.3 ROI 评估的一致性检验所有ROI 的FA 值测量观察者间的一致性检验ICC 为0.83~0.90,P<0.001;观察者内部的ICC 为0.90~0.96,P<0.001。所有ROI 的ADC 值测量的观察者间一致性检验ICC为0.84~0.94,P<0.001;观察者内部的ICC为0.90~0.97,P<0.001。
2.4 2 组间各区域的FA 值及ADC 值比较痉挛型CP组较非CP组FA 值降低的区域为双侧PLIC、半卵圆中心、CST、PTR 及胼胝体的膝、体、压部(P<0.05)。2 组间ADC值差异无统计学意义(P>0.05),见表2。
表2 PVL痉挛型CP组及PVL-非CP组各部位的FA值及ADC值比较 (±s)Table 2 Comparison of FA and ADC values between spastic CP and non CP group in children with PVL (±s)
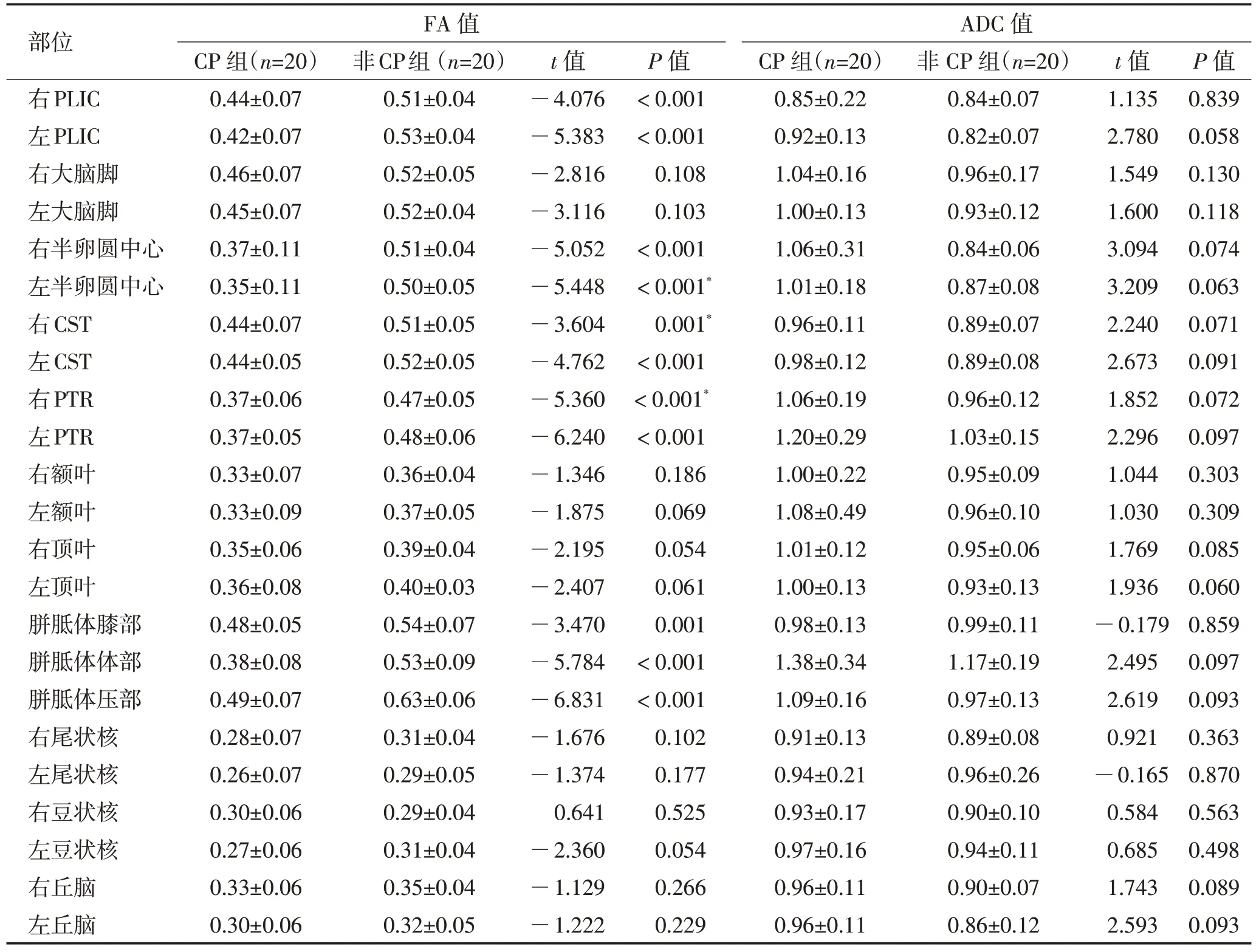
表2 PVL痉挛型CP组及PVL-非CP组各部位的FA值及ADC值比较 (±s)Table 2 Comparison of FA and ADC values between spastic CP and non CP group in children with PVL (±s)
部位右PLIC左PLIC右大脑脚左大脑脚右半卵圆中心左半卵圆中心右CST左CST右PTR左PTR右额叶左额叶右顶叶左顶叶胼胝体膝部胼胝体体部胼胝体压部右尾状核左尾状核右豆状核左豆状核右丘脑左丘脑FA 值ADC 值CP 组(n=20)0.44±0.07 0.42±0.07 0.46±0.07 0.45±0.07 0.37±0.11 0.35±0.11 0.44±0.07 0.44±0.05 0.37±0.06 0.37±0.05 0.33±0.07 0.33±0.09 0.35±0.06 0.36±0.08 0.48±0.05 0.38±0.08 0.49±0.07 0.28±0.07 0.26±0.07 0.30±0.06 0.27±0.06 0.33±0.06 0.30±0.06非CP组(n=20)0.51±0.04 0.53±0.04 0.52±0.05 0.52±0.04 0.51±0.04 0.50±0.05 0.51±0.05 0.52±0.05 0.47±0.05 0.48±0.06 0.36±0.04 0.37±0.05 0.39±0.04 0.40±0.03 0.54±0.07 0.53±0.09 0.63±0.06 0.31±0.04 0.29±0.05 0.29±0.04 0.31±0.04 0.35±0.04 0.32±0.05 t 值—4.076—5.383—2.816—3.116—5.052—5.448—3.604—4.762—5.360—6.240—1.346—1.875—2.195—2.407—3.470—5.784—6.831—1.676—1.374 0.641—2.360—1.129—1.222 P 值<0.001<0.001 0.108 0.103<0.001<0.001*0.001*<0.001<0.001*<0.001 0.186 0.069 0.054 0.061 0.001<0.001<0.001 0.102 0.177 0.525 0.054 0.266 0.229 CP 组(n=20)0.85±0.22 0.92±0.13 1.04±0.16 1.00±0.13 1.06±0.31 1.01±0.18 0.96±0.11 0.98±0.12 1.06±0.19 1.20±0.29 1.00±0.22 1.08±0.49 1.01±0.12 1.00±0.13 0.98±0.13 1.38±0.34 1.09±0.16 0.91±0.13 0.94±0.21 0.93±0.17 0.97±0.16 0.96±0.11 0.96±0.11非CP 组(n=20)0.84±0.07 0.82±0.07 0.96±0.17 0.93±0.12 0.84±0.06 0.87±0.08 0.89±0.07 0.89±0.08 0.96±0.12 1.03±0.15 0.95±0.09 0.96±0.10 0.95±0.06 0.93±0.13 0.99±0.11 1.17±0.19 0.97±0.13 0.89±0.08 0.96±0.26 0.90±0.10 0.94±0.11 0.90±0.07 0.86±0.12 t 值1.135 2.780 1.549 1.600 3.094 3.209 2.240 2.673 1.852 2.296 1.044 1.030 1.769 1.936—0.179 2.495 2.619 0.921—0.165 0.584 0.685 1.743 2.593 P 值0.839 0.058 0.130 0.118 0.074 0.063 0.071 0.091 0.072 0.097 0.303 0.309 0.085 0.060 0.859 0.097 0.093 0.363 0.870 0.563 0.498 0.089 0.093
2.5 痉挛型CP 组FA 值与GMFCS 的相关性分析将痉挛型CP 组双侧PLIC、半卵圆中心、CST、PTR 及胼胝体的膝、体、压部的FA 值与GMFCS行偏相关性分析,结果显示:双侧PLIC、双侧CST 及胼胝体压部FA值下降均与GMFCS呈负相关,且CST相关性最高(右PLIC,r=-0.509,P=0.044;左PLIC,r=-0.513,P=0.039;右侧CST,r=- 0.530,P =0.028;左侧CST,r=-0.556,P=0.013;胼 胝 体 压 部,r=-4.497,P =0.030);而双侧半卵圆中心及胼胝体膝、体部FA值下降与GMFCS不相关(P>0.05)。
2.6 诊断效能分析双侧CST、双侧PLIC 及胼胝体压部FA值降低对痉挛型CP的独立及联合诊断效能比较分析见表3,病例示意图见图2,三维重建的CST及胼胝体白质纤维束彩色示踪图见图3。
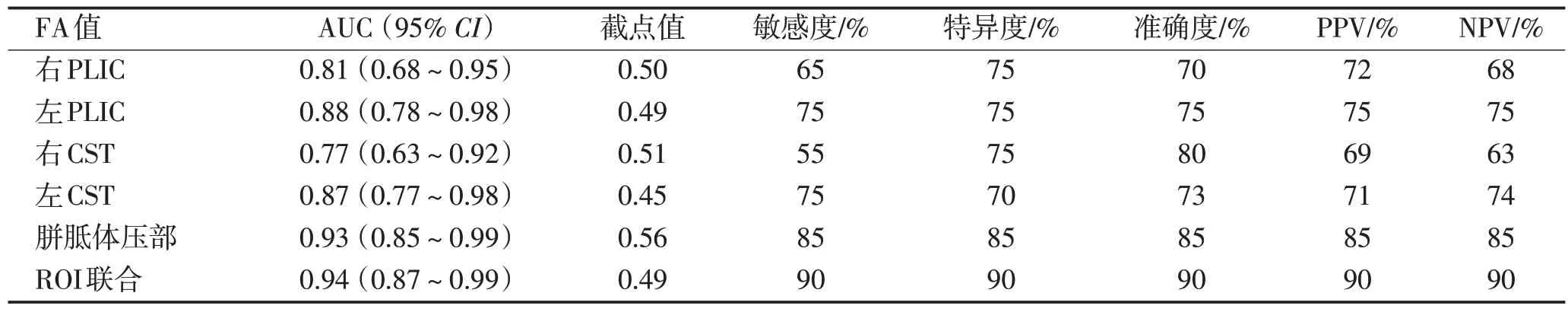
表3 PVL患儿发生痉挛型CP的不同部位的诊断效能分析Table 3 Diagnostic performance of different regions of spastic CP in children with PVL
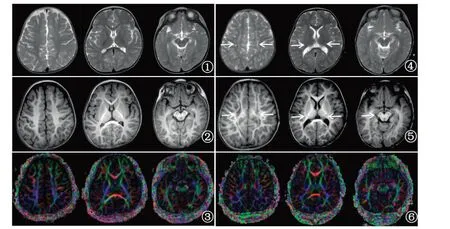
图2 T2WI、3D-T1WI及DTI彩色编码示意图Figure 2 Schematic diagram of T2WI,3D-T1WI and DTI color coding
3 讨论
本研究基于DTI技术,发现PVL-痉挛型CP患儿的白质纤维束损伤较PVL-非CP 患儿更为广泛且严重。双侧CST、PLIC及胼胝体压部FA值下降是早期诊断痉挛型CP 的重要参数,均与GMFCS 呈负相关。三者联合诊断时效能最高,AUC 为0.94(95% CI:0.87~0.99),敏感度90%,特异度90%。该方法无需复杂的后处理软件,操作简单易于在工作站直接测量,并能早期发现CP 患儿的白质纤维束结构异常,有助于临床早期实施干预策略。
DTI 成像技术是一种可以有效揭示大脑主要白质区域纤维束结构变化的方法。本研究发现痉挛型CP 在大部分ROI 区域的FA 值低于非CP 组,与前期相关研究一致[15,18-19],证明白质纤维束损伤在PVL-痉挛型CP 患儿中更为广泛且严重。而与之前的研究不同的是[31-32],ADC 值2 组间差异无统计学差义,因此可以推断FA 值较ADC 值对白质纤维束的细微结构损伤更为敏感,可以作为CP 预测中的重要指标。
本研究发现双侧CST 的FA 值降低为诊断痉挛型CP 的重要参数,特别是在PLIC 区域,与相关研究一致[15-20]。CST为重要的下行运动传导束,起源于中央前回中上部和中央旁小叶前部,集中下行穿过PLIC、大脑脚及脑桥的基底部,再继续下行至脊髓前角的运动神经元,负责控制骨骼肌的随意运动[33-36]。由于CST 走行于脑室周围的白质区域,因此是PVL损伤中最易受累的白质纤维束[18-19,34,37-38]。PLIC是大脑运动传导环路的重要组成部分,是评估CST 损伤最为重要的解剖部位。PVL损伤后由于华勒氏变性引起CST-PLIC 段的损伤,CST 及PLIC-FA 值的降低代表白质纤维束的完整性破坏,导致神经纤维连接异常和神经信息传导通路中断[18,20,35],以上结果表明CST损伤是引起痉挛型CP的主要机制。
本研究发现胼胝体压部FA 值下降与痉挛型CP相关,与黄婷婷等[39-40]研究相符。胼胝体是脑内最大的白质纤维结构,包含(2~2.5)亿的轴突投射纤维,与大脑具有广泛连接,是连接左右大脑半球的重要通路[41],胼胝体压部是连接胼胝体与双侧运动皮质间的重要通路,由感觉-运动皮层产生的纤维常常穿过胼胝体的压部,FA 值的下降表明了大脑半球间结构连接的异常,因此胼胝体压部损伤可引起肌力降低、感觉及认知功能的异常[42]。
PTR 是重要的感觉神经纤维,负责连接丘脑与顶枕叶的大部分区域,研究认为PTR 与视觉空间功能有关,PTR 损伤会影响运动协调性[43-44],然而本研究发现PTR与痉挛型CP不相关,说明PTR可能不是导致痉挛型CP 运动功能障碍的直接原因。另外,PVL还会引起深部灰质核团(如豆状核及丘脑)的损伤,研究表明两者与CP 密切相关[45],然而本研究并没有发现2 组间FA值存在差异,分析原因可能是深部灰质含有的白质纤维束较少,今后的研究需要运用基于体素的形态测量学(voxel-based morphometry,VBM)及fMRI等新技术来探索其与CP的相关性。
本研究尚存在以下局限性:(1)本研究没有进行基于全脑白质纤维骨架的TBSS分析,只进行了感兴趣区纤维束的分析可能会遗漏一些征象,但是本研究选择的是经前期大量DTI研究已经证实的与运动密切相关的白质纤维束,便于在日常繁忙的临床工作中快速识别CP高危患儿;(2)已知FA值的升高与年龄及脑组织的髓鞘化程度密切相关[44-48],在2 岁前利用DTI 分析不同的脑白质纤维束可能是一个挑战。然而,本研究分析的都是位于脑部中线结构区域的白质纤维束(如CST、胼胝体),在出生时就已经髓鞘化;且PVL的脑部损伤病灶在6个月后已经相对稳定;(3)本研究纳入病例较少,在今后研究中需要扩大样本量来提高研究结果的可靠性。
本研究基于DTI 技术发现双侧CST、双侧PLIC、胼胝体压部的FA 值降低是运动发育落后患儿发生痉挛型CP的特异性因素,三者联合具有良好的诊断效能,可在日常临床工作中提供定量信息,有助于早期识别CP高危风险患儿,促进特异性干预。
