外周血淋巴细胞与单核细胞比值在初诊多发性骨髓瘤患者中的预后价值
2023-05-30朱亭郡何芳赵彩芳胡慧仙
朱亭郡 何芳 赵彩芳 胡慧仙


[摘要] 目的 探討外周血淋巴细胞与单核细胞比值(lymphocyte-to-monocyte ratio,LMR)在初诊多发性骨髓瘤(multiple myeloma,MM)患者中的预后价值。方法 回顾性分析2016年2月至2022年1月浙江大学医学院附属金华医院收治的156例初诊为MM患者的临床资料,应用受试者操作特征曲线(receiver operator characteristic curve,ROC曲线)计算LMR最佳临界值,并分析LMR与总生存(overall survival,OS)和无进展生存(progression free survival,PFS)的关系。结果 外周血LMR临界值为3.01时,据此将患者分为低LMR组(LMR<3.01,n=49)和高LMR组(LMR≥3.01,n=107)。中位随访时间30.5(3~75)个月,低LMR组患者的中位OS时间(55个月vs.未达到)和中位PFS时间(21个月vs.39个月)均显著短于高LMR组(P<0.05);低LMR组患者的OS率和PFS率均显著低于高LMR组(P<0.05)。多因素Cox回归分析结果显示,LMR是影响MM患者OS及PFS的独立危险因素(P<0.05)。结论 LMR是影响初诊MM患者预后的独立危险因素,在预测初诊MM患者预后中具有一定价值。
[关键词] 多发性骨髓瘤;淋巴细胞与单核细胞比值;预后
[中图分类号] R733 [文献标识码] A [DOI] 10.3969/j.issn.1673-9701.2023.10.007
Prognostic value of peripheral blood lymphocyte-to-monocyte ratio in patients with newly diagnosed multiple myeloma
ZHU Tingjun, HE Fang, ZHAO Caifang, HU Huixian
Department of Hematology, Affiliated Jinhua Hospital, Zhejiang University School of Medicine, Jinhua 321000, Zhejiang, China
[Abstract] Objective To investigate the prognostic value of lymphocyte-to-monocyte ratio (LMR) in patients with newly diagnosed multiple myeloma (MM). Methods The clinical data of 156 newly diagnosed MM patients in Affiliated Jinhua Hospital, Zhejiang University School of Medicine from February 2016 to January 2022 were retrospectively analyzed. Receiver operator characteristic (ROC) curve was used to calculate the optimal cut-off value, and analysed the relationship between LMR and overall survival (OS) and progression free survival (PFS). Results When the critical value of peripheral blood LMR was 3.01, patients were divided into low LMR group (LMR<3.01, n=49) and high LMR group (LMR≥3.01, n=107). The median follow-up time was 30.5 (3-75) months. Median OS time (55 months vs. not reached) and median PFS time (21 months vs. 39 months) in low LMR group were significantly shorter than in high LMR group (P<0.05), the rates of OS and PFS in low LMR group were significantly lower than those in high LMR group (P<0.05). Multivariate Cox regression analysis showed that LMR was an independent risk factor affecting OS and PFS in MM patients (P<0.05). Conclusions LMR is an independent risk factor affecting the prognosis of patients with newly diagnosed MM and has significant value in predicting the prognosis of patients with newly diagnosed MM.
[Key words] Multiple myeloma; Lymphocyte-to-monocyte ratio; Prognosis
![]()
多发性骨髓瘤(multiple myeloma,MM)属于浆细胞恶性肿瘤,是第二常见的血液系统恶性肿瘤。随着蛋白酶体抑制剂和(或)免疫调节药物与自体造血干细胞移植的联合使用,MM的总生存(overall survival,OS)得到显著提高[1]。然而,幾乎所有的MM患者最终均会复发。早期识别高危人群和适当的治疗方案可提高缓解率并延长生存时间[2]。目前,评估MM的预后多采用Durie-Salmon(D-S)分期体系、国际分期体系(international staging system,ISS)和修订的国际分期体系(revised-international staging system,R-ISS),但这些分期系统多基于肿瘤负荷,未涉及宿主免疫相关因素。而荧光原位杂交评估MM患者预后的价格昂贵,成本和非便利性限制其在临床上的应用。研究证实,MM的进展与免疫功能障碍有关[3]。因此迫切需要方便易得的免疫相关预后指标以评价患者的风险并指导治疗,从而延缓疾病进展。外周血的免疫相关指标易获得,近年来研究发现,淋巴细胞与单核细胞比值(lymphocyte-to-monocyte ratio,LMR)是一种潜在的可反映宿主免疫状态的生物标志物,可能与多种肿瘤预后相关[4-6]。Shi等[7]报道LMR升高是初诊MM患者的良好预后指标,是OS的独立预测因素。为探讨LMR对初诊MM患者的预后预测价值,本研究对初诊MM患者进行回顾性分析,现将结果报道如下。
1 资料与方法
1.1 研究对象
回顾性收集2016年2月至2022年1月浙江大学医学院附属金华医院收治的156例MM患者的临床资料。纳入标准:①初诊为MM;②接受以硼替佐米为基础的化疗;③符合《中国多发性骨髓瘤诊治指南(2022年修订)》[8]的诊断标准;④无免疫药物治疗史。排除标准:①复发难治性MM;②确诊前有化疗、免疫治疗相关病史;③合并自身免疫疾病。本研究经浙江大学医学院附属金华医院伦理委员会批准(伦理审批号:2022伦审第95号),并取得患者知情同意。
1.2 方法
1.2.1 研究方法 收集所有患者入院时的相关临床资料,包括外周血淋巴细胞和单核细胞计数、年龄、性别、血红蛋白(hemoglobin,Hb)、白蛋白、乳酸脱氢酶(lactate dehydrogenase,LDH)、肌酐、血钙、D-S分期、ISS分期、β2微球蛋白、M蛋白类型等。
1.2.2 随访方法 采取查阅患者的住院资料及电话联系进行随访,截止时间为2022年5月。156例患者中无失访,随访率100%。OS时间指从疾病诊断至任何原因导致的死亡或随访结束的时间;无进展生存(progression free survival,PFS)时间指从疾病诊断至首次出现疾病进展、任何原因导致死亡或随访结束的时间。
1.3 统计学方法
本研究采用SPSS 26.0软件进行统计学分析。计数资料以例数(百分率)[n(%)]表示,比较采用c2检验或连续校正c2检验。采用受试者操作特征曲线(receiver operator characteristic curve,ROC曲线)对LMR的最佳临界值进行评估,并记录曲线下面积(area under the curve,AUC)。生存分析采用Kaplan- Meier法,并进行Log-rank检验。单因素和多因素Cox回归分析初诊MM患者的预后影响因素。P<0.05为差异有统计学意义。
2 结果
2.1 LMR预测MM患者预后的ROC曲线
外周血LMR临界值为3.01时,预测患者是否存活的敏感度为69.7%,特异性为78.9%,AUC为0.813(95%CI:0.733~0.893),见图1。
2.2 MM患者临床特征与LMR的关系
根据ROC曲线确定的最佳临界值,将患者分为低LMR组(LMR<3.01,n=49)和高LMR组(LMR≥3.01,n=107)。两组患者的年龄、性别、Hb、血清白蛋白、LDH、血清肌酐、血钙、D-S分期、ISS分期、M蛋白类型、β2微球蛋白水平比较,差异均无统计学意义(P>0.05),见表1。
2.3 通过LMR预后分层的MM患者生存分析
MM患者的中位随访时间为30.5(3~75)个月。低LMR组患者的中位OS时间(55个月vs.未达到)和中位PFS时间(21个月vs.39个月)均显著短于高LMR组(P<0.05)。低LMR组患者的OS率和PFS率均显著低于高LMR组(P<0.05),见图2。
2.4 影响MM患者预后的单因素和多因素分析
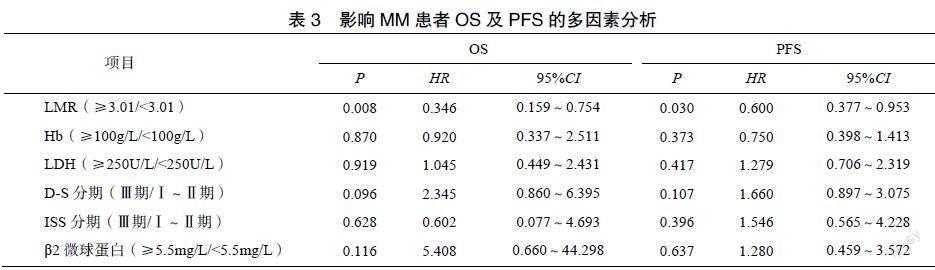
單因素Cox回归分析结果显示,LMR、Hb、LDH、D-S分期、ISS分期、β2微球蛋白均是MM患者OS的影响因素(P<0.05),LMR、Hb、D-S分期、ISS分期、β2微球蛋白均是MM患者PFS的影响因素(P<0.05),见表2。多因素Cox回归分析结果显示,LMR是影响MM患者OS及PFS的独立危险因素(P<0.05),见表3。
3 讨论
虽然MM患者的预后近年来得到明显改善,但MM仍然是一种无法治愈的疾病,多数患者在缓解后常出现疾病复发或进展。MM丧失免疫监视的关键介质,并形成促进疾病进展和对治疗抵抗耐受的免疫环境[8]。骨髓微环境在MM的发生发展中起重要作用,骨髓微环境不仅可支持骨髓瘤细胞增殖与存活,且与其耐药性有关[9]。炎症细胞是骨髓微环境的主要组成部分,研究发现,炎症细胞在肿瘤的发生、生长和发育中起重要作用[10]。外周血淋巴细胞计数可反映宿主免疫功能,淋巴细胞计数降低被认为是肿瘤预后不良因素,已被证实与多种肿瘤患者的预后不良相关[11-14]。肿瘤相关巨噬细胞来源于单核细胞,是构成肿瘤相关炎症细胞的重要组成部分,在多种肿瘤细胞的生长、血管生成和转移中起重要作用[15]。肿瘤相关巨噬细胞通过肿瘤来源的趋化因子招募至肿瘤部位,从而影响外周血单核细胞的数量,故外周血单核细胞计数可作为肿瘤相关巨噬细胞的重要替代标志物[16]。单核细胞分泌的相关细胞因子会增加肿瘤的负荷量,并参与构建有利于MM细胞存活的免疫抑制微环境[17]。因此,LMR可能代表宿主免疫系统和肿瘤诱导的免疫功能障碍的相对强度,可作为反映基线宿主免疫状态的免疫生物标志物,用于预测初诊MM患者的预后。研究表明,低LMR与血液系统恶性肿瘤和多种实体瘤的不良预后相关[18-20]。
本研究证实,低LMR初诊MM患者生存期缩短,预后较差,LMR是初诊MM患者OS和PFS的独立危险因素,该结果与既往研究一致[21-24],提示LMR在预测初诊MM患者的远期生存方面具有重要的临床指导价值。Tian等[25]研究发现,低LMR的MM患者其血清LDH、肌酐、血钙和β2微球蛋白水平较高LMR患者显著升高,提示低LMR患者有更高的基础肿瘤负荷,但在本研究中,虽然低LMR组患者的血清LDH、肌酐、血钙和β2微球蛋白升高比例均高于高LMR组,但差异并无统计学意义,这可能与不同研究人群之间的个体差异有关,也可能与所选的不同最佳临界值有关。
综上所述,LMR作为一种易测的免疫生物标志物,初诊MM患者低LMR则生存期缩短,预后较差,这为临床医生对初诊MM患者的预后评估提供新的思路和参考依据。
[参考文献][1] SILBERSTEIN J, TUCHMAN S, GRANT S J. What is multiple myeloma?[J]. JAMA, 2022, 327(5): 497.
[6] SUZUKI K, NISHIWAKI K, NAGAO R, et al. Clinical significance of the lymphocyte-to-monocyte ratio in multiple myeloma patients with negative minimal residual disease: A single-center retrospective analysis[J]. Int J Hematol, 2021, 114(5): 599–607.
[13] YAMANOUCHI K, MAEDA S, TAKEI D, et al. Pretreatment absolute lymphocyte count and neutrophil-to- lymphocyte ratio are prognostic factors for stage Ⅲ breast cancer[J]. Anticancer Res, 2021, 41(7): 3625–3634.
[20] TOKUMARU S, KOIZUMI T, SEKINO Y, et al. Lymphocyte-to-monocyte ratio is a predictive biomarker of response to treatment with nivolumab for gastric cancer[J]. Oncology, 2021, 99(10): 632–640.
