烟粉虱取食及其与TYLCCNV共侵染对烟草植株内H2O2的诱导响应
2023-05-30茹宁辰姜珊纠敏汪伦记任利娜
茹宁辰 姜珊 纠敏 汪伦记 任利娜

摘要 本研究采用DAB染色法定位检测经烟粉虱取食及其与中国番茄黄化曲叶病毒(TYLCCNV)共侵染后烟草叶片中H2O2的积累,并定量分析烟草叶片中H2O2的含量。DAB染色结果表明,2种处理的烟草叶片中均未检测到H2O2积累;H2O2的定量分析结果表明,2种处理均可诱导烟草叶片中H2O2含量较对照显著升高。在烟粉虱取食处理后0.5、1、3、6、12 h及1、3、5、7、9 d,烟草叶片中H2O2含量分别为对照的1.62、1.71、1.77、1.77、1.95、1.46、1.82、1.63、1.53和1.08倍;共侵染处理后烟草叶片中H2O2含量分别为对照的1.64、1.84、1.95、2.19、2.29、1.43、2.17、2.08、2.60和1.79倍。烟粉虱与TYLCCNV共侵染较烟粉虱取食可诱导烟草植株内H2O2含量显著升高。
关键词 中国番茄黄化曲叶病毒;烟粉虱;烟草;活性氧;H2O2;诱导响应
中图分类號 S572 文献标识码 A
文章编号 1007-7731(2023)06-0119-06
Abstract The accumulation of H2O2 in tobacco leaves was detected firstly by histochemical method after feeding of B. tabaci and its co-infection with TYLCCNV, and then the content of H2O2 in tobacco leaves was quantitatively analyzed. The results of DAB staining showed that no accumulation of H2O2 was detected in tobacco leaves after these two treatments. The quantitative analysis of H2O2 showed that the content of H2O2 in tobacco leaves increased significantly after these two treatments when compared with the control. At 0.5, 1, 3, 6, 12 h, and 1, 3, 5, 7, 9 d after feeding of B. tabaci, the contents of H2O2 in tobacco leaves were 1.62, 1.71, 1.77, 1.77, 1.95, 1.46, 1.82, 1.63, 1.53 and 1.08 times of that in the control leaves, respectively; while the contents of H2O2 in the tobacco leaves after co-infection with B. tabaci and TYLCCNV were 1.64, 1.84, 1.95, 2.19, 2.29, 1.43, 2.17, 2.08, 2.60 and 1.79 times of that in the control leaves, respectively. The co-infection of B. tabaci and TYLCCNV could induce a significant increase in the content of H2O2 in tobacco plants compared with the feeding of B. tabaci.
Keywords tomato yellow leaf curl China virus; Bemisia tabaci; tobacco; reactive oxygen species; H2O2; induction response
植物成功识别病原体侵染后会伴随着细胞内活性氧(reactive oxygen species,ROS)的产生[1-2]。ROS在应激反应刺激下产生,通常被认为是氧化应激指示标志物,可以在植物不同的细胞器中产生,如线粒体、叶绿体和过氧化物酶体,它们是植物光合作用和呼吸作用等不同代谢和生理过程的副产物[3]。生物胁迫在加速植物系统中ROS的产生方面起着关键作用[4]。能够诱导氧化损伤的ROS包括单线态氧(1O2)、超氧化物([O-2]),过氧化氢(H2O2)、羟基自由基(OH·)、烷氧基(RO·)、过氧基(ROO·)、有机过氧化氢(ROOH)等[5]。起初,ROS被认为是应激代谢的有毒副产物,导致氧化应激损伤,是细胞死亡的“杀手”[6]。最近的研究表明,ROS作为细胞响应不同生物和非生物胁迫、发育过程和程序性细胞死亡的一类信号分子,在植物防御中发挥着关键作用[7]。
H2O2是最稳定的活性氧,能以分子的形式穿透细胞膜,并能从其产生位置扩散一定距离[8]。研究表明,H2O2在植物防御细菌和真菌侵染过程中起着重要作用[9]。目前,植物受到食草动物攻击后,虫害组织中ROS的来源尚不清楚。研究发现,在铃夜蛾属(Helicoverpa)昆虫侵染大豆期间,大豆内的O2?和OH·含量增加[10]。也有研究认为,来自Helicoverpa唾液腺的葡萄糖氧化酶等酶会产生H2O2,这可能有助于提高攻击部位的ROS浓度[11]。
烟粉虱(Bemisia tabaci)属半翅目(Hemiptera)、粉虱科(Aleyrodidae),作为重要的农业害虫及菜豆金黄花叶病毒属病毒的传播媒介,给农业生产造成了严重的经济损失[12-13]。近年来,有关烟粉虱—双生病毒—宿主植物三者互作的研究已有不少报道[14],但目前为止,有关ROS在三者互作过程中的诱导响应情况还未被报道,有关宿主植物如何通过调控自身体内ROS来防御烟粉虱取食及其与TYLCCNV共侵染也未见报道。因此,本研究以健康烟草为材料,利用DAB染色法检测烟粉虱取食及其与TYLCCNV共侵染不同时间后烟草叶片中H2O2的积累情况,然后采用H2O2定量分析试剂盒测定2种处理不同时间的烟草叶片内H2O2的含量变化,分析2种处理对烟草叶片内H2O2产生量的影响差异,探索烟草植株如何通过调控H2O2含量来防御烟粉虱取食及其与TYLCCNV的共侵染,进而为研究烟粉虱—TYLCCNV—宿主植物三者之间的互作机制提供理论参考。
1 材料与方法
1.1 材料
1.1.1 供试植物。健康烟草(Nicotiana tabacum NC89)种子由河南科技大学园艺与植物保护学院董钧锋老师提供。将种子播于育种盘中,置于光照培养箱内培养,待植株生长至2~3片真叶移栽至小盆(直径10 cm左右),每盆1株,定期浇植物营养液,待植株生长至3~4片真叶时用于试验。
1.1.2 供试昆虫。MED隐种烟粉虱(GenBank 登录号:KY100013)是2015年9月采自河南省洛阳市的芝麻寄主并一直维持在健康烟草植株上的虫群。饲养温度为(26±1) ℃,相对湿度为40%~60%,光照周期为L∶D=16 h∶8 h。用RAPD-PCR方法不定期检测烟粉虱种群纯度,一般2~3代检测1次。选取羽化后2 d内的烟粉虱成虫用于后续试验。携带TYLCCNV的烟粉虱获取方法参考Jiu等[15],即将收集的羽化后2 d内的烟粉虱成虫转接于养虫笼内被TYLCCNV侵染的烟草毒株上,在毒株叶片上取食获毒48 h即为携带TYLCCNV的烟粉虱。收集获毒48 h后的成虫个体用于后续试验。
1.1.3 试剂及仪器。H2O2定量试剂盒购于上海生工生物工程有限公司;3,3′-二氨基联苯胺(DAB)染色液购于南京建成生物工程研究所;光照培养箱(PGX-330A-12H)购于宁波莱福科技有限公司;JXFSTPRP-24全自动样品快速研磨器由上海净信实业发展有限公司生产;SMART生物显微镜、CDD TP510专业彩色相机及OPTPro显微图像分析软件,均为重庆奥特光学仪器有限公司生产。
1.2 方法
1.2.1 烟草植株的处理方法。选取3~4片真叶期长势较为一致的健康烟草植株,置于养虫笼(120目网纱,规格大小为60 cm×60 cm,塔形,帐篷式)内,分别用微虫笼将携带和未携带TYLCCNV的烟粉虱成虫转接于烟草植株叶片上,每笼100头,每株2笼,同时以夹有微虫笼但未接虫的烟草植株作对照。在试验处理0.5、1、3、6、12 h和1、3、5、7、9 d时,将用于取食处理的烟粉虱成虫个体除去并收集植株,用于DAB染色和H2O2含量测定。
1.2.2 DAB染色法检测烟草叶片内的H2O2积累。采用组织化学方法检测H2O2。该方法基于3,3′-二氨基联苯胺(DAB)的氧化反应,在H2O2存在下,二氨基联苯胺被氧化为红棕色[16-17]。DAB染色方法参考Kempema等[18]的方法并稍做修改。收集处理不同时间的烟草植株,用蒸馏水清洗2~3次,再用吸水纸轻轻吸干植株叶片及根部水分。用2.8 mmol/L DAB(pH 3.68)染色液浸没整个烟草植株,避光真空渗透20 min,然后在37 ℃条件下避光培养5 h。去除DAB溶液,加入95%乙醇,沸水浴10~15 min除去色素,显微镜下观察DAB染色结果并成像。每个处理重复3次。
1.2.3 定量分析不同处理后烟草叶片内H2O2含量。烟草叶片内H2O2的定量分析按照H2O2定量分析试剂盒说明书进行。植株处理方法同1.2.2,迅速剪取处理的植株叶片,准确称取0.1 g,在低温条件下快速匀浆,4 ℃,10 000 r/min离心10 min,吸取上清液置于冰上,待测。定量分析方法参考任利娜[19]。H2O2浓度计算公式:样品中H2O2浓度(?mol/L)=该样品稀释液的过氧化氢浓度×样品稀释倍数。每个处理3次重复。
1.3 数据分析
数据统计分析采用SPSS 18.0软件,组间分析采用One-Way ANOVA进行两两比较得到相应P值,检验组间差异显著性。
2 结果与分析
2.1 各处理不同时间点烟草叶片内H2O2的组织化学定位
不同处理的烟草叶片内H2O2的组织化学定位结果如图1和图2所示。由图1、2可知,在不同处理的0.5、1、3、6、12 h和1、3、5、7、9 d时,无处理对照叶片(图1A和图2E)、烟粉虱取食处理叶片(图1B和图2F)、烟粉虱与TYLCCNV共侵染处理叶片(图1C和图2G)内均未检测到H2O2积累。
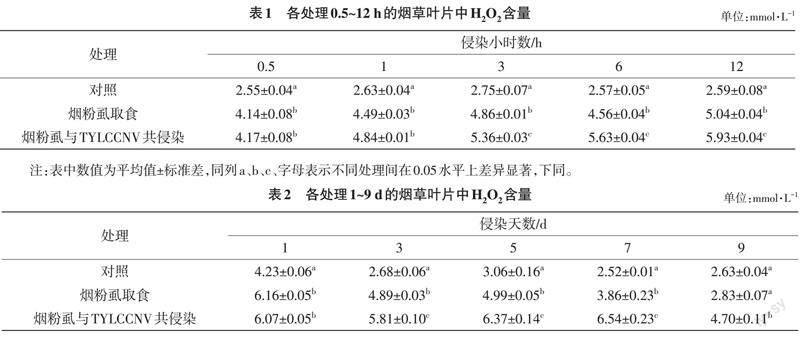
2.2 各处理不同时间点烟草植株中H2O2的定量分析
由表1可知,在处理的0.5、1、3、6和12 h时,烟粉虱取食均可诱发烟草植株内H2O2含量较对照显著升高,其H2O2含量分别是对照的1.62、1.71、1.77、1.77和1.95倍;烟粉虱与TYLCCNV共侵染处理的烟草植株内H2O2含量也均较对照显著升高,其H2O2含量分别是对照的1.64、1.84、1.95、2.19和2.29倍。與烟粉虱取食处理相比较,烟粉虱与TYLCCNV共侵染处理0.5和1 h时,H2O2含量在2种处理植株间差异不显著,而在处理3、6和12 h时,H2O2含量在2种处理植株间的差异均达显著水平(P<0.05),烟粉虱与TYLCCNV共侵染植株中H2O2含量分别是烟粉虱取食植株的1.10、1.23和1.18倍。
从表2可以看出,除处理后第9 d以外,烟粉虱取食均可诱发烟草植株内H2O2含量较对照显著升高,烟粉虱取食处理第1、3、5和7 d,植株内H2O2的含量分别是对照的1.46、1.82、1.63和1.53倍;烟粉虱与TYLCCNV共侵染处理均可诱发烟草植株内H2O2含量较对照显著升高,共侵染处理的第1、3、5、7和9 d,植株内H2O2的含量分别是对照的1.43、2.17、2.08、2.60和1.79倍。与烟粉虱取食处理相比较,共侵染处理的第1 d,H2O2含量在2种处理植株间差异不显著,而处理的第3、5、7和9 d,H2O2含量在2种处理植株间的差异均达显著水平(P<0.05),共侵染处理植株内H2O2含量分别是烟粉虱取食植株的1.19、1.28、1.69和1.66倍。
3 讨论与结论
已有研究表明,H2O2在植物防御生物胁迫过程中起着重要作用,可通过DAB染色法观察植物组织中H2O2的积累[18, 20-23]。在本研究中,烟粉虱取食及其与TYLCCNV共侵染处理的烟草叶片内均未检测到局部H2O2积累(图1、图2),甚至在整个植株中也未检测到H2O2积累。与本研究结果相似的是,Kempema等[18]在对拟南芥经银叶粉虱(B. tabaci type B)取食过程中的防御反应研究中发现,虽然经银叶粉虱若虫取食危害21 d,在取食过程中也未检测到拟南芥植株内局部细胞死亡和H2O2积累,但作者认为不能忽视在银叶粉虱若虫与拟南芥相互作用过程中,H2O2会在短暂或更早的时间点产生的可能性。Giovamini等[24]的研究也发现,在经黑穗蝇(Mayetiola destructor)幼虫取食0、2、6、12、18、24、48、72或96 h的小麦(Triticum aestivum)组织中也均未检测到黑穗蝇取食诱导的H2O2积累。有趣的是,在马铃薯蚜虫(Macrosiphum euphorbiae)取食3、6和12 h的番茄叶片内未观察到H2O2积累,而在取食24 h的番茄小叶主脉和次脉处则检测到H2O2积累[25]。由此可见,不同的植物被不同昆虫取食后所诱导的H2O2积累情况有所差异。
DAB染色分析的敏感性可能有限[25]。活性氧检测困难与其寿命短以及活细胞清除活性氧的能力有关[4]。本研究虽然在所检测的样品中未成功检测到H2O2的积累,但不能排除在不同处理过程中存在微氧化爆发的可能性,以及通过植物过氧化氢酶或存在于烟粉虱唾液中的过氧化物酶有效清除H2O2的情况。因此,进一步对烟粉虱取食及其与TYLCCNV共侵染处理后烟草叶片内H2O2的含量进行了定量分析。在H2O2的定量分析中发现,2种处理均诱发植株内H2O2含量较对照显著升高(表1,表2),植株内H2O2含量的升高可能是烟草植株应对烟粉虱取食及其与TYLCCNV共侵染的一种防御反应。该研究结果也解释了先前报道中烟粉虱取食及其与TYLCCNV共侵染的烟草植株内一些氧化酶酶活性较对照显著升高的一个重要原因[26],通过氧化酶活性升高清除被侵染植株内产生的过量H2O2,进而降低ROS对植株自身造成伤害。
有关植物在病毒侵染后发生氧化爆发的现象已有详细报道[27]。研究发现烟草花叶病毒(Tobacco mosaic virus,TMV)侵染烟草后可导致烟草叶片坏死并伴随O2-产生[28]。西葫芦黄化花叶病毒(Zucchini yellow mosaic virus,ZYMV)侵染西葫芦后诱导植株内H2O2含量升高[29]。大豆黄化花叶病毒(Bean yellow mosaic virus,BYMV)侵染及水楊酸处理诱导大豆植株内H2O2含量及多种氧化酶活性升高[30]。本研究发现,烟粉虱与TYLCCNV共侵染处理较烟粉虱取食处理可诱导烟草叶片中产生更多的H2O2,这可能是共侵染处理可诱导烟草植株较烟粉虱取食植株产生更强防御反应的结果。由此可见,植物在遭受病毒及其传播媒介共侵染的过程中可诱发更多量的ROS以防御昆虫的取食及病毒的侵染。宿主植物烟草可通过调控自身体内H2O2的含量来防御烟粉虱取食及其与TYLCCNV共侵染。本研究为进一步研究烟粉虱—双生病毒—宿主植物3者互作过程中ROS的作用及调控机制提供理论基础。
4 参考文献
[1] SUZUKI N,MITTLER R. Reactive oxygen species and temperature stresses:a delicate balance between signalling and destruction[J]. Physiologia Plantarum,2006,126:45-51.
[2] BAILEY-SERRES J,MITTLER R. The roles of reactive oxygen species in plant cells[J]. Plant Physiology,2006,141:311.
[3] SHADEL G S,Horvath T L. Mitochondrial ROS signalling in organismal homeostasis[J]. Cell,2015,163:560-569.
[4] BISWAS K,ADHIKARI S,TARAFDAR A,et al. Reactive oxygen species and antioxidant defence systems in plants:Role and crosstalk under biotic stress[M]. Switzerland:Springer Nature Switzerland AG,2020.
[5] BHATTACHARJEE S. Reactive oxygen species and oxidative burst:roles in stress,senescence and signal transduction in plants[J]. Current Science,2005,10:1113-1121.
[6] TORRES M A,DANGL J L. Functions of the respiratory burst oxidase in biotic interactions,abiotic stress and development[J]. Current Opinion in Plant Biology,2005,8:397-403.
[7] FUJITA M,FUJITA Y,NOUTOSHI Y,et al. Crosstalk between abiotic and biotic stress responses:a current view from the points of convergence in the stress signalling networks[J]. Current Opinion in Plant Biology,2006,9:436-442.
[8] DAT J,VANDENABEELE S,VRANOV? E,et al. Dual action of the active oxygen species during plant stress responses[J]. Cellular and Molecular Life Sciences,2000,57:779-795.
[9] GRANT M,BROWN I,ADAMS S,et al. The RPM1 plant disease resistance gene facilitates a rapid and sustained increase in cytosolic calcium that is necessary for the oxidative burst and hypersensitive cell death[J]. Plant Journal,2000,23:441-450.
[10] EBEL J,MITHOER A. Early events in the elicitation of plant defence[J]. Planta,1998,206:335-348.
[11] MITHOFER A,SCHULZE B,BOLAND W. Biotic and heavy metal stress response in plants:evidence for common signals[J]. FEBS Letters,2004,566:1-5.
[12] NARANJO S E,CASTLE S J,DE BARRO P J,et al. Population dynamics,demography,dispersal and spread of Bemisia tabaci[M]//Bemisia:Bionomics and management of a global pest. Dordrecht:Springer,2009:185-226.
[13] MALKA O,FELDMESSER E,BRUNSCHOT S V,et al. The molecular mechanisms that determine different degrees of polyphagy in the Bemisia tabaci species complex[J]. Evolutionary Applications,2021,14(3):807-820.
[14] LUAN J B,WANG X W,COLVIN J,et al. Plant-mediated whitefly-begomovirus interactions:research progress and future prospects[J]. Bulletin of Entomological Research,2014;104(3):267-276.
[15] JIU M,ZHOU X P,LIU S S. Acquisition and transmission of two begomoviruses by the B and a non‐B biotype of Bemisia tabaci from Zhejiang,China[J]. Journal of Phytopathology,2006,154(10):587-591.
[16] OROZCO-CARDENAS M,RYAN C A. Hydrogen peroxide is generated systemically in plant leaves by wounding and systemin via the octadecanoid pathway[J]. Proceedings of the National Academy of Sciences,1999,96(11):6553-6557.
[17] THORDAL-CHRISTENSEN H,ZHANG Z,WEI Y,et al. Subcellular localization of H2O2 in plants. H2O2 accumulation in papillae and hypersensitive response during the barley-powdery mildew interaction[J]. The Plant Journal,1997,11(6):1187-1194.
[18] KEMPEMA L A,CUI X P,HOLZER F M,et al. Arabidopsis transcriptome changes in response to phloem-feeding silverleaf whitefly nymphs. Similarities and distinctions in responses to aphids[J]. Plant Physiology,2007,143(2):849-865.
[19] 任利娜. TYLCCNV與烟粉虱共侵染对普通烟防御生理的影响[D]. 洛阳:河南科技大学,2019.
[20] ASAI S,MASE K,YOSHIOKA H. Role of nitric oxide and reactive oxygen species in disease resistance to necrotrophic pathogens[J]. Plant Signaling & Behavior,2010,5:872-874.
[21] L′ HARIDON F,BESSON-BARD A,BINDA M,et al. A permeable cuticle is associated with the release of reactive oxygen species and induction of innate immunity[J]. PLoS Pathogens,2011,7:e1002148.
[22] ZHANG L,OH Y,LI H,et al. Alternative oxidase in resistance to biotic stresses:Nicotiana attenuata AOX contributes to resistance to a pathogen and a piercing-sucking insect but not Manduca sexta larvae[J]. Plant Physiology,2012,160:1453-1467.
[23] SIMON U K,POLANSCH?TZ L M,KOFFLER B E,et al. High resolution imaging of temporal and spatial changes of subcellular ascorbate,glutathione and H2O2 distribution during Botrytis cinerea infection in Arabidopsis[J]. PLoS One,2013,8:e65811.
[24] GIOVANINI M P,PUTHOFF D P,NEMACHECK J A,et al. Gene-for-gene defense of wheat against the Hessian fly lacks a classical oxidative burst[J]. Molecular plant-microbe interactions,2006,19(9):1023-1033.
[25] DE-ILARDUYA O M,XIE Q G,KALOSHIAN I. Aphid-induced defense responses in Mi-1-mediated compatible and incompatible tomato interactions[J]. Molecular Plant-Microbe Interactions,2003,16(8):699-708.
[26] 汪伦记,任利娜,李晶晶,等. 烟草对烟粉虱取食及其与TYLCCNV共侵染的生理生化反应[J]. 植物保护学报,2019,46(4):860-867.
[27] LAMB C,DIXON R A. The oxidative burst in plant disease resistance[J]. Annual Review of Plant Physiology and Plant Molecular Biology,1997,48:251-275.
[28] DOKE N,OHASHI Y. Involvement of an O2? generating system in the induction of necrotic lesions on tobacco leaves infected with tobacco mosaic virus[J]. Physiological and Molecular plant pathology,1988,32(1):163-175.
[29] RADWAN D E M,FAYEZ K A,MAHMOUD S Y,et al. Salicylic acid alleviates growth inhibition and oxidative stress caused by zucchini yellow mosaic virus infection in Cucurbita pepo leaves[J]. Physiological and Molecular Plant Pathology,2006,69(4-6):172-181.
[30] RADWAN D E M,FAYEZ K A,MAHMOUD S Y,et al. Modifications of antioxidant activity and protein composition of bean leaf due to Bean yellow mosaic virus infection and salicylic acid treatments[J]. Acta Physiologiae Plantarum,2010,32(5):891-904.
(责编:何 艳)
基金项目 国家自然科学基金(31672036)。
作者简介 茹宁辰(1998—),男,河南济源人,在读硕士。研究方向:烟粉虱—双生病毒—宿主植物三者互作机制。
