环境DNA揭示东江流域水生昆虫生物多样性变化及影响因素
2023-05-30尹雪秦珊王宗阳殷旭旺张远
尹雪 秦珊 王宗阳 殷旭旺 张远


摘 要:以东江流域为例,通过环境DNA技术探究了水生昆虫群落的空间分布规律及其环境影响因子。结果显示:1)水生昆虫物种丰富度由高到低顺序为:双翅目(7科)>蜉蝣目(6科)>毛翅目(2科)=蜻蜓目(2科)=鞘翅目(2科)>鳞翅目(1科)。双翅目(84.99%)和蜉蝣目(14.89%)共占总reads数99.88%,摇蚊科(69.20%)、四节蜉科(14.36%)及蚊科(14.26%)三个科合计占总reads数97.82%。2)物种丰富度指数、香农维纳指数、辛普森指数与功能丰富度指数(FRic)、功能离散度指数(FDiv)均与距河口距离呈正相关关系。功能均匀度指数与距河口距离呈负相关关系。3)海拔是影响物种丰富度最重要的环境因子(P<0.01),COD是影响物种丰富度的重要环境因子(P<0.05)。海拔、DO、COD是影响功能丰富度的重要环境因子(P<0.05)。
关键词:东江流域;水生昆虫;物种多样性;功能多样性;环境DNA
中图分类号:S941.419
水生昆虫是河流生物多样性中重要生物类群[1]。水生昆虫对环境变化和人类干扰敏感,对干扰的反应范围广,我们可以通过其被干扰后的影响进行空间分析[2];水生昆虫有较长的生活周期,能综合反映较长时间段内的水体质量状况[3]。水生昆虫的生态学性状(如摄食方式、大小、生存位置、栖息地改造、移动性等)在很大程度上影响其生态功能贡献[4-5]。盛天进等[6]研究认为物种多样性有助于确定未来河流群落恢复差距。物种多样性虽被广泛使用,但其仅考虑物种的丰度和多度,忽视了物种的功能性状[7],近年来功能多样性概念得到重视,其是通过量化一个群落内的性状变异或多变量性状差异来理解群落和生态系统[8]。
环境DNA(Environmental DNA, eDNA)是指从土壤、水、冰川或沉积物等环境样品中提取的DNA,可揭示过去和现今的生物多样性信息[9]。与传统采样方法相比,该方法成本更低,样本采集受气候条件影响较小。近年使用环境DNA技术进行生物监测逐渐兴起。环境DNA最早应用于法国池塘中检测到北美牛蛙[10]。随着该方法研究的爆发式增长,不同样本类型的环境DNA在物种丰富度估算方面十分成功[9]。样本类型从淡水[11-13]、海洋[14-15]、陆地[16-18]到空气[19-20]。环境DNA技术的出现为水生生态系统生物多样性的研究开辟了一条新道路,具有极大的应用潜能。
目前,使用环境DNA技术对我国亚热带河流水生昆虫物种多样性及功能多样性变化研究仍处于空白。本研究选取我国典型亚热带河流东江水系为研究区域,旨在探究东江流域水生昆虫的群落多样性三个关键问题:一是东江流域水生昆虫的群落组成特征;二是流域内水生昆虫的空间格局分布规律;三是影响水生昆虫群落结构差异以及物种多样性的因素。
1 材料与方法
1.1 采样点的选择和样品的采集
东江为珠江流域三大水系之一,介于东经114°47′36″至115°52′36″,北纬24°20′30″至25°12′18″之间,位于珠江三角洲的东北端,地势东北高,西南低。干流全长 562 km,发源于江西省寻乌县桠髻钵山,流入广东省境内经龙川、东源、源城、紫金、惠阳、惠城、博罗至东莞市,最后注入狮子洋,经虎门出海,河道平均坡降0.388‰,流域面积35 340 km2。属亚热带季风湿润气候区[21],河流年均径流量257亿m3。本研究采样于2021年10月,共计51个样点,其中干流23点位、支流浰江6点位、石马河6点位、西枝江16点位,监测点位(见封三图1)示。
环境DNA样品使用Rocker过滤装置、0.45 μm混合纤维素脂滤膜过滤采集的水样,每500 mL过滤一个滤膜,使用灭菌镊子从边缘夹起滤膜,将其放置于5 mL无菌离心管内,-20 ℃干冰保存,带回实验室后保存于-20 ℃冰箱,直到提取DNA。过滤用的杯子在每次使用后均用纯净水冲洗2~3遍。
现场使用多参数水质监测仪(YSI Incorporated,Yellow Springs,USA)进行水质原位测定,包括pH、溶解氧(DO,mg/L)、电导率(EC,μS/cm)、水温(Temp,℃)、溶解性总固体(TDS,mg/L)、氧化还原电位(ORP,mV)、盐度(SAL,PSU)、叶绿素a(CHLA,μg/L)。另采集1 L水样送到实验室,按照中国国家标准测定方法测定:氨氮(NH+4-N,mg/L)、总氮(TN,mg/L)、总磷(TP,mg/L)、磷酸盐(PHOS,mg/L)、高锰酸盐指数(COD,mg/L)、硝酸盐(NO-3-N,mg/L)、亚硝酸盐(NO-2-N,mg/L)等指标。现场还用手持GPS进行经纬度定位和海拔高度测量。
1.2 DNA提取和PCR扩增
DNA提取步骤按照ZymoBIOMICSTM DNA Miniprep Kit说明书进行。正向引物fwhF2(5'-GGDACWGGWTGAACWGTWTAYCCHCC-3'),反向引物EPTDr2n(5'-AAACAAATARDGGTATTCGDTY-3'),采用上述eDNA模板进行水生昆虫的PCR扩增。引物fwhF2-EPTDr2n扩增长度在150~315 bp之间。25 μL反应体系包括:4 μL模板DNA、正反向引物各1 μL、2 μL dNTPs、2.5 μL Buffer、0.125 μL Taq HS以及14.375 μL DEPC。PCR反应程序为:95 ℃预变性30 s; 35个循环包括: 95 ℃變性5 s, 54 ℃退火30 s, 72 ℃延伸10 s; 72 ℃最后延伸5 min。51个采样点各设置一个阴性对照,PCR产物使用2%琼脂凝胶电泳检测。COI区域所有隐性对照均无目的条带,表明无外源污染。
1.3 高通量测序和数据处理
将等量PCR产物汇集在一起,使用Illumina PE150平台进行高通量测序。对测序得到的序列信息进行拼接得到原始数据,经质控和去嵌合体得到可用于后续分析的有效数据。对有效数据进行去冗余、去单一序列和97%相似度的OTU(Operational Taxonomics Table,可操作分类单元)聚类分析,根据OTU聚类结果,对每个OTU的代表序列数据库比对作物种注释,得到对应的物种信息和基于物种的丰度分布情况,即OTU Distribution Table(以下简称 OTU Table)。
1.4 生物信息学分析
采用图图云平台(www.cloudtutu.com)的alpha多样性指数工具包计算α多样性指数,散点图工具包中的spearman方法完成散点图的制作。利用参考文献[22-23]进行功能性状的等级划分。本研究选择水生昆虫的游泳能力、吸附能力、形状、生活型、营养习性、最大体长以及生活史等7个功能性状的27个等级性状纳入分析(见表1)。大多数性状信息基于百度百科(https://baike.baidu.com)及书籍[24-29]进行搜集。采用Rstudio软件FD功能包的dbFD函数计算功能多样性指数。使用SPSS 27.0.1对环境变量进行线性回归分析。保留ASL、pH、DO、ORP、SAL、CHLA、PHOS、COD、NO-2N等9个环境变量构建简约模型解释群落结构变化。采用凌波微课(http://www.cloud.biomicroclass.com)DCA分析工具包先做DCA分析。本研究DCA分析后第一轴值为1.39,故选择RDA分析。RDA分析前,为避免环境因子间的共线性,对环境因子数据进行了log(x+1)转换。使用凌波微课RDA分析工具包对环境因子进行可视化。Mantel test分析对α多样性指数与功能多样性指数的相关关系进行检验并在图图云平台进行可视化。物种多样性、功能多样性与环境变量之间关系的网络图与显著影响的环境变量相关性分析图叠加热图的Mantel Test分析以及偏曼特尔检验均使用图图云平台计算制作。采样点图用Arcgis10.7软件制作。
2 结果
2.1 东江水生昆虫物种组成
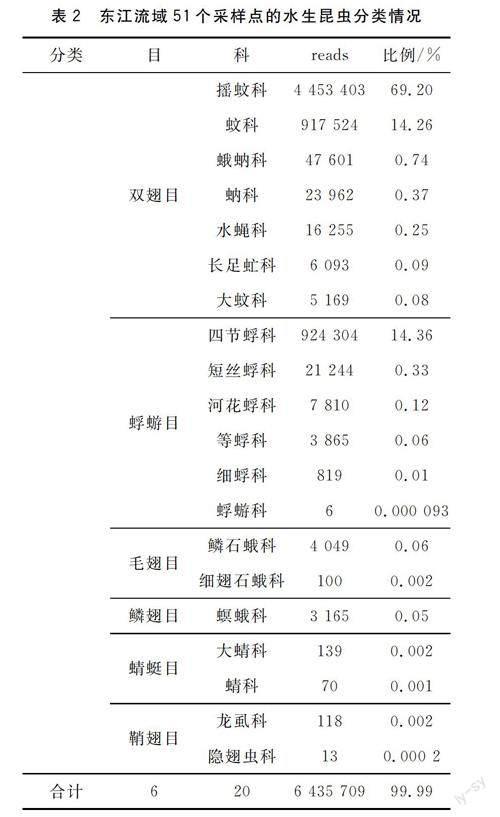
东江水生昆虫共获得57 142 012条reads,经过生物信息学过滤,保留了6 435 709个reads。在所有采样点和重复中,共获得昆虫纲6目20科89属166种。其中,双翅目和蜉蝣目为两大优势类群,共占总reads数99.88%,优势十分明显。摇蚊科(69.20%)、四节蜉科(14.36%)及蚊科(14.26%)三个科合计占总reads数97.82%,东江流域水生昆虫分类情况见表2。
2.2 物种多样性与功能多样性空间分布
对物种多样性空间格局统计分布(见封三图2-a、2-b、2-c),结果表明:物种丰富度指数范围在3~15之间;香农指数范围在0.03~1.75之间;辛普森指数范围在0.01~0.79之间。对东江流域水生昆虫物种多样性分析后发现,物种丰富度、香农指数、辛普森指数均呈现干流上游及支流高,干流中下游低的分布现象。
对功能多样性空间格局统计分布,见图2-d、2-e、2-f,结果表明:功能丰富度指数范围在0.63~12.06之间;功能均匀度指数范围为0~0.88;功能离散度指数范围在0.52~0.99之间。对东江流域水生昆虫功能多样性分析后发现,功能丰富度指数在干流上游及支流分布明显高于干流中下游,见图2-d;功能均匀度指数在干流上下游及支流分布较为均匀,见图2-e;功能离散度指数较高,且均匀分布在各个点位,见图2-f。
环境DNA还揭示了东江流域水生昆虫物种多样性及功能多样性随距河口距离变化的趋势。结果显示,物种丰富度指数(见图3-a)、Shannon指数(见图3-b)、Simpson指数(见图3-c)与FRic指数(见图3-d)、FDiv指数(见图3-f)均与距河口距离呈正相关关系。FEve指数(见图3-e)与距河口距离呈负相关关系。
2.3 水生昆虫生物多样性变化确定因素
通过方差膨胀因子去除共线性较高(VIF值>10)的环境因子EC、Temp、TDS、NH+4-N、TN、TP、NO-3-N等引起东江流域水生昆虫群落结构差异的影响因素,保留ASL、pH、DO、ORP、SAL、CHLA、PHOS、COD、NO-2-N等9个环境变量。冗余分析(RDA分析)结果显示,东江流域水生昆虫群落结构同时受ASL、COD(P<0.01)和PHOS(P<0.05),见图4。不同环境因子对各轴的贡献也不同。NO-2-N、COD、pH、CHLA、ASL与轴1相关,PHOS、SAL、DO、ORP与轴2相关。其中,NO-2-N、COD与轴1正相关,PHOS、SAL与轴2正相关。第一轴和第二轴分别可以解释采样点与环境关系的78.76%和9.94%。
跟着图5,沿着轴2正方向,PHOS、SAL逐渐增大、DO、ORP逐渐减小,蛾蚋科、摇蚊科、蚊科、螟蛾科、四节蜉科、水蝇科、龙虱科、蜉蝣科逐渐增多,其它水生昆虫逐渐减少。
使用偏曼特尔分析可以排除环境因子之间自相关的干扰,如图6(见封三)及表3所示,ASL是影响物种丰富度最重要的环境因子(P<0.01),COD是影响物种丰富度的重要环境因子(P<0.05)。 ASL、DO、COD是影响功能丰富度的重要环境因子(P<0.05)。
3 讨论
河流作为一个完整的生态系统,具有一定程度净化污染物的能力[30]。物种丰富度指数的分布情况可以说明东江干流中下游及西枝江下游采样点位于海拔较低处,且受生活污染的排放及土地利用格局变化的影响较大。东江源海拔较高,河岸为山林,人口较少,主要种植脐橙和蜜橘,属农业区,河流受干扰相对较少,水质较好。东江干流中游城镇人口多,受生活污染物的排放及有少量航运、渔业活动的影响较大,河岸遍布竹林;东江下游多为平地,气候条件适宜,更适合人类生存与城镇建设,因此下游城镇化水平比上、中游明显提高,工业化和城市化进程加速了经济发展的同时也引起了一系列环境问题,大量工厂和货运码头,航运频繁[31-32]。东江下游西枝江是东江的第二大一级支流,发源于惠州市惠东县与河源市紫金县交界处,流经惠东县、惠阳区、惠城区后汇入东江[33]。西枝江上游区域有自然保护区白盆珠水库,居民少,污染排放少,水质情况较好;而中游和下游区域人口相对集中,工业较为发达,点源污染占到污染源负荷的85%以上,西枝江下游部分水域处于东江干流剑潭库区内,水生态状况直接影响东江干流水质[34]。石马河为东江的一级支流,源于深圳市宝安区龙华镇大脑壳山,上接观澜河,寶安区工业企业分布密集,工业废水排放较多,剧烈的人类活动使石马河受污染严重[35]。浰江是东江流域一级支流,张辉等[36]研究表明浰江水体优势种较多,优势种的多样化也反映了浰江水体生境的多样性,整体而言,浰江受人类活动干扰小,河网结构相对简单,对生态变化抗性较弱。
各采样点间海拔的不同,会形成不同的水温和溶解氧含量,在源头溪流中,河岸带凋落物是溪流生态系统主要的能量来源,因此大型底栖动物以撕食者和集食者为主[37]。一些水生昆虫的有翼成虫常年存在,这些扩散能力强的水生昆虫对环境变化比较敏感,善于逃离不良环境,寻找新的栖息地的能力强。按河流连续理论,连续变化的河流其生物群落多样性常常会逐步降低[38]。Paller等[39]研究认为水生昆虫群落多样性会随着海拔的升高而逐步降低。但东江源头水体底质为卵石和砾石为主,人为干扰较少,可能促进了水生昆虫生物多样性的上升。
受环境因子的作用、筛选,生物性状是物种适应环境并长期进化的结果,在特定的栖息地环境条件下,會存在特定的生物性状[40]。近年来,对于生物多样性的调查由物种多样性扩展至功能多样性[23]。功能多样性考虑了群落组成物种的功能性状对生态过程的需求和响应[41]。目前,对于东江流域水生昆虫物种多样性和功能多样性的研究还很少。功能丰富度(FRic)、功能均匀度(FEve)、功能离散度(FDis)分别代表功能多样性的不同侧面,相互独立。FRic取决于物种所占据的功能生态位空间的大小,也取决于功能特征值的范围[42]。FEve指数衡量物种性状在已占据生态位空间的分布均匀程度, 值越高表明物种对环境资源的利用越充分[43]。FDis指数高说明生态位离散程度高,资源竞争程度低。物种多样性和功能多样性的空间分布特征存在一定的相关性(见图2)。FRic指数的空间分布格局与物种丰富度反映的格局一致,均呈现东江干流上游、支流高,中下游低的格局,可能是FRic十分依赖物种数目的原因[44]。主要因为物种越多,功能性状异质性越强,群落所占据的生态位空间一般也会越大,这和蒋万祥等[45]的研究一致。
距河口的距离,显示着沿河流的河源至河口的纵向梯度变化,水生昆虫沿着东江流域呈现纵向梯度的空间变化,在人类活动干扰和经济发展影响下,东江流域从上游至下游水体复杂性上升,水生昆虫生物多样性降低,物种多样性指数与功能多样性指数均随距河口距离的增加而增加。FEve指数越高表明物种对环境资源的利用越充分、性状分布越规律,可以说明东江源处的水生昆虫对环境资源的利用随着距河口距离越近,对环境资源的利用越充分、性状分布越规律。
由于地理位置、人为影响等因素的不同,以及河流各区段之间的相互关联,水体中的养分会表现出不同的变化特征[46],反映着该河流的主要污染因子及影响因素和可能来源,有助于评价水体被污染和自净的状况[47]。李飞龙等[48]研究表明不同水生态区间各类环境要素的差异性是造成EPT群落时空分布的内在原因。
排序分析反映了环境因子对物种组成的影响。线段越长代表该环境因子对物种分布的影响越大,环境因子与采样点之间的夹角能反映出环境因子与采样点的相关性。pH值、CHLA与ASL对大多数物种的影响呈正相关关系。
黄志伟[49]等研究发现与矿产开采及农业耕作活动较为频繁有关,东江流域中上游地区各类重金属含量相对较高。贾银涛等[50]研究发现采矿会使河流内悬浮物增多,生物栖息地多样性下降。因此,其他环境因子,如水体重金属含量也需作为可能影响水生昆虫群落变化的因素进行考量。另外,虽然我们的目标类群是水生昆虫物种,但我们也检测到了其它类群,如藻类。说明引物fwhF2-EPTDr2n不仅适用于昆虫,还适用于包括藻类在内的其他生物。COI区域的其它引物也出现了这样的现象[11]。缺乏针对水生昆虫的高特异性引物是一个重要问题。
4 结论
水生昆虫物种丰富度由高到低顺序为:双翅目(7科)>蜉蝣目(6科)>毛翅目(2科)=蜻蜓目(2科)=鞘翅目(2科)>鳞翅目(1科)。双翅目(84.99%)和蜉蝣目(14.89%)共占总reads数99.88%,优势十分明显。摇蚊科(69.20%)、四节蜉科(14.36%)及蚊科(14.26%)三个科合计占总reads数97.82%。
物种丰富度、香农指数、辛普森指数均呈现干流上游及支流高,干流中下游低的分布现象;功能丰富度指数在干流上游及支流分布明显高于干流中下游,功能均匀度指数在干流上下游及支流分布较为均匀,功能离散度指数较高,且均匀分布在各个点位。环境DNA还揭示了东江流域水生昆虫物种多样性及功能多样性随距河口距离变化的趋势。
海拔是影响物种丰富度最重要的环境因子(P<0.01),COD是影响物种丰富度的重要环境因子(P<0.05)。海拔、DO、COD是影响功能丰富度的重要环境因子(P<0.05)。
参考文献:
[1]
FENOGLIO S, FIGUEROA J, DORETTO A, et al. Aquatic insects and benthic diatoms: A history of biotic relationships in freshwater ecosystems[J].Water, 2020(10):1-14.
[2] EDWARD D W R, COLIN F, WEBB D W. Just how imperiled are aquatic insects? A case study of stoneflies (Plecoptera) in Illinois[J]. Annals of the Entomological Society of America,2005,98(6):941-950.
[3] 李金国.低级溪流中水生昆虫的群落特征及水质生物评价[D].哈尔滨:东北林业大学,2007.
[4] BELLO F D , LAVOREL S , SANDRA DAZ, et al. Towards an assessment of multiple ecosystem processes and services via functional traits[J]. Biodiversity & Conservation, 2010, 19(10):2873-2893.
[5] VILLNS A , HEWITT J , SNICKARS M , et al. Template for using biological trait groupings when exploring large-scale variation in seafloor multifunctionality[J]. Ecological Applications, 2017, 28(1):78-94.
[6] 盛天進,EVANCE MBAO,吴聪,等.浙江浦阳江大型底栖无脊椎动物物种多样性和生态功能恢复研究[J].环境监控与预警,2021,13(2):1-8.
[7] 夏治俊,刘飞,余梵冬,等.赤水河流域鱼类物种、功能和分类多样性研究[J].水生态学杂志,2022,43(5):89-98.
[8] CADOTTE M W, CARSCADDEN K, MIROTCHNICK N. Beyond species: functional diversity and the maintenance of ecological processes and services[J]. Journal of Applied Ecology, 2011, 48(5):1079-1087.
[9] KRISTY, DEINE, HOLLY, et al. Environmental DNA metabarcoding: Transforming how we survey animal and plant communities[J]. Molecular Ecology, 2017, 26(21):5872-5895.
[10] FICETOLA G F, MIAUD C, POMPANON F, et al. Species detection using environmental DNA from water samples[J]. Biology Letters, 2008(4):423-425.
[11] KRISTY, DEINER, EMANUEL, et al. Environmental DNA reveals that rivers are conveyer belts of biodiversity information[J]. Nature Communications, 2016,7(1):1-9.
[12] HANFLING, BERND, HANDLEY,et al. Environmental DNA metabarcoding of lake fish communities reflects long-term data from established survey methods. [J].Molecular ecology,2016,25(13):3101-3119.
[13] LACOURSIRE-R, ANAS, DUBOIS Y , et al. Improving herpetological surveys in eastern North America using the environmental DNA method[J]. Genome, 2016,59(11):991-1007.
[14] THOMSEN P F, PETER RASK MLLER, SIGSGAARD E E, et al. Environmental DNA from seawater samples correlate with trawl catches of subarctic, deepwater fishes[J]. PLoS ONE, 2016, 11(11):1-22.
[15] YAMAMOTO S , MASUDA R , SATO Y , et al. Environmental DNA metabarcoding reveals local fish communities in a species-rich coastal sea[J]. Scientific Reports, 2017, 7(1),1-12.
[16] HOPKEN M W,ORNING ELIZABETH K,YOUNG JULIE K,et al.Molecular forensics in avian conservation: a DNA-based approach for identifying mammalian predators of ground-nesting birds and eggs.[J].BMC research notes,2016,9(1):1-9.
[17] DRUMMOND A J, NEWCOMB R D, BUCKLEY T R, et al. Evaluating a multigene environmental DNA approach for biodiversity assessment[J]. GigaScience, 2015, 4(1):1-19.
[18] PANSU J, DANIELI S D, PUISSANT J, et al. Landscape-scale distribution patterns of earthworms inferred from soil DNA[J]. Soil Biology and Biochemistry, 2015,83:100-105.
[19] KRAAIJEVELD K, WEGER L D, M VENTAYOL GARCA, et al. Efficient and sensitive identification and quantification of airborne pollen using next-generation DNA sequencing.[J]. Molecular Ecology Resources, 2015, 15(1):8-16.
[20] ROWNEY F M,BRENNAN G L,SKJTH C A,et al. Environmental DNA reveals links between abundance and composition of airborne grass pollen and respiratory health[J]. Current Biology, 2021,31(9):1995-2003.
[21] 杨婷,张代青,沈春颖,等.基于能值分析的流域生态系统服务功能价值评估——以东江流域为例[J].水生态学杂志,2023,44(1):9-15.
[22] 蒋万祥,何逢志,蔡庆华.香溪河水生昆虫功能性状及功能多样性空间格局[J].生态学报,2017,37(6):1861-1870.
[23] 张潋波,刘东晓,刘朔孺,等.钱塘江中游水生昆虫群落功能多样性对土地利用变化的响应[J].应用生态学报,2013,24(10):2947-2954.
[24] 刘建康.高级水生生物学[M].北京:科学出版社,1999:241-259
[25] 周凤霞.淡水微型生物图谱[M].北京:化学工业出版社,2005:366-367.
[26] 李元胜.昆虫丽影[M].重庆:重庆大学出版社,2015:4-24.
[27] 黄仕杰.昆虫脸书[M].北京:商务印书馆,2015:10-168.
[28] 卢耽.图解昆虫世界:昆虫世界[M].北京:电子工业出版社,2012:173-176
[29] 韩永植.昆虫识别图鉴[M].郑州:河南科学技术出版社,2017:408.
[30] 张远,高欣,林佳宁,等.流域水生态安全评估方法[J].环境科学研究,2016,29(10):1393-1399.
[31] 李星,杨扬,乔永民,等.东江干流水体氮的时空变化特征及来源分析[J].环境科学学报,2015,35(7):2143-2149.
[32] 彭资,谷成燕,刘智勇,等.东江流域1989—2009年土地利用变化对生态承载力的影响[J].植物生态学报,2014,38(7):675-686.
[33] 秦建桥,何梓锋,黄洁妮,等.惠州市西枝江流域生态环境调查与生态安全评估[C]//中国环境科学学会.2017中国环境科学学会科学与技术年会论文集:第三卷,2017:520-529.
[34] 李思阳,张娟,姚玲爱,等.西枝江流域浮游植物群落结构特征与主要环境因子的关系研究[J].环境科学学报,2016,36(6):1939-1947.
[35] 高磊,陈建耀,王江,等.东莞石马河沿岸土壤重金属污染及生态毒性研究[J].土壤学报,2014,51(3):538-546.
[36] 张辉,袁世辉,姚志鹏,等.基于底栖动物的东江上游生态健康状况评价[J].水生态学杂志,2022,43(1):24-29.
[37] VANNOTE R L , MINSHALL G W , CUMMINS K W , et al. The river continuum concept[J]. Canadian Journal of Fisheries and Aquatic Sciences, 1980, 37(1):130-137.
[38] 王強,袁兴中,刘红.西南山地源头溪流附石性水生昆虫群落特征及多样性——以重庆鱼肚河为例[J].水生生物学报,2011,35(5):887-892.
[39] PALLER M H , SPECHT W L , DYER S A . Effects of stream size on taxa richness and other commonly used benthic bioassessment metrics[J]. Hydrobiologia, 2006, 568(1):309-316.
[40] TOWNSEND C R , HILDREW A G . Species traits in relation to a habitat templet for river systems[J]. Freshwater Biology, 1994, 31(3):265-275.
[41] VILLGER S, MIRANDA J R , DF HERNNDEZ, et al. Contrasting changes in taxonomic vs. functional diversity of tropical fish communities after habitat degradation[J]. Ecological Applications, 2010, 20(6):1512-1522.
[42] MASON N , MOUILLOT D , LEE W G , et al. Functional richness, functional evenness and functional divergence: The primary components of functional diversity[J]. Oikos, 2005, 111(1):112-118.
[43] VILLGER S, MASON N W H, MOUILLOT D. New multidimensional functional diversity indices for a multifaceted framework in functional ecology[J]. Ecology, 2008, 89(8): 2290-2301.
[44] ZHANG J T, XIAO J, LI L. Variation of plant functional diversity along a disturbance gradient in mountain meadows of the Donglingshan reserve, Beijing, China[J]. Russian Journal of Ecology, 2015, 46(2):157-166.
[45] 蔣万祥,渠晓东,吴乃成,等.神农架地区香溪河流域水生昆虫物种多样性与功能多样性研究[J].长江流域资源与环境,2021,30(6):1428-1436.
[46] 廖剑宇,彭秋志,郑楚涛,等.东江干支流水体氮素的时空变化特征[J].资源科学,2013,35(3):505-513.
[47] 刘景双,于君宝,闫百兴,等.第二松花江水体中氮含量的动态变化分析[J].环境科学,1997(1):15-17,93.
[48] 李飞龙,丁森,张远,等.太子河流域不同水生态区EPT群落时空分布特征[J].环境科学研究,2015,28(12):1833-1842.
[49] 黄志伟,李文静,李伟杰,等.东江流域土壤重金属污染特征及潜在风险评价[J].农业环境科学学报,2022,41(3):504-515.
[50] 贾银涛. 基于鱼类的东江上游及增江河流健康评价研究[D].北京:中国科学院大学,2010.
Environmental DNA revealed changes and influencing factors of aquatic insect species diversity in Dongjiang River Basin
YIN Xue1, QIN Shan2, WANG ZongYang2, YIN Xuwang1,ZHANG Yuan2
(1.Liaoning Provincial Key Laboratory of Hydrobiology,College of Fisheries and Life Sciences,Liaoning Province,Dalian Ocean University,Dalian 116023 China;2.Guangdong Provincial Key Laboratory of Water Quality Improvement and Ecological Restoration for Watersheds,School of Ecology,Environment and Resources,Guangdong Province,Guangdong University of Technology,Guangzhou 510006 China)
Abstract:Taking Dongjiang River Basin as an example,the spatial distribution of aquatic insect community and its environmental influencing factors were explored through environmental DNA technology.The results showed that: 1) The species richness of aquatic insects in descending order was Diptera (7 families)> Ephemeroptera (6 families)> Trichoptera (2 families) = Odonata (2 families) = Coleoptera (2 families) >Lepidoptera (1 family).Diptera (84.99%) and Ephemeroptera (14.89%) accounted for 99.88% of the total reads, while Chironomidae (69.20%), Tetrapaetidae (14.36%) and Heliidae (14.26%) accounted for 97.82% of the total reads.2) Species richness index, Shannon Wiener index, Simpson index, functional richness index (FRic) and functional dispersion index (FDiv) were positively correlated with the distance from estuarine. The FEve index of functional evenness was negatively correlated with the distance from estuary. 3) Elevation was the most important environmental factor affecting species richness (P<0.01), and COD was the most important environmental factor affecting species richness (P<0.05).Elevation, DO and COD were important environmental factors affecting function richness (P<0.05).
Key words:Dongjiang River basin; aquatic insects; species diversity; functional diversity; environmental DNA
(收稿日期:2023-01-11)
