椎体脂肪化对椎体骨质疏松性骨折风险的评价意义
2023-05-29徐荣健郑杰文何磊钱宇
徐荣健,郑杰文,何磊,钱宇
(1.温州医科大学,浙江 温州 325031;2.绍兴市人民医院骨科,浙江 绍兴 312035;3.绍兴文理学院,浙江 绍兴 312000;4.浙江省中医院骨科,浙江 杭州 310060)
骨质疏松是一种由于矿物质大量流失导致骨量下降而令骨折风险提高的疾病,由于人口老龄化加剧,骨质疏松患者的比例明显上升,由此引发的骨质疏松性骨折(vertebral osteoporotic fracture,VOF)和相应并发症的风险也随之增加[1-2],因此,尽早发现疾病并可靠地评估骨质疏松症患者的椎体骨折风险对于预防椎体骨折和相应并发症是十分必要的。成骨细胞和脂肪细胞来源于共同的祖细胞间充质干细胞(mesenchymal stem cell,BMSC),生理状态下,在过氧化物酶体增殖物活化受体γ(peroxisome proliferator-activated receptor gamma,PPAR-γ)、乙型转化生长因子(transforming growth factor beta,TGF-β)等因素的作用下,它们的分化处于平衡状态[3-4]。但是在某些病理状态下,如骨质疏松症,这种平衡态就会被破坏,从而导致脂肪量的增加和骨量的减少[5],进而导致VOF的发生。因此本研究主要通过测量椎体脂肪化面积比(vertebral fat area ratio,VFAR)、椎体脂肪信号强度比值(vertebral fat signal ratio,VFSR)和椎体脂肪化指数(vertebral fat index,VFI)并评估其对VOF早期诊断的重要意义。
1 资料与方法
1.1 一般资料 纳入标准:(1)行椎体后凸成形术(percutaneous kyphoplasty,PKP)患者和体检患者;(2)行腰椎MRI常规序列及血生化检查;(3)行PKP患者能与同时期体检患者根据性别年龄相互配对。排除标准:(1)患有相关内分泌疾病,如先天性骨代谢异常、甲状旁腺亢进或功能减退等疾病;(2)长期服用影响骨质的药物,如华法林;(3)患有肿瘤、或者影响骨代谢的胃肠道疾病、血液系统疾病等疾病史患者。
本研究收集了2016年4月至2021年6月在绍兴市人民医院记录在册骨质疏松性骨折并行PKP手术患者及同时期体检患者共1 009例,在排除有严重代谢病、具有肿瘤病史等患者后根据性别、年龄进行相互配对,配对后剩余168例,进入最终的研究队列(见图1)。其中,男58例,女110例;年龄50~89岁,平均(64.78±7.32)岁。将配对后的数据分为骨折组和非骨折组,根据其MRI影像测量VFAR、VFSR、VFI并结合基线数据进行统计学分析。骨折组的合并症较多,35%的患者有高血压,24%的患者有高脂血症,且其血脂水平、甲状腺功能和非骨折组比较,差异有统计学意义(P<0.05)。48%患者的年龄主要分布在60~69岁区间内,大多数的患者是女性(65%),骨折组82%患者生活环境是农村,而非骨折组44%患者生活环境是农村(见表1)。

图1 符合条件参与者的流程图
1.2 检查方法
1.2.1 MRI成像 应用西门子1.5 MR核磁扫描仪进行腰椎成像。患者体位取仰卧位,行腰椎矢状位扫描,MRI T1加权成像参数如下:重复时间540 ms,回波时间9 ms,视野280 mm,矩阵320 mm×80 mm,层厚4 mm,间隔0.2 mm,平均次数2次,层数13层,翻转角150 °,扫描时间 1分51秒。
1.2.2 图像后处理分析 将配对好的受检者MRI影像数据导出,然后由两名经验丰富的骨科医师在Photoshop上对椎体脂肪的面积和信号值进行定量测定。选取L1~4椎体各个影像中矢状位层面中脂肪化最严重椎体层面作为感兴趣区域(region of interest,ROI),首先采用T1加权像图像,甄别脂肪化,再在T2加权像和脂肪抑制像上进行进一步鉴别,最后再在T1加权像上进行测量。测量时尽量避免选中椎间盘、椎后静脉丛等解剖异常区域,同时标记出背部脂肪所在区域,测量其灰度值(见图2)。分别计算出VFAR(椎体脂肪化区域面积÷所在椎体矢状位面积)、VFSR(所在椎体矢状位平均灰度值÷背部脂肪灰度值)、VFI(VFAR÷VFSR)。
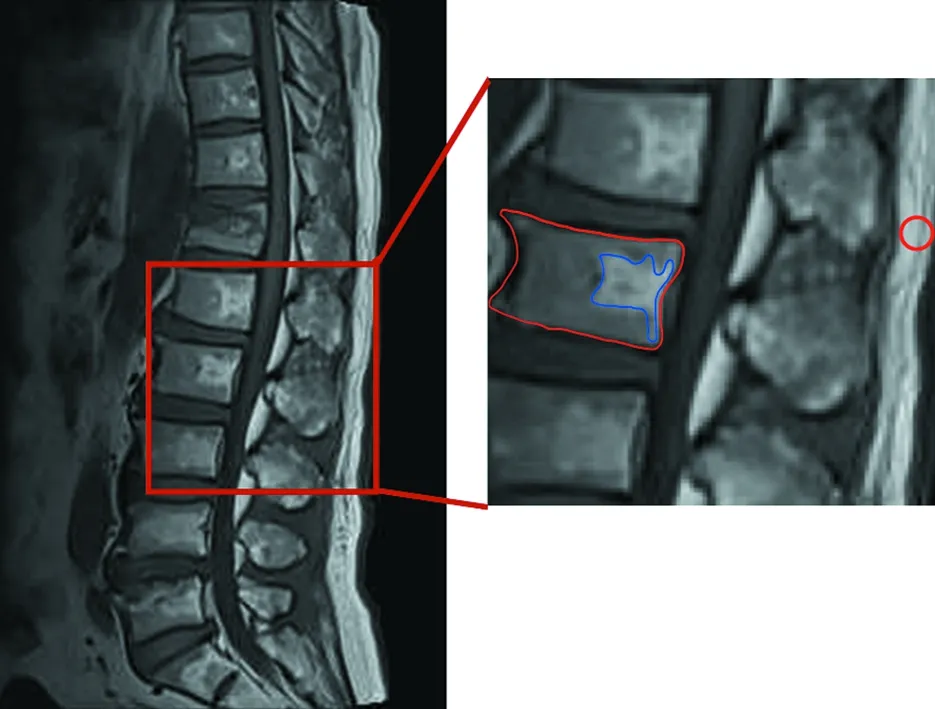
图2 MRI T1像上勾画椎体病变部位最大矢状面,分别测量VFAR、VFSR、VFI

2 结 果
2.1 骨折组和非骨折组及亚组比较分析
2.1.1 骨折组与非骨折组分析 比较了骨折组和非骨折的VFAR、VFSR和VFI,并进行配对样本t检验分析,骨折组的VFAR、VFSR和VFI显著高于非骨折组,差异均有统计学意义(P<0.05,见图3)。

图3 骨折组和非骨折组比较分析
2.1.2 性别年龄亚组分析 将骨折组和非骨折组分别根据性别和年龄进一步细分亚组,在性别亚组中,不论是男性还是女性,骨折组VFAR和VFI显著高于非骨折组,差异均有统计学意义(P<0.05,见图4)。在年龄亚组中,60~69岁区间内骨折组和非骨折组VFAR和VFSR差异有统计学意义(P<0.05)。>70岁区间骨折组VFAR、VFSR和VFI显著高于非骨折组,差异均有统计学意义(P<0.05,见图5)。

图4 按性别亚组比较分析
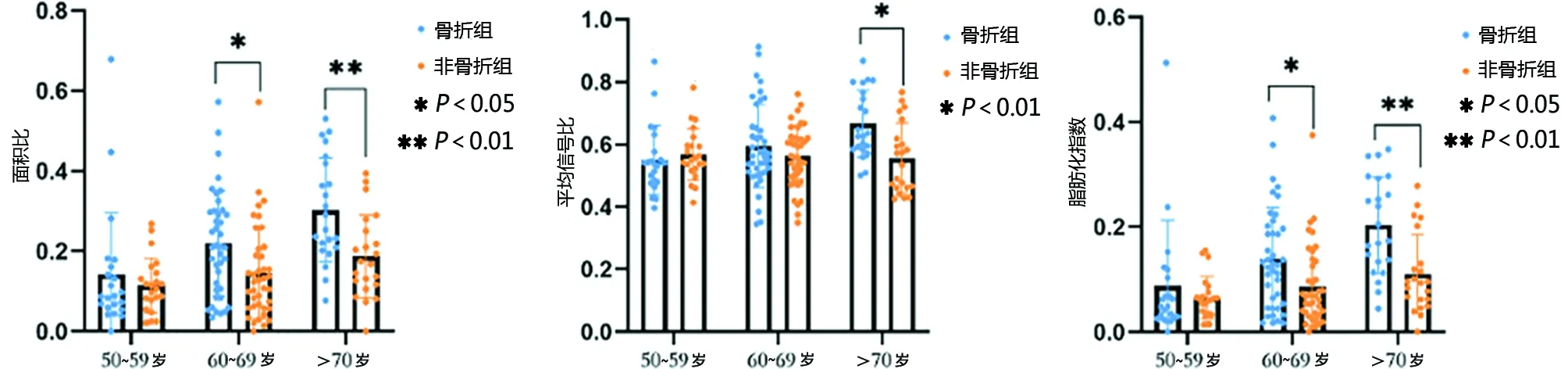
图5 按年龄亚组比较分析
2.2 ROC曲线分析 VFAR判断VOF的ROC曲线下面积为0.643 0,95%CI 55.91%~72.69%,诊断VOF的最佳截断值为0.157 6,其灵敏度和特异度为90.24%、53.85%。VFSR判断VOF的ROC曲线下面积为0.580 8,95%CI 49.45%~66.71%,诊断VOF的最佳截断值为0.741 5,其灵敏度和特异度为20.24%、96.43%。VFI判断VOF的ROC曲线下面积为0.645 5,95%CI 56.14%~72.97%,诊断VOF的最佳截断值为0.102 2,其灵敏度和特异度为59.52%、73.81%(见图6)。
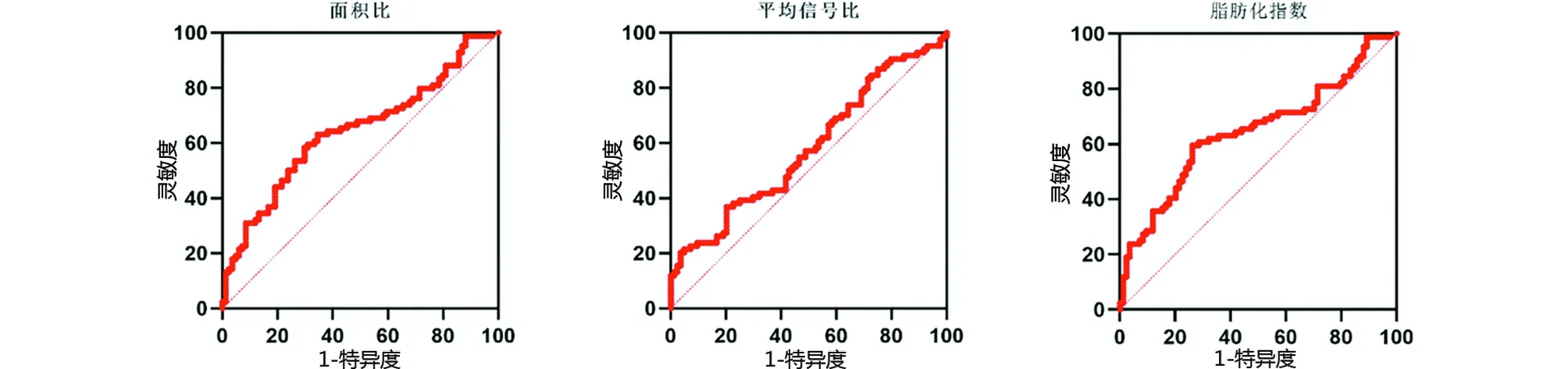
图6 VFAR、VFSR、VFI诊断OVCF的ROC曲线
3 讨 论
骨质疏松症是一种以低骨量为特点或骨微结构退化、骨强度降低,从而导致骨折风险增加的系统性骨骼疾病[6-7]。骨折是骨质疏松最具破坏性的后果,具有高发病率和高死亡率的特点,据估计发生髋部骨折后1年之内20%患者会死于各种并发症,约50%患者致残,会带来沉重的家庭和社会负担[2]。在骨质疏松症的进展过程中,骨量的减少一方面是由于破骨细胞和成骨细胞失衡导致的,另一方面,BMSC成骨分化能力减弱,成脂分化能力增强,导致骨形成下降和骨髓脂肪组织堆积,椎体脂肪化程度也随之增加[8-9]。因此,椎体脂肪化可能是骨质疏松症骨折的危险因素。
由于MRI能够对脂肪体积分数进行相对精确的估计[10]。因此,测量脂肪化程度已被提议作为一种非侵入性工具来诊断多种疾病,例如肝脂肪变性[11]。在本研究中,骨折组的VFAR、VFSR、VFI高于非骨折组,差异有统计学意义,表明了基于MRI T1影像资料测量得到的VFAR、VFSR、VFI可以区别有无椎体骨折的骨质疏松患者,这表明其也可能是骨折风险的有效评估工具,这与以往研究得出的结论基本一致[1,12]。最近一些研究发现,椎体的脂肪含量与腰椎骨密度呈负相关[13-14],有助于预测和评估骨质疏松症,与本研究结果类似,不过在之前的研究中,仅评估了绝经后妇女的椎体脂肪含量和骨密度,然而本研究中将骨折组和非骨折组细分性别亚组时,不论男性组还是女性组,骨折组和非骨折组差异均有统计学意义,表明这可能是人群中存在的普遍情况。在年龄亚组中,随着年龄的增长,骨折组和非骨折组椎体脂肪化程度的差异显示出逐渐增加的趋势,说明随着年龄的增长,骨折组和非骨折组之间的VFAR、VFSR、VFI差异越显著,越能预测骨质疏松性骨折,这可能与年龄是骨质疏松椎体骨折的独立危险因素有关[15],即随着年龄增加,BMSC分化由成骨向成脂方向偏移,同时破骨细胞处于激活状态,椎体大量丢失的骨量逐渐被脂肪所替代,MRI影像上的VFAR、VFSR、VFI也随之逐渐增加,最终导致的结果是骨质疏松椎体骨折危险也逐渐增加[16]。同时本研究发现血脂含量过高,甲状腺功能偏低、高血压糖尿病等并发症为骨质疏松性骨折的危险因素,这与既往研究基本相符[15,17-18]。
重要的是将VFAR、VFSR、VFI的诊断性能与常规测量,如骨密度(bone mineral density,BMD)或CT值的诊断性能进行比较,这些测量目前通常用于骨质疏松性骨折的诊断[19-20]。通过双能X射线骨密度仪测量的BMD被广泛用作骨质疏松症的诊断工具,因为它反映了整体骨量。然而,BMD不能提供有关骨骼微结构的信息,这可能是骨折发生的重要因素。另一方面,CT值可以提供关于骨骼微结构的信息,但辐射剂量相对较高,并且在常规临床环境中没有广泛使用。通过MRI测量的VFAR、VFSR、VFI可以提供额外的骨折风险信息,并且作为一种非侵入性工具,它不会使患者暴露于电离辐射中。
本研究有一定的局限性,(1)本研究为小样本数据且缺乏长期随访研究。只有168例病例纳入分析,大量患者被排除在研究之外,这可能影响了样本的代表性。排除率高的可能原因包括严格的入选和排除标准,以及难以招募符合标准的患者。在未来的研究中会增加病例样本量,多中心研究椎体脂肪化是否可以作为骨质疏松性骨折的生物学诊断指标会更有意义。(2)本研究获得的影像资料仅在创伤或症状发作后而不是之前进行扫描,需要在骨折发生前评估的前瞻性研究来评估个体骨折风险。(3)需要更多的研究来比较VFAR、VFSR和VFI的诊断性能与常规测量(如BMD或CT值)的诊断性能,并探索VFAR、VFSR和VFI在常规临床实践中的应用潜力。
综上所述,本研究表明,VFAR、VFSR和VFI作为非入侵性生物标志,对诊断椎体骨质疏松性骨折有一定价值,从临床角度看,评价患者椎体脂肪化程度有望成为无创性评估骨质疏松性骨折风险的实用工具。
