金黄色葡萄球菌感染下骨细胞对破骨细胞分化形成的影响研究
2023-05-29仪洋洋刘飞飞阮玉山李绍波张磊李颖任莉荣
仪洋洋,刘飞飞,阮玉山,李绍波,张磊,李颖,任莉荣
(大理大学第一附属医院脊柱外科,云南 大理 671000)
骨髓炎是骨组织以金黄色葡萄球菌为主要病原菌的一种感染性疾病,以严重的炎性反应及进行性的骨破坏为特征[1],常导致感染性骨缺损、骨不连,是骨科的一大治疗难题。目前,关于炎性骨破坏的具体发生机制尚不清楚。骨细胞作为骨组织内数目最多的细胞,其由成骨细胞进一步分化而来。研究发现,骨细胞可合成分泌许多细胞因子及信号分子,来调节成骨细胞及破骨细胞的活性,在骨重建及骨组织内环境稳态的维持方面发挥着极其重要的作用[2]。但骨细胞在炎性骨破坏发生机制中的作用如何,相关研究甚少。本研究通过金黄色葡萄球菌感染骨细胞获取骨细胞来源的条件培养基(conditioned medium,CM),并使用该条件培养基对破骨细胞前体细胞(RAW264.7细胞)进行诱导培养,观察破骨细胞分化形成的情况,并检测破骨细胞分化形成标志性基因的表达情况,探讨金黄色葡萄球菌感染下骨细胞对破骨细胞分化形成的影响。
1 材料与方法
1.1 主要试剂及仪器 MLO-Y4细胞、RAW264.7细胞系(均购于昆明动物所),金黄色葡萄球菌(ATCC 4330),磷酸盐缓冲盐溶液(phosphate buffered saline,PBS)及H-DMEM培养基(HyClone公司),胎牛血清(杭州四季青生物工程有限公司),溶菌酶(Solarbio公司),核因子-κB受体活化因子配体(receptor activator for nuclear factor-κB ligand,RANKL)(R&D Systems公司),抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRAP)染色试剂盒(Sigma公司),RNA抽提试剂盒(Thermo Fisher公司),A PrimeScriptTMRT reagent kit with gDNA Eraser(Perfect Real Time)及SYBR Premix Ex TaqTMⅡ(Tli RNase H Plus) 购于宝生物工程(大连)有限公司,酶标仪(Thermo Fisher Scientific公司),CFX96 Real-time System(BIO-RAD公司)。
1.2 金黄色葡萄球菌感染骨细胞后骨细胞源性CM的获得 将MLO-Y4细胞接种到Ⅰ型胶原涂层板上培养35 d获得骨细胞,期间2~3 d换液1次。随后金黄色葡萄球菌活菌以40∶1的感染复数感染骨细胞4 h,4 h后用溶菌酶灭活细胞外金黄色葡萄球菌,更换新鲜培养基后,细胞继续培养72 h,随后收集培养基获得骨细胞源性CM。
1.3 CM对RAW264.7细胞的诱导培养 阳性对照组(RANKL组)使用100 ng/mL的RANKL进行诱导培养,实验组(30%CM组)使用体积分数为30%的CM进行诱导培养,空白对照组(PBS组)使用等体积的PBS诱导培养。按实验分组将RAW264.7细胞分别接种于96孔板及6孔板,待细胞铺满孔底约60%更换新鲜培养基。对应孔分别加入诱导培养液,每2~3 d换液1次,换液后重新加入诱导液。共诱导培养5 d,5 d后96孔板使用TRAP染色试剂盒染色,6孔板收集细胞后进一步提取RNA行RT-qPCR检测。
1.4 TRAP染色 按TRAP染色试剂盒说明书的操作步骤配制染液并进行染色。简单步骤为:去离子水清洗2遍,固定液固定细胞30 s,之后去离子水清洗3遍,加入TRAP染液,避光条件下染色1 h。随后去离子水再次清洗3遍,加入苏木素染色1 min,碱性自来水漂洗4遍后,在倒置相差显微镜下观察,将图像放大100倍,计数每个视野下破骨细胞的数目(破骨细胞的界定:TRAP染色阳性,且细胞核≥3个)。
1.5 RT-qPCR检测破骨细胞标志性基因的表达 根据实验分组,对应时间点收集6孔板内的RAW264.7细胞,按GeneJET RNA抽提试剂盒的操作手册提取RNA,反转录合成cDNA(按Takara公司PrimeScriptTMRT reagent Kit with gDNA Eraser的操作步骤合成cDNA),并按Takara公司SYBR Premix Ex TaqTM的操作步骤进行RT-qPCR反应。检测对应时间点破骨细胞特异性基因的表达情况:TRAP、calcitonin receptor(Cal R)、cathepsin K(Cathe K)及MMP-9,目的基因的表达量均通过甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)进行标准化,通过2-ΔΔCt的方法计算各目的基因的相对表达量。实验使用的引物序列,TRAP:正向(5′-3′)GCGACCATTGTTAGCCACATACG,反向(5′-3′)CGTTGATGTCGCACAGAGGGAT;calcitonin receptor(Cal R):正向(5′-3′)TGGTGCGGCGGGATCCTATAAGT,反向(5′-3′)AGCGTAGGCGTTGCTCGTCG;cathepsin K(Cathe K):正向(5′-3′)AGCAGAACGGAGGCATTGACTC,反向(5′-3′)TTTAGCTGCCTTTGCCGTGGC;MMP-9:正向(5′-3′)GCTGACTACGATAAGGACGGCA,反向(5′-3′)GCGGCCCTCAAAGATGAACGG;GAPDH:正向(5′-3′)CCCAGAAGACTGTGGATGG,反向(5′-3′)CAGATTGGGGGTAGGAACAC。

2 结 果
2.1 TRAP染色结果 RAW264.7细胞诱导培养5 d后,PBS组基本无破骨细胞分化形成,30%CM组及RANKL组均见明显的破骨细胞形成(见图1),图像放大100倍,每个视野下破骨细胞的数目分别为:PBS组(0.231±0.203)个,30%CM组(19.154±2.115)个,RANKL组(52.000±3.317)个。各组间比较差异均具有统计学意义(P<0.05),30%CM组诱导形成的破骨细胞数目明显多于PBS组,但少于RANKL组。
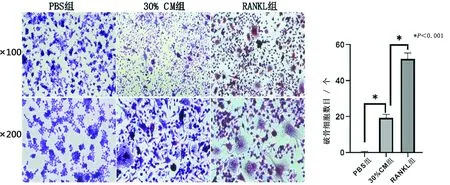
a 各组破骨细胞分化形成的情况(TRAP染色) b 各组破骨细胞分化形成数目分析
2.2 RT-qPCR结果 RAW264.7细胞诱导培养5 d后,30%CM组及RANKL组均导致破骨细胞分化形成的标志性基因:TRAP、calcitonin receptor(Cal R)、cathepsin K(Cathe K)、MMP-9的表达增高,均高于PBS组(见图2)。各组间比较,差异均具有统计学意义(P<0.05)。
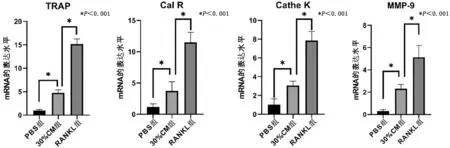
a TRAP的表达情况 b calcitonin receptor(Cal R)的表达情况 c cathepsin K(Cathe K)的表达情况 d MMP-9的表达情况
3 讨 论
正常骨骼为一无菌的组织,其持续不断地进行着骨重建,而成骨细胞、破骨细胞及骨细胞则紧密地调节着骨的重建过程。成骨细胞起源于间充质干细胞,并进一步分化成骨细胞,调节骨的形成;而破骨细胞起源于造血细胞的单核巨噬细胞系,调节骨的吸收。目前关于感染性骨缺损、骨不连发生机制的研究发现,在骨形成方面,细菌生物膜及炎性细胞因子抑制了骨髓间充质干细胞的成骨分化能力[3],而金黄色葡萄球菌则抑制了成骨细胞的增殖并诱导其凋亡[4],金黄色葡萄球菌还能通过金黄色葡萄球菌A蛋白(Staphylococcal protein A,SPA)、杀白细胞素及凝固酶等抑制成骨细胞对Ⅰ型胶原、骨钙素、骨桥蛋白等的合成[4]。此外,在体内及体外的实验研究中均发现,金黄色葡萄球菌还可侵入成骨细胞,进而引起成骨细胞的死亡,而侵入成骨细胞的金黄色葡萄球菌还可在其内存活并增殖,并被认为与慢性骨髓炎及复发性骨髓炎的发生有一定关系[5-6]。在骨吸收方面,金黄色葡萄球菌[7]及其菌壁蛋白(SPA[8]、脂磷壁酸[9-10]、肽聚糖[11-12])均具有促进破骨细胞分化形成、增强骨吸收活性的作用,金黄色葡萄球菌同样可侵入破骨细胞,并在破骨细胞内自我复制[13]。由此可见,金黄色葡萄球菌感染导致的炎性骨破坏、骨缺损,是其抑制骨形成并促进骨破坏增加的共同结果。
骨细胞是由成骨细胞分化而来,占骨骼内细胞总数的90%~95%,散落于骨基质中。骨细胞被一个直径为15~20 μm的腔隙包围,骨细胞的树突通过狭窄的小管穿过骨基质。骨细胞的腔隙和小管被称为腔隙-小管系统(lacunar-canalicular system,LCS),液体可通过该系统为骨细胞提供养分,维持骨细胞的活性及功能,并通过该系统实现细胞间的信号传导。骨细胞作为一种多功能的信号感知细胞,可调节成骨细胞及破骨细胞的活性,在骨组织内环境稳态的维持方面发挥着极其重要的作用[2]。研究发现,在金黄色葡萄球菌感染下,金黄色葡萄球菌同样可以侵入骨细胞,并在细胞内长期存活,且并不引起骨细胞死亡增加[14]。课题组使用感染复数为40∶1对骨细胞感染4 h后撤出,细胞再继续培养的过程中,细胞并未发生凋亡坏死增多的情况,这一结果与上述结果一致。但金黄色葡萄球菌感染下,骨细胞对成骨细胞及破骨细胞的影响如何,其是否调控骨形成及骨破坏,参与炎性骨破坏的病理过程未见相关报道。本研究在金黄色葡萄球菌感染骨细胞后,骨细胞来源的条件培养基作用于破骨细胞前体细胞RAW264.7细胞后发现,其诱导RAW264.7细胞向破骨细胞分化,导致破骨细胞分化形成的数目增多,并导致破骨细胞标志性基因的表达增高。提示在金黄色葡萄球菌的感染下骨细胞可合成分泌一些活性分子促进破骨细胞的分化形成,导致骨破坏增加,进而参与炎性骨破坏的进程。但具体的活性成分及其分子机制,有待进一步研究。并且,骨细胞源性活性分子的产生,是金黄色葡萄球菌菌壁蛋白、毒力因子或是金黄色葡萄球菌侵入骨细胞引起,具体机制如何,仍需进一步研究。
破骨细胞由单核巨噬细胞系分化而来,是目前已知的唯一具有骨吸收活性的细胞,在破骨细胞的分化形成过程中,巨噬细胞集落刺激因子(macrophage-colony stimulating factor,M-CSF)及RANKL起到极其重要的作用,代表了破骨细胞分化形成的经典信号通路。而其他一些细胞因子,如肿瘤坏死因子(tumor necrosis factor,TNF)-α、白细胞介素(interleukin,IL)-1、IL-6、IL-11、LIGHT等,则可替代M-CSF或RANKL来促进破骨细胞的分化形成,进而代表了破骨细胞分化形成的非经典信号通路[15]。本研究在金黄色葡萄球菌感染骨细胞后,骨细胞源性条件培养能诱导破骨细胞分化形成增多,但其培养基内起作用的具体成分不得而知,是通过RANKL的合成增多,再通过经典信号通路促进破骨细胞的分化形成;还是通过炎性细胞因子合成增多,如TNF-α、IL-1、IL-6等,再通过非经典信号通路促进破骨细胞分化形成;或是通过细胞外囊泡,携带细胞因子、RNA等来促进破骨细胞分化形成;亦或是上述机制的共同作用,导致破骨细胞分化形成的增多,均有待进一步研究。
综上所述,本研究从骨细胞的角度出发,探讨了金黄色葡萄球菌感染下骨细胞对破骨细胞分化形成的影响。研究发现,金黄色葡萄球菌感染下骨细胞可合成分泌一些活性分子,诱导破骨细胞分化形成增多。由此提示,在炎性骨破坏的发生过程中,除了金黄色葡萄球菌及其菌壁成分直接导致破骨细胞分化形成增多外,骨细胞及成骨细胞[16]均可通过信号分子促进破骨细胞的分化形成增多。因此,骨细胞作为骨组织内数目最多、存活时间最长的细胞,深入探讨炎性环境下骨细胞对成骨细胞及破骨细胞的调节作用,便于揭示炎性骨破坏的发生机制,有望为骨髓炎的治疗提供新的思路及靶点。
