西洛他唑改善2型糖尿病小鼠肠黏膜屏障损伤的机制
2023-05-29宋平义蒋世秋檀佳璐
宋平义,蒋世秋,胡 娟,檀佳璐,杨 岚,王 强
(西安交通大学第一附属医院麻醉手术部&脑科学中心,陕西西安 710061)
肠黏膜屏障是将体内、体外环境分开,并参与维护机体内环境稳态的重要防御屏障。肠黏膜屏障的完整性具有保护机体免受肠道有害微生物及其代谢物影响的作用[1]。2 型糖尿病(type 2 diabetes mellitus,T2DM)患者肠黏膜屏障功能受损可导致微生物产物全身性内流,从而增加肠道感染风险和全身炎症风险[2-3]。因此,维持肠黏膜屏障正常功能对于T2DM患者有至关重要的意义。
T2DM 患者血清中血小板P2Y12受体表达显著增加并呈持续性激活状态,表现为血小板黏附、聚集和促凝作用的增强,且有研究表明,慢性高血糖和餐后高血糖状态与血小板活化增强相关[4-6]。同时,抑制血小板活化可以改善脓毒症肠屏障功能损伤,表明活化的血小板可能与脓毒症时肠黏膜屏障功能受损有关[7]。西洛他唑是一种新型血小板聚集抑制药,通过抑制炎症改善T2DM 患者的代谢异常和全身胰岛素抵抗,广泛应用于预防和治疗多种糖尿病慢性并发症[8-9]。研究表明,在非酒精性脂肪性肝病中,血小板依赖于P2Y12受体释放的CD40 配体(CD40L)与CD40作用从而激活CD8+T 细胞发挥抗肿瘤免疫的作用[10]。血小板CD40L 还可通过诱导胶质细胞活化破坏高血压大鼠模型的血脑屏障,从而介导脑的炎症损伤[11]。然而,西洛他唑是否可以通过抑制血小板活化改善糖尿病肠黏膜屏障损伤尚不清楚。本实验选用db/db糖尿病小鼠和对照m/m 小鼠,采用西洛他唑干预的方式,通过检测肠黏膜屏障功能以探究西洛他唑对T2DM 肠屏障损伤的影响。
1 材料与方法
1.1 实验动物
无特定病原体级别的8周龄雄性db/db小鼠和相同条件的对照m/m 小鼠,购买自江苏集萃药康生物科技股份有限公司,饲养于西安交通大学第一附属医院脑科学研究中心SPF动物房,室温21~25℃,相对湿度50%~60%,12 h/12 h昼夜交替光照。db/db小鼠为每2~3只一笼,对照m/m 小鼠为每4只小鼠一笼进行饲养,可自由进食与饮水。所有动物实验均按照西安交通大学动物研究所制定的标准进行。
1.2 生物信息学分析
通过GEOquery 包从GEO 数据库中下载GSE142153数据集,获取糖尿病及对照组患者基因集。通过limma包Normalize Between Arrays函数再次标准化数据,利用limma包进行差异分析(倍数变化>2或<0.5,P<0.05)。差异分析结果用火山图进行可视化,差异基因用clusterProfiler包进行富集分析。
1.3 材料与试剂
西洛他唑(cilostazol,cilo)购买自美国MedChemExpress公司;sCD40L ELISA 试剂盒购自武汉云克隆科技股份有限公司;4 ku异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-葡聚糖(dextran)购买自美国Sigma公司;兔抗CD40购买自美国Abcam公司;兔 抗ZO-1 购 买 自 美 国Affinity 公 司,兔 抗Occludin购买自中国ABclonal公司,兔抗β-Tubulin 购买自中国ABclonal公司。
1.4 动物分组及干预
将db/db小鼠和对照m/m 小鼠随机分为m/m+溶剂组、m/m+西洛他唑组、db/db+溶剂组、db/db+西洛他唑组,每组10只小鼠。其中m/m+西洛他唑组及db/db+西洛他唑组小鼠给予西洛他唑处理,西洛他唑溶解于5 g/L羧甲基纤维素钠盐(carboxymethyl cellulose sodium salt,cmc),m/m+溶剂组和db/db+溶剂组给予等量5 g/L羧甲基纤维素钠盐溶剂处理,采取灌胃给药的方式,并根据体质量大小以30 mg/(kg·d)的药物剂量及等量溶剂给药4周。
1.5 ELISA检测CD40L水平
各组小鼠禁食12 h后,通过异氟烷麻醉小鼠并眼眶取血,室温静置2 h后,3 000 r/min离心10 min收集小鼠血清,并严格按照ELISA 试剂盒说明书步骤操作,检测血清可溶性CD40L(sCD40L)水平。
1.6 Western blotting检测蛋白表达
小鼠经过异氟烷麻醉后,取小鼠小肠组织立即制备蛋白样品或置于-80℃冰箱待用。在小肠组织中加入适量快速裂解液,并于冰上充分研磨及超声破碎,将匀浆液以12 000 r/min转速于4℃离心10 min,提取上清液并采用BCA 蛋白定量试剂盒测定蛋白浓度。加入适量5×蛋白上样缓冲液,于100℃高温处理使蛋白变性。蛋白样品经电泳分离后,以恒流转膜,封闭采用50 m L/L脱脂牛奶于常温下孵育1~2 h,之后置于适量的一抗溶液中(兔抗CD40、兔抗ZO-1、兔抗Occludin、兔 抗β-Tubulin),4℃孵 育 过 夜 后,进 行10 min×3次洗膜处理。二抗于室温孵育1~2 h后,再次进行洗膜处理。利用ECL发光液于化学发光仪进行曝光显像,拍摄后的图像使用Image J分析。
1.7 肠道通透性检测
小鼠过夜禁食后,用4 ku异硫氰酸荧光素-葡聚糖(FITC-dextran)溶液对小鼠进行灌胃处理。经过1.5 h后,小鼠眼眶取血,于激发波长为485 nm、发射波长为535 nm 条件下,检测荧光吸光度值。
1.8 肠道含水量测定
测定小鼠肠道组织含水量以评估小鼠肠道水肿的程度。取小鼠新鲜小肠组织,立即称重,此时记为组织湿重。随后将组织置于60℃烘干48 h后再次称重,此时为组织干重,计算含水量(%)=(组织湿重-组织干重)/组织湿重×100%。
1.9 肠道细菌计数
取小鼠肠系膜淋巴结组织、肺脏组织并分别将其匀浆处理,室温离心提取上清液。经过连续稀释后,将500μL稀释液均匀平铺在TSA 琼脂平板上,于37℃恒温孵育24 h后进行细菌含量计数。
1.10 统计学分析
统计分析使用Graphpad Prizm 软件完成。连续变量选用单因素方差分析(Turkey事后检验),计量资料采用均数±标准差表示。P<0.05为差异具有统计学意义。
2 结 果
2.1 糖尿病患者差异基因富集通路分析
通过提取GSE142153数据集中10例对照组和23例糖尿病患者外周血单核细胞基因进行分析,结果发现糖尿病患者共有109个基因上调,73个基因下调(图1)。差异基因富集在血小板活化、内皮细胞屏障功能等通路中,提示糖尿病患者存在血小板活化及内皮屏障损伤。

图1 糖尿病患者差异基因富集通路Fig.1 Differentially expressed genes enriched pathway of diabetic patients
2.2 西洛他唑抑制糖尿病小鼠体内血小板的活化
ELISA 结果显示,db/db小鼠血清中sCD40L表达量较对照m/m 小鼠明显升高(P<0.05),而给予西洛他唑处理后,db/db小鼠血清中sCD40L 表达水平下降(P<0.05,图2A)。除此之外,Western blotting结果显示,与m/m 溶剂组小鼠相比,db/db溶剂组小鼠肠道组织中CD40蛋白水平升高(P<0.05),db/db西洛他唑组小鼠肠道组织中CD40蛋白水平下降(P<0.05,图2B、图2C)。

图2 西洛他唑对血清sCD40L水平及肠道CD40蛋白表达的影响Fig.2 The effect of cilostazol on serum sCD40L and intestinal CD40 expression
2.3 西洛他唑改善小鼠肠道通透性、含水量及肠道菌群含量
通过给各组小鼠给予4 ku FITC-dextran 溶液灌胃处理以检测小鼠的肠道通透性,结果显示,db/db溶剂组小鼠血清FITC 的浓度显著高于m/m 溶剂组小鼠(P<0.05);西洛他唑干预后,db/db西洛他唑组小鼠血清FITC 的浓度明显降低(P<0.05,图3A)。与m/m 溶剂组相比,db/db溶剂组的肠道含水量明显升高,肠组织明显水肿(P<0.05);db/db西洛他唑组肠道含水量明显降低,肠组织水肿程度减轻(P<0.05,图3B)。通过小鼠肠道细菌平板计数,结果发现与m/m 溶剂组和m/m 西洛他唑组相比,db/db溶剂组肠系膜淋巴结及肺脏组织匀浆菌落数均明显升高,西洛他唑的干预显著降低了两个部位的菌落数(P<0.05,图3C、图3D)。
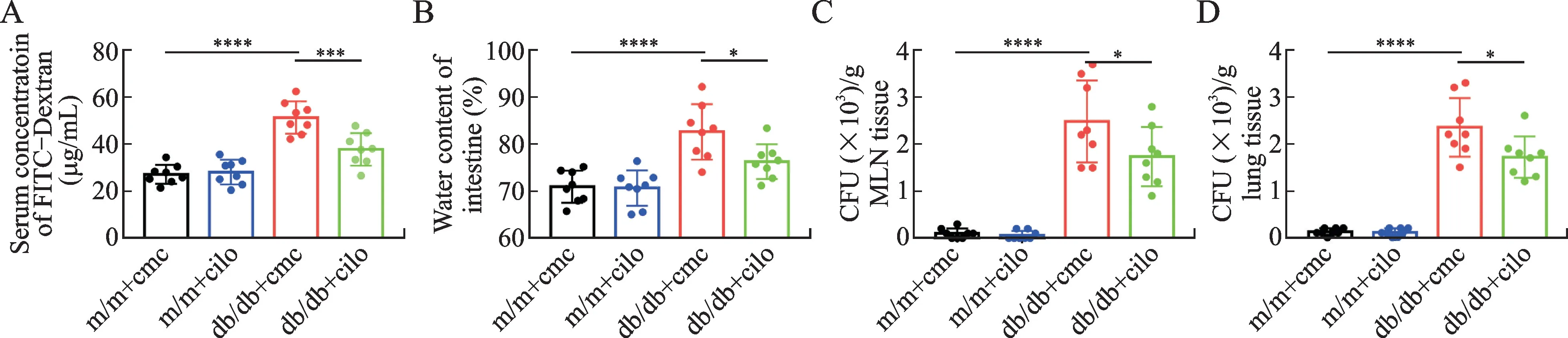
图3 肠道通透性、含水量及组织菌落计数的比较Fig.3 The effect of cilostazol on the permeability of intestine
2.4 小鼠肠道紧密连接蛋白ZO-1和Occludin的表达水平
Western blotting结果显示,糖尿病db/db溶剂组小鼠肠道组织中紧密连接蛋白ZO-1和Occludin的表达水平明显低于对照m/m 溶剂组小鼠(P<0.05);与db/db溶剂组小鼠相比,db/db西洛他唑组小鼠肠道紧密连接蛋白ZO-1和Occludin的表达水平升高,差异具有统计学意义(P<0.05,图4)。
3 讨 论
肠道屏障是机体隔绝内环境与肠道毒素的关键结构。T2DM 患者往往伴随肠道屏障损伤,一旦出现外界刺激,将大大增加其炎症感染和罹患脓毒症风险。遗憾的是,T2DM 肠道屏障损伤机制仍未阐明。研究表明,抑制血小板活化可以改善小鼠肠黏膜屏障损害[7],而糖尿病导致的慢性高血糖在内的代谢异常可能导致体内血小板活化,严格控制代谢功能等方法可减少体内血小板的活化[12]。本研究通过对糖尿病与非糖尿病患者的外周血单核细胞转录组数据进行分析发现,其差异基因在血小板活化和上皮屏障相关通路富集,进而证实抗血小板药物西洛他唑可抑制血小板活化,下调CD40-CD40L 信号通路、改善肠道通透性和含水量,提高肠道紧密连接蛋白表达,为改善糖尿病肠道屏障功能提供了新策略和新靶点。
本研究借助GSE142153数据集中10例对照组和23例糖尿病患者外周血单核细胞基因进行分析,发现差异基因富集在血小板活化、内皮细胞屏障功能等通路中,在一定程度上可以反映糖尿病患者体内基因的表达变化趋势。由于人与小鼠基因具有高度同源性,我们推测模式动物体内具有相似变化。然而,使用外周血基因变化推测肠道变化存在组织间差异,因此,本研究通过后续血液及肠道组织相关实验予以证明,完善了相应证据。当然,基于本研究结果,针对二代测序组织特异性不足这一缺陷,我们将在后期展开针对肠道的组学分析,进一步探索糖尿病肠道屏障功能损伤的下游分子机制。
血小板是屏障功能的重要调控者,在维持血脑屏障、血气屏障和血肠屏障等功能中具有关键作用[13]。同时,血小板因其包含数百种可分泌蛋白,在静息和活化状态对屏障功能的调控展现出双向作用,即静息态血小板往往维持屏障功能稳定,而活化态血小板却表现出损伤屏障功能的倾向[14]。糖尿病及相关并发症患者体内sCD40L 水平异常升高,并且T2DM 与sCD40L 水平升高在冠状动脉粥样硬化性心脏病患者中呈现独立相关[15-16]。活化的血小板是sCD40L的主要来源,而CD40-CD40L 信号通路参与糖尿病在内的多种炎症性疾病的病理生理过程[17]。研究表明,西洛他唑可降低T2DM 患者体内的C 反应蛋白和sCD40L的水平,从而延缓其动脉粥样硬化和慢性炎症的进展[18]。我们的研究结果显示,糖尿病小鼠血清中sCD40L明显升高,肠道组织CD40的表达量显著增加,而西洛他唑干预可明显改善血清sCD40L和肠道组织CD40的表达水平。
既往研究发现,西洛他唑可以通过抑制血小板与其他免疫细胞的相互作用来改善小鼠肠道炎症及损伤[19-20]。为进一步证实西洛他唑是否可改善T2DM小鼠肠道屏障功能,本研究针对T2DM 小鼠肠道屏障功能研究发现,糖尿病小鼠肠道黏膜屏障明显受到破坏,表现为肠道通透性、含水量、组织匀浆菌落数明显增加,肠道紧密连接蛋白ZO-1、Occludin 表达水平下降,而西洛他唑治疗明显缓解了糖尿病小鼠肠道黏膜屏障的损伤,提示其对改善糖尿病小鼠屏障功能的有效性。当然,该实验结果仅仅为西洛他唑改善T2DM 屏障功能提供了实验室证据和理论依据,其具体作用仍待临床多中心大样本研究证实。
综上,本研究表明西洛他唑可能通过抑制血小板活化,减少血清及肠道组织中sCD40L 和CD40的表达,进而改善糖尿病小鼠肠道黏膜屏障的破坏。本研究为西洛他唑对T2DM 及其相关并发症的影响及其潜在作用机制提供了科学依据。
