短期自愿运动对高脂血症小鼠脑出血后内源性神经干细胞的影响
2023-05-29胡晓宣王童卓孙美琪张子宣黄鹏瑜罗宇佳吕海侠
胡晓宣,刘 倩,王童卓,孙美琪,张子宣,黄鹏瑜,罗宇佳,王 飔, 吕海侠
(1.西安交通大学基础医学院神经生物学系;2.西安交通大学基础医学院人体解剖与组织胚胎学系;3.西安交通大学第一附属医院,陕西西安 710061)
脑出血(intracerebral hemorrhage,ICH),俗称出血性脑卒中,是一种非外伤性脑组织内血管破裂引起的损伤性疾病,占全部脑卒中的20%~30%,有较高的死亡率和致残率[1-2]。近年来,肥胖和高脂血症已经成为全球健康问题关注的重点,被认为是心脑血管意外、代谢综合征及其他慢性疾病的主要危险因素[3-4]。临床观察发现,伴有高脂血症或肥胖的中年患者是ICH 高发人群,结局严重,预后差;其脑内出血灶面积大且血肿消除缓慢,神经功能障碍严重且恢复时间延长[5-7]。因此,开发有效的治疗手段以改善高脂血症或肥胖人群ICH 后的结局、加速神经功能康复,成为亟待解决的问题。
有研究证实,啮齿类动物ICH 后侧脑室室管膜下区(subventricular zone,SVZ)的内源性神经干细胞(endogenous neural stem cells,eNSCs)被激活[8-12]。然而,eNSCs的有限激活不足以完成神经损伤修复的任务,因此,临床工作中仍需要不断探索新的基于NSCs的治疗策略[13]。近年来,通过康复运动改善脑损伤症状促进神经修复受到关注。动物实验研究证实,运动促进海马齿状回颗粒细胞下区NSCs增殖和分化,刺激海马神经发生[14]。另外,运动可以减少ICH 引起的神经元死亡[15];长期自愿运动可增强神经祖细胞的存活、增殖和向损伤灶迁移[16]。有关ICH 后运动干预的策略,目前观点不一。有研究提示,自愿运动对小鼠SVZ 中NSCs的增殖和神经发生没有影响[17]。许多研究表明,运动可增加肥胖小鼠脑源性神经营养因子的表达,增强海马神经元的突触可塑性,提高学习与记忆能力[18-19],也可改善高脂血症或肥胖导致的神经发生减弱[20]。那么,高脂血症或肥胖人群ICH 后能否通过合理的康复运动训练进一步促进eNSCs的激活,加速神经功能修复,还有待探索。
本研究基于前期的工作观察,首先构建高脂血症小鼠ICH 模型,然后在损伤急性期开始短时间自愿运动训练,通过对比小鼠运动和平衡能力改善,评价短期自愿运动对神经功能康复的影响,通过观察SVZ的eNSCs激活情况,阐明其可能的机制,以期为开发针对高脂血症人群ICH 的临床治疗策略提供实验依据。
1 材料与方法
1.1 材料与试剂
Nestin-CreERT2:tdTomato转基因C57BL/6小鼠(南京大学模式动物有限公司),血糖检测仪(莱弗仕康医疗器械有限公司),高脂饲料(research diet D12492,4.30 kcal/g,60%脂肪,20%碳水化合物,20%蛋白质),三酰甘油(triglyceride,TG)、血清总胆固醇(total cholesterol,TC)、血清低密度脂蛋白胆固醇(low-density lipoprotein cholesterol,LDL-C)、血清高密度脂蛋白胆固醇(high-density lipoprotein cholesterol,HDL-C)购自南京建成生物工程有限公司,尼罗红(Nile Red,Sigma公司),他莫昔芬(Sigma公司),H&E染色试剂盒(西安赫特生物科技有限公司),一抗包括兔抗Ki67(1∶300)和兔抗-DCX(1∶400)购自Abcam 公司,二抗绿色荧光标记驴抗兔IgG(1∶500)购自Invitrogen公司。
1.2 高脂血症小鼠脑出血模型的构建
实验选用4月龄Nestin-Cre雄性小鼠14只,给予8周高脂饮食。遵循西安交通大学医学部实验动物管理委员会相关规定(批准号:XJTU 2021-1265),所有小鼠饲养于12 h/12 h明暗循环的SPF级动物房,自由摄食及饮水。通过称量体质量,测定血糖、血清TG、TC、LDL-C、HDL-C及肝脏组Nile Red染色,验证小鼠高脂血症模型构建成功。以纹状体注射胶原酶的方法制备ICH 模型。经腹腔注射0.75%戊巴比妥钠(0.01 mL/g)后,小鼠俯卧位固定于立体定位仪台上;术区备皮及消毒,沿矢状线剪开头皮,充分暴露颅骨。在纹状体注射0.03 U Ⅳ型胶原酶(以前囟为原点,右旁开2.4 mm,前0.4 mm,深度3.4 mm),注药时长5 min,注药后留针5 min,退针时长2 min。缝合头皮并消毒,红霉素软膏涂抹预防感染。造模前3 d,连续腹腔注射他莫昔芬(0.05 mg/g)诱导Nestin表达;造模后小鼠置37℃的电热毯上保暖,完全苏醒后放回鼠笼。
1.3 动物分组与自愿运动干预
实验动物共14 只,随机分为5 组:空白对照组(Blank)2 只,假 手 术 组(Sham)3 只,ICH 组3 只,Sham+运动(Ex)组3只及ICH+Ex组3只。Blank组不进行任何处理,Sham 组小鼠仅开颅进针;以转轮(直径12.7 cm)作为自愿运动训练。ICH 前2 d,运动组小鼠进行适应性练习,其余小鼠在标准笼内自由活动。ICH 后2 d,运动组小鼠开始运动且持续7 d,以Statistical Analysis System 软件记录小鼠每日运动圈数和7 d运动总圈数。
1.4 神经功能评估
所有小鼠在实验前进行预训练,以保证小鼠熟悉平衡木并能顺利通过。ICH 后2 d及运动干预第1、3、5、7天采用双盲法对小鼠神经功能进行评价,评价指标包括神经功能缺损评分(neurological severity score,NSS)和平衡木(beam walking)。NSS评分越高表示神经功能障碍越严重。平衡木实验记录小鼠肢体未从距离地面10 cm 的100 cm×1 cm 木条上滑脱/躯体未从木条跌落所运动的最远距离。实验重复3次,取平均值作为小鼠通过横梁的距离。
1.5 组织取材及染色
分别于ICH 后2 d及运动7 d留取肝脏组织及脑组织。小鼠经0.75%戊巴比妥钠腹腔注射麻醉,用4%多聚甲醛经心脏灌注固定,留取肝脏组织和脑组织进行冰冻切片(厚度为10μm)。按照常规方法,以1μmol/L 的Nile Red染液进行肝脏组织染色,37℃孵育30 min后光镜下观察脂滴数量。脑组织进行HE染色,观察脑出血损伤灶以及组织病理学改变;采用ki-67及DCX 免疫组织化学染色,观察SVZ的eNSCs激活情况。
1.6 数据采集及统计学分析
小鼠体质量、NSS评分、转轮运动量使用均数±标准差表示,血糖及血清脂质代谢相关因子浓度、免疫荧光细胞计数以均数±标准误表示。所有数据采用GraphPad Prism 8.0软件进行分析。免疫染色阳性细胞数量采用单因素方差分析(One-way ANOVA),体质量及NSS 评分采用双因素方差分析(Two-way ANOVA),其余数据采用非配对t检验(Unpairedttest)分析。P<0.05为差异有统计学意义。
2 结 果
2.1 高脂饮食诱导Nestin-Cre 雄性小鼠出现高脂血症
实验开始前各组小鼠体质量(表1)无统计学差异,喂养8周后(6月龄),HFD组小鼠体质量增加更明显(P<0.000 1),伴随血糖水平明显升高(图1A,P=0.004 3)。肝脏组织Nile Red染色结果显示,HFD组小鼠肝脏组织脂滴形成数量明显增加(图1B,P<0.001),血清TG(P=0.027 9)、TC(P<0.001)、HDL-C(P<0.001)和LDL-C(P<0.001)浓度明显增加(图1C),提示小鼠出现高脂血症。
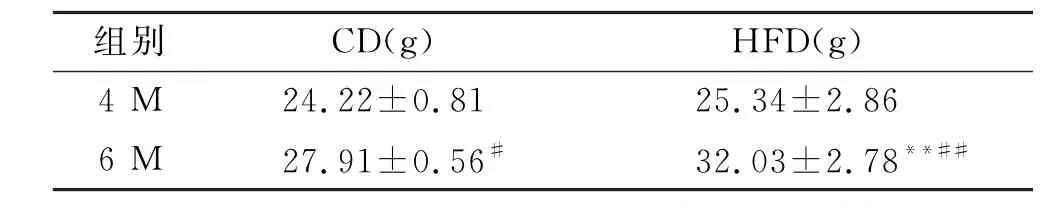
表1 高脂饮食喂养8周后小鼠体质量的变化Tab.1 Changes in body weight of mice after 8-week HFD
2.2 短期自愿运动改善高脂血症小鼠ICH后神经功能
ICH 组小鼠纹状体部位出现明显损伤灶(图2A)。NSS结果显示(表2),Blank与Sham 组无统计学差异(P>0.05),ICH 组小鼠评分明显增高(P<0.01),提示小鼠运动功能障碍。Beam walking结果显示(表2),Blank 与Sham 组无统计学差异(P>0.05),ICH 组小鼠通过距离明显缩短(P<0.001),提示小鼠平衡能力下降。

图2 短期自愿运动改善ICH 小鼠神经功能Fig.2 Short-term voluntary exercise improved ICH-induced neurological dysfunction

表2 ICH 后高脂血症小鼠出现神经运动功能障碍Tab.2 ICH induced neurological dysfunction in mice with hyperlipidemia
Sham+Ex和ICH+Ex组小鼠每日运动圈数和7 d运动总距离无统计学差异(图2A、图2B),提示两组小鼠运动意愿和运动能力具有可比性。随运动天数增加,ICH+Ex组小鼠NSS逐渐降低,通过平衡木距离逐渐增加;7 d后与ICH 组有明显差异,接近对照组(Sham 及Sham+Ex)水平(图2C、图2D,P>0.05)。提示短期自愿运动明显改善高脂血症小鼠ICH 后神经功能。
2.3 短期自愿运动促进高脂血症小鼠ICH后eNSCs激活
分别对各组小鼠SVZ 的Nestin+细胞(红色)、Nestin+/Ki67+及Nestin+/DCX+细胞进行计数,以观察eNSCs 激活。结果显示,ICH 组小鼠SVZ 的Nestin+/Ki67+细胞数量明显低于Sham 组(P<0.05);运动组(Sham+Ex及ICH+Ex)小鼠SVZ的Nestin+细胞(P<0.05)及Nestin+/Ki67+(P<0.001)细胞数量明显高于Sham 和ICH 组(图3A),运动组之间无统计学差异。提示短期自愿运动明显增强高脂血症小鼠eNSCs增殖。
侧脑室前外侧角的DCX+细胞计数结果显示,ICH组Nestin+/DCX+细胞明显多于Sham 组(P<0.05);Sham+Ex(P<0.001)和ICH+Ex(P<0.01)组小鼠Nestin+/DCX+细胞数量明显高于Sham 组,与ICH组之间差异无统计学意义(图3B),运动组之间无统计学差异。提示ICH 及短期自愿运动均增强了高脂血症小鼠eNSCs向神经元方向分化,而7 d自愿运动对高脂血症小鼠ICH 后eNSCs向神经元分化的促进作用不明显。
3 讨 论
我国居民膳食调查的数据显示,居民营养失衡状态日益加剧[21-22]。长期高脂饮食诱发的高脂血症或肥胖,已成为危害健康的重要因素。临床数据及研究证实,脂质代谢紊乱不仅影响神经发育和脑认知功能,也容易诱发脑卒中[23-24]。伴有高脂血症的ICH患者症状重、恢复慢且预后差。根据文献报道的小鼠高脂血症模型构建方法,本研究给予Nestin-Cre雄性小鼠8周高脂饮食,成功建立了小鼠高脂血症,并伴有血糖水平明显升高及肝脏组织脂滴形成增多[25-26]。
研究证实,长期运动在改善脑卒中患者的心血管状态、提高认知功能、增强身体耐力与平衡及提升生活质量等方面发挥重要作用[27]。同时,运动能够显著改善高脂饮食诱导的高脂血症,对高脂血症引起的神经元损伤具有保护作用[28-29]。但是,短期运动对脑损伤后神经功能恢复的研究相对较少,有关运动训练策略也存在争议。本研究在高脂血症小鼠ICH 模型中,观察到明显的脑组织损伤及神经功能障碍;基于前期研究观察,选择在ICH 急性期开始1周自愿运动。结果显示,运动组小鼠神经功能明显改善,NSS评分降低,Beam walking距离增加,7 d后与对照组(Sham 及Sham+Ex)小鼠功能接近,没有统计学差异。与已有的关于非高脂血症小鼠ICH 的研究结果基本一致,即1周的运动训练可显著降低NSS评分,小鼠平衡能力恢复至对照组水平[30]。
基于NSCs的中枢神经损伤修复策略已经成为基础研究和临床治疗共同关注的焦点。前期研究证实,脑卒中后eNSCs一定程度被激活,参与损伤修复过程[8-12,31]。本研究证实高脂血症小鼠发生ICH后,处于增殖状态(Nestin/Ki67双阳性)的eNSCs数量显著减少,而其向神经元分化(DCX 阳性)数量显著增加,提示高脂血症小鼠ICH 后存在eNSCs的有限激活,但由于较多细胞被动员向神经元分化,导致eNSCs储备下降,参与神经修复的能力明显下降。经过7 d自愿运动,运动组小鼠无论是Nestin/Ki67双阳性细胞,还是Nestin/DCX 双阳性细胞,均显著高于Sham 组,提示自愿运动有效促进了高脂血症小鼠ICH 急性期eNSCs激活,有望通过产生更多的eNSCs及新生神经元的方式加速损伤修复。值得关注的是,ICH+Ex与ICH 组小鼠相比,Nestin/DCX双阳性细胞数量增加不明显,提示因运动训练而增加的eNSCs分化成为新生神经元可能需要更长时间。此结果也在一定程度上解释了临床观察到患有高脂血症的ICH 患者神经功能恢复慢的结果。
综合以上结果,本研究证实,ICH 急性期短时程自愿运动可改善高脂血症小鼠的神经功能障碍,促进eNSCs激活;但由于高脂血症本身对NSCs行为的影响,通过运动训练促进新生的eNSCs分化成神经元以加速神经功能康复可能需要更长时间。后续研究将通过延长运动天数进一步促进eNSCs向神经元方向分化,增强修复效果,通过观察运动后损伤局部环境及糖脂代谢改变,阐明自愿运动促进ICH 后神经功能康复的细胞与分子机制,为开发基于eNSCs的高脂血症人群ICH 临床治疗策略、加速其神经功能康复提供新的思路与理论依据。
