1个FGG基因新变异致遗传性异常纤维蛋白原血症家系的临床特征和遗传学分析
2023-05-29王晓欧王锦院舒旷怡游畅胡榕王锦乐林素珍李姗姗江明华
王晓欧,王锦院,舒旷怡,游畅,胡榕,王锦乐,林素珍,李姗姗,江明华
温州医科大学附属第二医院育英儿童医院 临床检验中心,浙江 温州 325027
纤维蛋白原(fibrinogen, Fg)在止血中起核心作用,它是血小板聚集的支持物,纤维蛋白转化的底物,纤维蛋白溶解和伤口愈合的支架[1]。遗传性异常纤维蛋白原血症(congenital dysfibrinogenemia, CD)是编码Fg的基因(FGA、FGB和FGG)缺陷引起的一种临床上可表现为自发性出血或血栓形成的罕见遗传性血液病[2-3],部分患者有肺动脉高压等症状。有研究[3]显示,CD患者中42%的人有出血现象,在外伤或合并其他相关凝血系统异常的患者中,出血情况尤为严重。因大多数无症状的CD患者被漏诊或未被报道,该病在人群中发病率尚无具体统计资料[4]。大约一半的CD病例中,偶然发现是最常见的诊断方式[5-7]。笔者对1个CD家系进行了临床特征和遗传学分析,现报告如下。
1 对象和方法
1.1 对象 先证者,男,20岁,因“机器碾压伤致右手2-4掌骨多发粉碎性开放性骨折伴活动受限3 h”入院进行手术治疗,术前凝血检查发现凝血酶时间(thrombin time, TT)(22.0 s)延长,Fg(0.91 g/L)活性下降。患者既往无自发出血史或血栓倾向史,无肝肾病史及临床药物过敏史。家系调查发现先证者母亲月经量多、时间长,轻伤后出血难止,其父亲和弟弟表现无殊,父母非近亲结婚,系谱图见图1。本研究通过温州医科大学附属第二医院伦理委员会审批(批准号LW2018-11),所有家系成员均签署知情同意书。
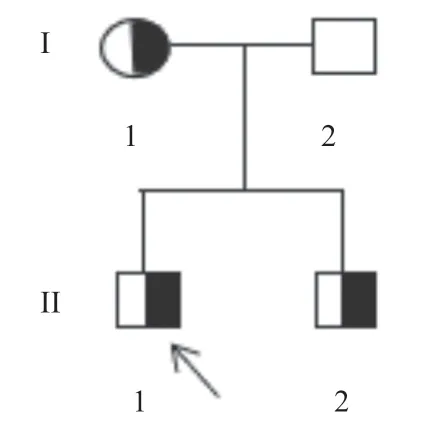
图1 CD家系图
1.2 方法
1.2.1 常规出凝血指标和生化功能检测:用枸橼酸钠抗凝管采集先证者及家系成员外周血各2.7 mL,供凝血指标及基因检测用;生化促凝管采集各2 mL,用于血清肝功能及肾功能检测。法国Stago STA-R全自动血凝仪检测Fg活性(Clauss法)、TT、部分活化凝血活酶时间(activated partial thromboplastin time, APTT)、血浆凝血酶原时间(prothrombin time, PT)、纤维蛋白(原)降解产物[fibrin(ogen) degradation products, FDPs]、D二聚体(D-dimer, D-D),采用配套试剂盒进行检测;德国Siemens ADVIA2400型生化分析仪检测Fg抗原(试剂盒购自上海太阳生物技术有限公司)和肝、肾功能。
1.2.2 Fg基因检测:用基因组DNA提取试剂盒(购自美国Axygen公司)对4个家系成员外周血进行基因组DNA的提取;引物由上海生工生物工程有限公司参照文献[8]进行设计合成,涵盖Fg 3个编码基因(FGA、FGB、FGG)所有外显子及侧翼序列,引物序列见表1。用DNA扩增试剂盒(购自大连宝生物工程有限公司)将待检标本在ECT-811 PCR扩增仪(购自广州合众生物科技股份有限公司)进行扩增。PCR产物送杭州擎科生物技术有限公司进行纯化、测序,将测序结果通过Mutation Surveyor软件与参考序列进行比对,发现基因变异位点后再次进行正、反向测序确认并家系验证。

表1 FGA、FGB和FGG三个基因的引物序列
1.2.3 生物信息学软件分析:用PolyPhen-2、Mutation Taster和PROVEAN 3个变异位点有害性预测软件评估变异位点对Fg功能的影响程度,当3种软件均预测同一遗传变异对Fg的功能影响较大时,认定该遗传变异具有高危害性。用PyMol软件建模分析变异前后Fg的分子三维结构,推测此变异对Fg功能的影响;用同源性分析软件Clustal X对Fg γ链氨基酸序列进行保守性比对;用I-Mutant Suite软件分析单点变异对Fg稳定性的影响。
1.2.4 血栓弹力图评估Fg功能:按照血栓弹力图凝血分析仪(美国血液技术公司, Hemostasis Analyzer TEG 5000)标准操作规程,模拟人体内凝血过程,检测家系成员相关参数,监测凝血和纤维蛋白溶解整个过程中血凝块的动态变化,反映全血的凝血和纤溶能力,其中凝块形成时间(K)和凝固角(Angle)主要反映Fg的功能和水平,综合凝血指数(CI)反映机体处于低凝或高凝状态。
2 结果
2.1 临床表型检测 在先证者Fg:C 显著降低(0.91 g/L)而Fg:Ag正常(3.20 g/L),Fg:C/Fg:Ag<0.7,TT(22.0 s)延长且不能被硫酸鱼精蛋白校正;PT、APTT、FDPs、D-D均在正常范围内,肝肾功能无异常,排除了抗凝系统和继发因素的影响。其母、弟弟与先证者检测结果相似,其父各项指标均未见异常,见表2。
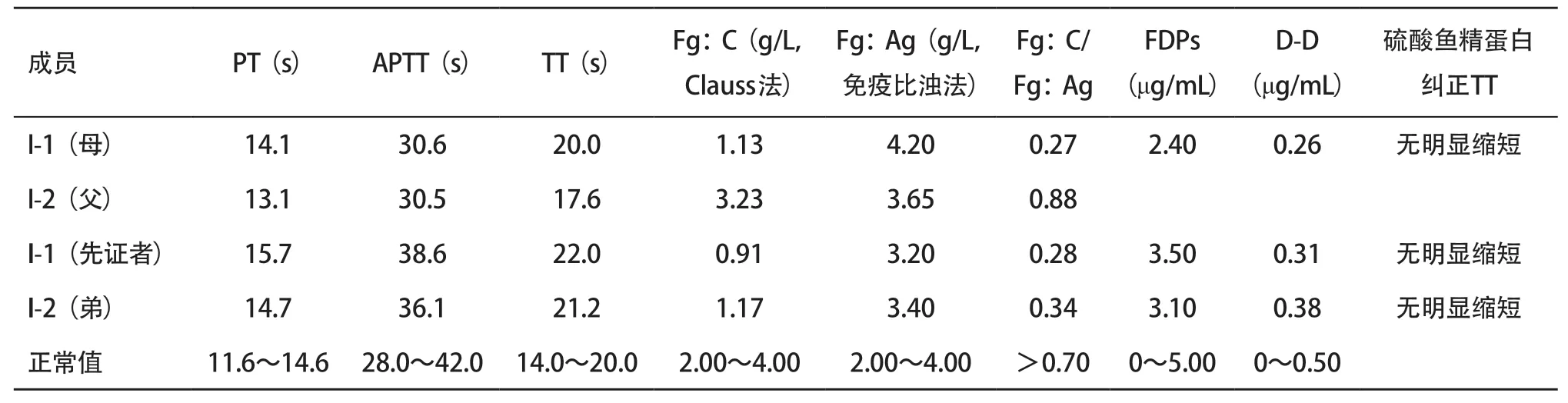
表2 家系各成员表型检测结果
2.2 Fg基因变异分析结果 先证者编码Fg γ链的FGG基因第9外显子c.1133G>A杂合变异,导致γ链p.Gly378Asp,见图2A;其母和弟弟携带相同变异,父亲则为野生型,见图2B,通过ExAC、千人基因组、gnomAD数据库检索,未发现正常人群携带该变异,排除此变异为多态性的可能。

图2 FGG 基因第9号外显子部分测序图
2.3 生信软件预测结果 3款预测软件均提示FGGc.1133G>A可能为有害致病的变异,PolyPhen-2评分结果为1.0分(可能有害的);Mutation Taster预测结果提示c.1133G>A变异致病,不仅使氨基酸序列发生变化,还有可能改变剪切位点;PROVEAN预测结果为-11.03分(有害的)。
2.4 变异蛋白模型分析FGG基因c.1133G>A变异,导致p.Gly378Asp,用PyMol软件建模分析发现,Gly378位于γ链D结构域,Gly378的主链与Ser404形成一个氢键;当Gly378变异为Asp378,侧链变长,且与Ser404的侧链增加了一个氢键,同时与Thr379增加了两个氢键,见图3。

图3 p.γ Gly378Asp变异模型图
2.5 同源比对保守性分析 用Clustal X软件对Fg γ链氨基酸序列进行同源保守性比对发现,γ链第378位氨基酸在不同物种间(人、小鼠、牛、蛙和七鳃鳗)为高度保守性序列,均为甘氨酸,见图4。

图4 Fg γ链同源序列比对
2.6 变异蛋白质稳定性预测 用I-Mutant Suite软件分析单点变异对蛋白质稳定性的影响,其DDG值为-0.99 kcal/mol,提示蛋白质稳定性下降(DDG值>0.5:增加蛋白质稳定性;DDG值<-0.5:降低蛋白质稳定性;-0.5≤DDG值≤0.5:中性),见图5A,其提供的PhD-SNP预测结果为致病性变异,见图5B。

图5 p.Gly378Asp稳定性预测图
2.7 血栓弹力图功能试验结果 先证者、其母亲和弟弟K值均延长,Angle值变小,提示三位c.1133G>A变异携带者Fg功能降低;先证者与其母亲CI值变小,提示血液可能处于低凝状态,先证者弟弟CI值接近正常水平,提示无凝血功能障碍表现;先证者父亲K值、Angle值和CI值均在正常范围内。见表3。
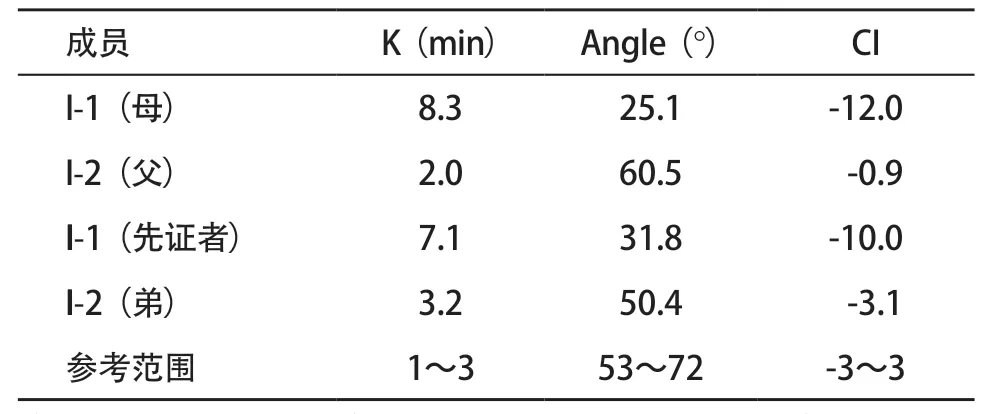
表3 家系各成员血栓弹力图检测结果
3 讨论
Fg是人体内含量最高的凝血因子,每个Fg分子由一个中央E区和两个外围D区组成,D区由Bβ链和γ链的羧基端构成[9]。γ链的D区羧基端有多个功能位点:如D-D的结合位点、形成E-D连接的“a”聚合位点和血小板结合位点等[10],所以当该羧基端的氨基酸发生改变时,可能影响到这些功能位点而导致Fg功能异常。
本文报道的1例CD家系先证者行右手骨折复位内固定、皮瓣转移修复术,术中无大出血,术后伤口愈合不良;先证者母亲月经量多、时间长,轻伤后出血难止;先证者弟弟无明显症状,三者的临床表现具异质性,但都符合CD的临床表现,与文献[3-4]报道一致。实验室检查中,先证者及其母亲、弟弟的Fg:C明显降低而Fg:Ag正常,Fg:C/Fg:Ag<0.7,TT延长且硫酸鱼精蛋白无法将其纠正,符合CD的实验室诊断标准。
基因分析证实先证者及其母亲、弟弟均携带FGG基因c.1133G>A变异,先证者的变异遗传自其母亲,父亲为野生型。本例突变p.Gly378Asp,由原来等电点为5.97 的中性氨基酸(Gly)变成了等电点为2.77酸性氨基酸(Asp),所带电荷及疏水性的改变使这个位点所处的高度保守的D区羧基端结构域发生变化。为了进一步研究p.Gly378Asp对Fg蛋白结构的影响,本研究进行了蛋白模型分析,发现Gly378位于Fg γ链D结构域,D结构域含多个功能位点,其中γ400-411附近的氨基酸残基是血小板膜糖蛋白IIb/IIIa的作用位点,当Gly378变异为Asp378,导致侧链变长,且与Ser404、Thr379增加了三个氢键,改变了空间作用力,影响了血小板膜糖蛋白IIb/IIIa与Fg的结合,阻碍了血小板的聚集,使凝块形成变慢。本研究还应用I-Mutant Suite软件分析p.Gly378Asp变异对蛋白质稳定性的改变,其DDG值为-0.99 kcal/mol,再次证实蛋白质稳定性存在下降。
血栓弹力图的三个参数K值、Angle值和CI值可以作为CD诊断的参考指标,K值和Angle值具有较高的特异性和敏感性,可以评估CD患者的整体止凝血状态,甚至预测出血或血栓形成的风险。本研究利用血栓弹力图试验发现,先证者及其母亲、弟弟的血凝块聚合的速率减低,提示三位家系成员Fg功能低下,先证者及其母亲CI值降低,提示两者处于低凝状态,可能有出血风险,需长期监测,避免出血风险;先证者弟弟CI值接近正常水平,提示无凝血功能障碍表现,这与其弟弟无症状的临床表型一致。通过血栓弹力图试验,验证了c.1133G>A导致Fg多功能位点的D结构域改变而使其功能下降的分子发病机制。
根据美国医学遗传学与基因组学学会(The American College of Medical Genetics and Genomics, ACMG)制定的临床变异解读标准和指南,对FGG基因c.1133G>A变异的致病性进行分析,检索千人基因组、gnomAD、ExAC数据库未见正常人携带该变异(PM2);变异在家系中共分离(PP1);经HGMD专业版数据库查询,FGG基因c.1133G>A变异(p.Gly378Asp)未见报道,γ链的Gly378在不同物种间同源序列比对具有高度的保守性(PP2),见图4;3个生信软件预测c.1133G>A变异均为有害的(PP3);先证者及家系成员的表型符合CD临床表型(PP4)。支持证据组合为:PM2+PP1+PP2+PP3+PP4,根据ACMG指南,判定c.1133G>A(p.Gly378Asp)变异为可能致病性变异。
此外,在先证者及其父亲和弟弟FGB基因第8号外显子存在c.1433G>A(p.Arg478Lys)杂合改变,BβArg478Lys是一个常见的多态性,位于Bβ分子的C-端,在分子水平上具有显著的表型效应。研究表明,它与冠状动脉疾病的严重程度有关,也与脑卒中的发育状况有关,携带这个多态性位点将可能增加血栓风险事件。
国外一项研究[11]表明,在CD诊断后平均随访8.8年中,CD患者有大出血(包括产后出血)的高风险,还有血栓事件的高风险。与血栓相关的Fg变异的患者尤其危险,在这种患者中,应考虑长期抗凝[12]。在某些特定的临床环境下,抗纤溶药物也是CD治疗的一部分[12]。
本研究报道了一例FGG基因新变异(c.1133G>A)致CD家系,拓宽了FGG基因突变谱;同时还发现该家系中3位成员存在BβArg478Lys多态性改变,故应长期观察先证者及其家系成员在不同状态下Fg功能的动态变化,有助于指导CD患者的治疗,也有助于为进一步阐明基因型和临床表现的关系提供依据。
