2023年普通高等学校招生全国统一考试(新课标卷)理科综合化学试题及考查目标分析
2023-05-28刘巧王润芝王杰
刘巧 王润芝 王杰

【试题部分】(以原试卷题号为序)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 F 19 Cl 35.5 Fe 56 Zn 65
一、选择题:本题共7小题,每小题6分,共42分,在每小题给出的四个选项中,只有一项是符合题目要求的。
7.化学在文物的研究和修复中有重要作用。下列说法错误的是( )
A.竹简的成分之一纤维素属于天然高分子
B.龟甲的成分之一羟基磷灰石属于无机物
C.古陶瓷修复所用的熟石膏,其成分為Ca(OH)2
D.古壁画颜料中所用的铁红,其成分为Fe2O3
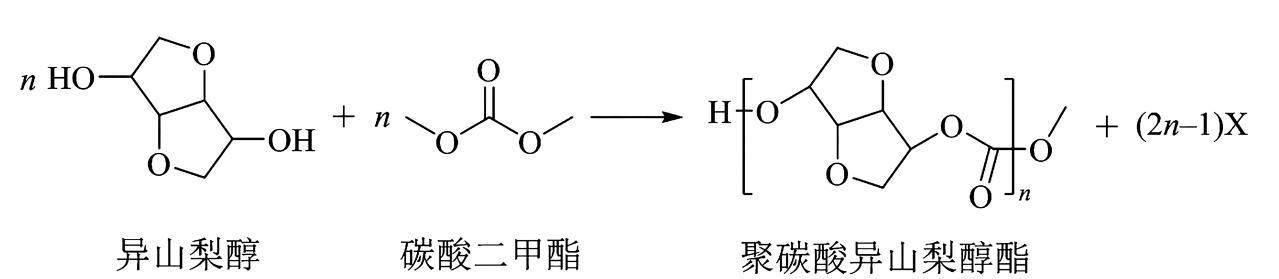
8.光学性能优良的高分子材料聚碳酸异山梨醇酯可由如下反应制备。
下列说法错误的是( )。
A.该高分子材料可降解
B.异山梨醇分子中有3个手性碳
C.反应式中化合物X为甲醇
D.该聚合反应为缩聚反应
9.一种可吸附甲醇的材料,其化学式为[C(NH2)3]4[B(OCH3)4]3Cl,部分晶体结构如图1所示,其中[C(NH2)3]+ 为平面结构。
下列说法正确的是( )。
A.该晶体中存在N—H…O 氢键
B.基态原子的第一电离能:C C.基态原子未成对电子数:B D.晶体中B、N 和O 原子轨道的杂化类型相同 10.一种以V2O5 和Zn 为电极、Zn(CF3SO3)2 水溶液为电解质的电池如图2所示。放电时,Zn2+ 可插入V2O5 层间形成ZnxV2O5·nH2O。下列说法错误的是( )。 A.放电时V2O5 为正极 B.放电时Zn2+ 由负极向正极迁移 C.充电总反应:xZn+V2O5+nH2O=ZnxV2O5·nH2O D.充电阳极反应:ZnxV2O5 ·nH2O-2xe- =V2O5+xZn2+ +nH2O 11.根据实验操作及现象,下列结论中正确的是( )。 12.“肼合成酶”以其中的Fe2+ 配合物为催化中心,可将NH2OH 与NH3 转化为肼(NH2NH2),其反应历程如下所示。 下列说法错误的是( )。 A.NH2OH、NH3 和H2O 均为极性分子 B.反应涉及N—H、N—O 键断裂和N—N 键生成 C.催化中心的Fe2+ 被氧化为Fe3+ ,后又被还原为Fe2+ D.NH2OH 替换为ND2OD,反应可得ND2ND2 13.向AgCl饱和溶液(有足量AgCl固体)中滴加氨水,发生反应 Ag+ +NH3 [Ag(NH3)]+ 和[Ag(NH3)]+ +NH3 [Ag(NH3)2]+ 。lg[c(M)/(mol·L-1)]与lg[c(NH3)/(mol·L-1)]的关系如图3所示(其中M 代表Ag+ 、Cl- 、[Ag(NH3)]+ 或[Ag(NH3)2]+ )。 下列说法错误的是( )。 A.曲线Ⅰ 可视为AgCl溶解度随NH3浓度变化曲线 B.AgCl的溶度积常数Ksp = c(Ag+ )·c(Cl- )=10-9.75 C.反 应 [Ag(NH3)]+ + NH3 =[Ag(NH3)2]+ 的平衡常数K 的值为103.81 D.c(NH3)=0.01 mol·L-1 时,溶液中c([Ag(NH3)2]+ )>c([Ag(NH3 )]+ )>c(Ag+ ) 二、非选择题:共58分。 27.(14分)铬和钒具有广泛用途。铬钒渣中铬和钒以低价态含氧酸盐形式存在,主要杂质为铁、铝、硅、磷等的化合物。从铬钒渣中分离提取铬和钒的一种流程如下所示。 已知:最高价铬酸根在酸性介质中以Cr2O27- 存在,在碱性介质中以CrO24- 存在。 回答下列问题: (1)煅烧过程中,钒和铬被氧化为相应的最高价含氧酸盐,其中含铬化合物主要为_____(填化学式)。 (2)水浸渣中主要有SiO2 和_____。 (3)“沉淀”步骤调pH 到弱碱性,主要除去的杂质是_____。 (4)“除硅磷”步骤中,使硅、磷分别以MgSiO3 和MgNH4PO4 的形式沉淀。该步需要控制溶液的pH≈9以达到最好的除杂效果。若pH<9时,会导致_____;pH>9时,会导致_____。 (5)“分离钒”步骤中,将溶液pH 调到1.8左右得到V2O5 沉淀。V2O5 在pH <1时,溶解为VO+ 2 或VO3+ ;在碱性条件下,溶解为VO3- 或VO34-。上述性质说明V2O5 具有_____(填标号) A.酸性 B.碱性 C.两性 (6)“还原”步骤中加入焦亚硫酸钠(Na2S2O5)溶液,反应的离子方程式为_____。 28.(14分)实验室由安息香制备二苯乙二酮的反应式如下: 相关信息如表1所示: 装置如图4 所示。实验步骤为: ① 在圆底烧瓶中加入10 mL 冰乙酸、5 mL 水及9.0 g FeCl3 ·6H2O,边搅拌边加热,至固体全部溶解。 ②停止加热,待沸腾平息后加入2.0 g安息香,加热回流45~60 min。 ③加入50 mL 水,煮沸后冷却,有黄色固体析出。 ④过滤,并用冷水洗涤固体3 次,得到粗品。 ⑤ 粗品用75%的乙醇重结晶,干燥后得淡黄色结晶1.6 g。 回答下列问题: (1)仪器A 中应加入_____(填“水”或“油”)作为热传导介质。 (2)仪器B 的名称是_____;冷却水应从_____(填“a”或“b”)口通入。 (3)实验步骤②中,安息香必须待沸腾平息后方可加入,其主要目的是_____。 (4)在本实验中,FeCl3 为氧化剂且过量,其还原产物为;某同学尝试改进本实验:采用催化量的FeCl3 并通入空气制备二苯乙二酮。该方案是否可行? 簡述判断理由: _____。 (5)本实验步骤①~③在乙酸体系中进行,乙酸除作溶剂外,另一主要作用是防止_____。 (6)若粗品中混有少量未氧化的安息香,可用少量_____洗涤的方法除去(填标号)。若要得到更高纯度的产品,可用重结晶的方法进一步提纯。 a.热水 b.乙酸 c.冷水 d.乙醇 (7)本实验的产率最接近于_____(填标号)。 a.85% b.80% c.75% d.70% 29.(15分)氨是最重要的化学品之一,我国目前氨的生产能力位居世界首位。回答下列问题: (2)研究表明,合成氨反应在Fe催化剂上可能通过图6机理进行(*表示催化剂表面吸附位,N*2 表示被吸附于催化剂表面的N2)。判断上述反应机理中,速率控制步骤(即速率最慢步骤)为_____(填步骤前的标号),理由是_____。 (3)合成氨催化剂前驱体(主要成分为Fe3O4)使用前经N2 还原,生成α-Fe包裹的Fe3O4。已知 α-Fe属于立方晶系,晶胞参数a=287 pm,密度为7.8 g·cm-3,则α-Fe晶胞中含有Fe的原子数为_____(列出计算式,阿伏加德罗常数的值为NA)。 (4)在不同压强下,以两种不同组成进料,反应达平衡时氨的摩尔分数与温度的计算结果如下图所示。其中一种进料组成为xH2 =0.75,xN2 =0.25,另一种为xH2 =0.675,xN2 =0.225,xAr=0.10。(物质i的摩尔分数:xi=ni/n总) ①图中压强由小到大的顺序为_____,判断的依据是_____。 ②进料组成中含有情性气体Ar的图是_____。 ③图7中,当p2=20 MPa,xNH3 =0.20时,氮气的转化率α=_____。该温度时,反应1/2N2(g)+3/2H2(g)=NH3(g)的平衡常数Kp =_____MPa-1(化为最简式)。 30.(15分)莫西赛利(化合物K)是一种治疗脑血管疾病的药物,可改善脑梗塞或脑出血后遗症等症状。以下为其合成路线之一。 回答下列问题: (1)A 的化学名称是_____。 (2)C 中碳原子的轨道杂化类型有_____种。 (3)D中官能团的名称为_____、_____。 (4)E 与F 反应生成G 的反应类型为_____。 (5)F的结构简式为_____。 (6)I转变为J的化学方程式为_____。 (7)在B的同分异构体中,同时满足下列条件的共有_____种(不考虑立体异构)。 ①含有手性碳;②含有三个甲基;③含有苯环。 其中,核磁共振氢谱显示为6组峰,且峰面积比为3∶3∶3∶2∶2∶1的同分异构体的结构简式为_____。 【试卷整体评价】 1.弘扬学科核心价值,落实立德树人根本任务。 第7题选取中国古代文物作为素材,主要考查文物及其修复材料中的成分及物质类别,展示中国传统文化的同时,厚植爱国主义情怀。 试 题立足学科特点,选取我国科学家的创新科研成果,在考查化学相关知识的同时,激发考生的爱国主义情怀。例如第9题介绍了一种新型的可吸附甲醇的材料的晶体结构,第10题以南开大学程方益老师课题组发表在ACS Energy Letters 期刊上的一篇水系Zn-V2O5 可充电电池为情境,第12题以新颖前沿的生物酶—“肼合成酶”催化反应为背景,分别展现了我国科研工作者在物质结构、新型可充电电池以及催化反应机理领域方面的优异成果,弘扬了爱国主义情怀。 这些试题不仅凸显了化学的学科价值,又引导考生运用化学知识去观察和感受身边的事物,激发考生对化学学科的热爱的同时,落实了高考评价体系中的创新性考查要求。 2.深化基础性考查,回归教材。 试题围绕高中化学基础知识,深入考查考生对物质组成的判断(第7题)、缩聚反应原理(第8题)、化学反应原理基础(第13题)等主要内容的掌握程度。 实验是化学学科的一种重要的研究手段,第11题围绕“硝酸的氧化性”“SO24- 的检验”“金属性的强弱判断”“溴水遇苯褪色”等教材中涉及的重要实验内容,考查考生利用化学反应基本原理分析实验现象,得出实验结论的能力。第13题以向饱和AgCl溶液中滴加氨水的反应为背景,呈现了多个因变量随一个自变量变化的图像,考查考生识图和运用实验数据的能力。 试题在突出对化学基本概念、基本反应原理、基本实验技能等内容考查的同时,强化对基础知识深入理解上的综合运用。 3.考查学科关键能力,促进考生全面发展。 试 题第27题呈现工业上从铬钒渣中分离提取铬和钒的多步转化过程,涉及溶液酸碱性对物质组分及物质分离的影响、化学(离子)反应方程式的书写、物质的转化等知识,考查考生信息获取和加工以及逻辑思维等能力。第28题着重考查考生对实验基本操作的理解及计算能力。 第29题以高中重要课程中的哈伯法合成氨反应原理为情境,试题紧密联系工业生产实际,要求考生综合运用盖斯定律、化学反应机理、晶体结构、影响平衡的因素及平衡常数等相关知识进行解题,凸显出试题鲜明的综合性特征,促进考生整体知识框架的构建。 总的来说,试题整体贯彻落实立德树人根本任务,充分遵循教育教学规律,并充分考虑高中生的认知特点,突出对化学学科基础知识、关键能力的考查,促进考生形成化学观并提升化学学科素养。 【参考答案与解析】 7.C 考查目标及解析: 本题以历史文物为情境,考查生活中常见物质的组成、性质及用途。 选项A 正确,纤维素属于多糖,是一种天然高分子化合物,其分子式为(C6H10O5)n ,相对分子质量较高。 选项B正确,羟基磷灰石又称羟磷灰石、碱式磷酸钙,其化学式为[Ca10(PO4)6(OH)2],属于无机物。 选项C 错误,熟石膏的主要成分为2CaSO4·H2O,Ca(OH)2 为熟石灰的主要成分。 选项D正确,Fe2O3 呈红色,常被用于油漆、涂料、油墨和橡胶的红色颜料,俗称铁红。 8.B 考查目标及解析: 本题以高分子材料聚碳酸异山梨醇酯为情境,考查有机分子的结构、性质以及缩聚反应。 选 项A 正确,该高分子材料结构中含有酯基,可以降解。 选项C正确,根据聚碳酸异山梨醇酯的结构可以看出,反应物异山梨醇提供的羟基氢与碳酸二甲酯提供的甲氧基结合生成甲醇,故反应式中X为甲醇。 选项D正确,该反应在生产高聚物的同时还有小分子的物质生成,故属于缩聚反应。 9.A 考查目标及解析: 本题通过介绍一种可吸附甲醇的材料,考查晶体结构、氢键、电离能及杂化类型等相关知识。 选项A 正确,由晶体结构图可知,[C(NH2)3]+ 中的—NH2 的N—H 与[B(OCH3)4]- 中的O 原子存在N—H…O氢键。 选项B错误,同一周期元素原子的第一电离能从左至右逐渐递增,但是处于第ⅤA族的N 原子的p轨道处于半充满状态,结构比较稳定,故其第一电离能高于同周期的相邻元素的原子,因此,基态原子的第一电离能从小到大的顺序为C 选项C 错误,B、C、O、N 原子的未成对电子数分别为1、2、2、3,因此,基态原子未成对电子数B 选项D错误,[C(NH2)3]+ 为平面结构,则其中的C 和N 原子轨道杂化类型均为sp2;[B(OCH3)4]- 中B 原子形成了4 个σ键,B原子没有孤电子对,则B的原子轨道杂化类型为sp3;[B(OCH3)4]- 中O 原子分别与B和C原子形成2个σ键,并且O 原子还有2个孤电子对,则 O 的原子轨道杂化类型为sp3。综上所述,晶体中B、N 和О 原子轨道的杂化类型不相同。 10.C 考查目标及解析: 本题以南开大学程方益老师课题组发表在ACS Energy Letters 期刊上的一篇水系Zn-V2O5 可充电电池为情境,考查可充电电池的工作原理,涉及正负极判断、离子移动方向、电极反应式及电池反应等知识点。 根据题干信息分析,放电时,Zn2+ 可插入V2O5 层间形成ZnxV2O5·nH2O,导致V 元素的化合价降低,因此Zn电极发生了氧化反应,V2O5 电极发生了还原反应,因此,Zn为电池的负极,电极反应式为xZn-2xe- =xZn2+ ,此时,生成的Zn2+ 带正电,由负极向正极移动,V2O5 为电池的正极,电极反应式为V2O5 + 2xe- + xZn2+ + nH2O =ZnxV2O5·nH2O,总反应式为xZn+V2O5+nH2O =ZnxV2O5 ·nH2O。充电时,Zn电极为阴极,V2O5 电极为阳极,阴极反应式为xZn2+ +2xe- =xZn,阳极反应式为ZnxV2O5·nH2O-2xe- =V2O5 +xZn2++nH2O,总反应式为ZnxV2O5 ·nH2O =xZn+V2O5+nH2O。 根据以上分析,C选项说法错误,A、B、D选项说法正确。 11.C 考查目标及解析: 本题以探究实验为情境素材,以实验操作及现象、结论为主题,考查考生运用化学知识解决问题的能力,体现科学探究学科素养。 选项A 错误,常温下,铁片遇到浓硝酸会发生钝化反应,现象不明显,但稀硝酸与铁不会发生钝化,会产生气泡,所以不能通过该实验现象比较浓硝酸和稀硝酸的氧化性强弱。 选 项 B 错误,浓硝酸会氧化 SO23- 成SO24-,仍然会产生白色沉淀,所以不能通过该实验现象判断样品中含有SO24-。 选项C 正确,Cu比Ag活泼,在形成原电池过程中,Cu作负极,发生氧化反应,生成了Cu2+ ,导致溶液变为蓝色,Ag作正极,溶液中的Ag+ 在Ag电极上得电子生成银白色的金属Ag,所以该实验可以比较Cu和Ag的金属性强弱。 选项D错误,向溴水中加入苯,苯可将溴萃取到上层,使下层水层颜色变浅,因此,苯使溴水褪色是因为发生了物理变化,不是因为溴与苯发生了加成反应。 12.D 考查目标及解析: 本题以“肼合成酶”为情境,考查极性分子的判断以及反应历程等知识点。 选项A 正确,NH2OH、NH3、H2O 的正负电荷中心不重合,为极性分子。 选项B正确,通过分析反应历程可知,有N—H,N—O 键断裂,还有N—N 键的生成。 选项C正确,由反应历程可知,反应过程中,配合物中的Fe2+ 先失去一個电子被氧化成Fe3+ ,之后Fe3+ 又得到一个电子被还原成Fe2+ 。 选项D错误,由反应历程可知,反应过程中生成的NH2NH2 有两个H 原子来源于NH3,所以将NH2OH 替换为ND2OD,不可能得到ND2ND2,得到的产物应该为ND2NH2 和HDO。 13.A 本题以“肼合成酶”为情境,考查极性分 子的判断以及反应历程等知识点。 选项A 正确,NH2OH、NH3、H2O 的正 负电荷中心不重合,为极性分子。 选项B正确,通过分析反应历程可知,有 N—H,N—O 键断裂,还有N—N 键的生成。 选项C正确,由反应历程可知,反应过程 中,配合物中的Fe2+ 先失去一个电子被氧化 成Fe3+ ,之后Fe3+ 又得到一个电子被还原 成Fe2+ 。 选项D错误,由反应历程可知,反应过程 中生成的NH2NH2 有两个H 原子来源于 NH3,所以将NH2OH 替换为ND2OD,不可 能得到ND2ND2,得到的产物应该为 ND2NH2 和HDO。 13.A 考查目标及解析: 本题考查沉淀溶解平衡、平衡常数的求算等知识点。 根据题干信息分析,在AgCl饱和溶液中,Ag+ 和Cl- 的浓度相等,向该饱和溶液中滴加氨水,由于氨水中的NH3·H2O 与Ag+结合,导致溶液中Ag+ 浓度减小,Cl- 浓度增大,[Ag(NH3)]+ 浓度增大,继续滴加氨水,[Ag(NH3)]+ 增大的幅度小于[Ag(NH3)2]+ ,则曲线Ⅰ、Ⅱ、Ⅲ、Ⅳ 分别表示[Ag(NH3)2]+ 、[Ag(NH3)]+ 、Ag+ 、Cl- 的浓度随NH3 浓度变化的曲线。 选项A 错误,根据以上分析,氨水的滴加导致AgCl饱和溶液的沉淀溶解平衡正向移动,AgCl溶解度增大的同时,Cl- 濃度也增大,因此,曲线Ⅳ既表示Cl- 浓度随NH3 浓度变化的曲线,又表示AgCl溶解度随NH3浓度变化的曲线。 选项B 正确,由以上分析可知,曲线Ⅰ、Ⅱ、Ⅲ、Ⅳ 分别表示[Ag (NH3 )2 ]+ 、[Ag(NH3)]+ 、Ag+ 、Cl- 的浓度随NH3 浓度变化的曲线。当c(NH3)=0.1 mol·L-1时,由图可知,溶液中c(Ag+ )= 10-7.4,c(Cl- )=10-2.35,故AgCl 的溶度积常数Ksp=c(Ag+ )·c(Cl- )=10-9.75。 选项C 正确,由图可知,当c(NH3)=0.1 mol·L-1 时,溶液中c([Ag(NH3)]+ )=10-5.16,c ([Ag(NH3 )2 ]+ )=10-2.35,则[Ag(NH3)]++NH3 =[Ag(NH3)2]+的平衡常数K = c([Ag(NH3)2]+ )/c([Ag(NH3)]+ )·c(NH3)=103.81。 选项D正确,由以上分析可知,曲线Ⅰ、Ⅱ、Ⅲ、Ⅳ 分别表示[Ag (NH3 )2 ]+ 、[Ag(NH3)]+ 、Ag+ 、Cl- 的浓度随NH3 浓度变化的曲线。当c(NH3)=0.01 mol·L-1时,c([Ag(NH3)2]+ )>c([Ag(NH3)]+ )>c(Ag+ )。 27.本题以工业中从铬钒渣中提取铬和钒的工艺为情境素材,通过矿渣的煅烧、浸取、沉淀等步骤对反应过程、产物推断等设问,考查考生综合运用化学知识解决实际问题的能力。 【流程分析】 (1)Na2CrO4 本问考查考生信息理解能力及铬酸盐的性质。 根据题中的已知条件“在碱性介质中以CrO24- 存在”,故含铬化合物被氧化为最高价含氧酸盐应为Na2CrO4。 (2)Fe2O3 本问考查考生流程图的阅读能力及氧化铁的性质。 根据题干中“主要杂质为铁、铝、硅、磷等的化合物”,经过在空气中煅烧后,铁转变为其最稳定价态的氧化物,即Fe2O3。 (3)Al(OH) 本问考查考生流程图的阅读能力及铝元素化合物的相关性质。 沉淀步骤中将pH 由强碱性调至弱碱性时,可促进AlO- 2 水解形成Al(OH)3 沉淀。 (4)促使PO34- 发生水解导致PO34- 沉淀不完全 使Mg2+ 和NH+ 4 分别形成Mg(OH)2 和 NH3·H2O 而影响 SiO23- 和PO34- 的沉淀效果 本文考查考生运用盐类水解等相关知识推断实际工艺流程中调pH 可能遇到的问题。 若 pH<9,可能使PO34- 发生水解形成HPO24-、H2PO4-、H3PO4 而不能尽可能转化为MgNH4PO4 沉淀。 若pH>9,可能会使 Mg2+和 NH4+ 水解程度增大,形成Mg(OH)2 和NH3·H2O。 (5)C 本问考查考生信息理解能力。 由题中信息可知,V2O5 既能与酸又能与碱反应生成盐和水,故其应具有两性。 (6)2Cr2O27-+3S2O25-+10H+=6SO24-+4Cr3+ +5H2O本问考查氧化还原反应的判断及方程书写能力。 根据流程分析可知,S2O25- 被氧化后的产物为SO24-,Cr2O27- 被还原的产物从题中最后一次调pH 可知应为Cr3+ ,故还原步骤中发生反应的离子方程式应为2Cr2O27- +3S2O25-+10H+=6SO24-+4Cr3++5H2O。 28.本题以安息香制备二苯乙二酮为情境素材,基于实验试剂信息(熔沸点与溶解性等)和实验步骤,主要考查考生对实验基本操作的认知和理解、催化剂的催化原理及产品产率计算等知识点。 (1)油 本问考查考生对题干信息的分析能力。 由题干信息可知冰乙酸(沸点是118 ℃)是反应溶剂,且实验操作中反应液需要加热煮沸,故应选油作为加热介质。 (2)球形冷凝管 a 本问考查冷凝回流相关实验仪器名称及操作。 根据仪器的结构特征可知,B 为球形冷凝管;冷却水“下进上出”便于填满冷凝管,故应从a口进,b口出。 (3)防止暴沸 本问考查添加实验试剂时的注意事项。 步骤②中,若沸腾时加入安息香,可能会产生暴沸,进而使得安息香飞溅到圆底烧瓶上方导致反应产率降低,所以需要沸腾平息后加入。 (4)FeCl2 可行;空气中的氧气可以将还原产物FeCl2 又氧化为FeCl3,FeCl3 可循环参与反应 本问围绕Fe2+ 与Fe3+ 的相互转化考查氧化还原反应等相关知识。 根据题给信息,在溶液中FeCl3 为氧化剂,则反应过程中铁的化合价会降低,还原产物为FeCl2;若采用催化量的FeCl3 并通入空气制备二苯乙二酮,空气中的氧气可以将还原产物FeCl2 又氧化为FeCl3,FeCl3 可循环参与反应。 (5)FeCl3 水解 本问考查乙酸的性质及其在该实验中的主要作用。 加热条件下Fe3+ 更易水解,醋酸电离出H+ 可抑制其水解。 (6)a 本問基于物质的性质考查考生对晶体洗涤试剂的选择。 根据题干表格信息可知,安息香溶于热水,二苯乙二酮不溶于水,所以可以采用热水洗涤粗品除去未氧化的安息香。 (7)b 本问考查产品产率的计算。 根据以上信息可知,用热水洗涤粗产品并不影响产物二苯乙二酮的量,且安息香与二苯乙二酮相对质量近似相等,故2.0 g安息香理论上可得到二苯乙二酮约2.0 g,产率约为1.6 g/2.0 g×100%=80%。 29.本题以哈伯法合成氨反应原理为主体,考查盖斯定律、反应机理、晶体结构、影响平衡的因素及平衡常数的计算等相关知识点。 (1)-45 本问考查焓变的计算。 根据图5 数据,可列式计算ΔH =(+473+654-339-397-436)kJ·mol-1=-45 kJ·mol-1。 (2)(ⅱ) 第ⅱ步中N2 断裂氮氮三键所需要吸收的能量,比其他步骤中断裂的化学键所吸收的能量要高本问考查反应机理及速率控制的相关知识。 由 图5中信息可知,NN 的键能为946 kJ · mol-1,H—H 键的键能为436 kJ·mol-1。在化学反应中,最大的能垒为速率控制步骤,而断开化学键的步骤都属于能垒,由于 NN 的键能比 H—H 键的大很多,因此,在上述反应机理中,速率控制步骤为(ⅱ)。 (3)7.8×2873×10-30NA/56 本问考查立方晶胞结构中Fe原子个数的计算。 设α-Fe晶胞中含有的Fe原子数为x,由于其为立方晶系,则密度的计算式可列为ρ= M (Fe)×x/(a×10-10)3NA ,则x=ρ(a×10-10)3NA/M (Fe) ,代入数据可得7.8×2873×10-30NA56 。 (4)①p1 本问考查压强对反应平衡的影响 合成氨的反应中,压强越大越有利于氨的合成,因此,压强越大,平衡时氨的摩尔分数越大。由图中信息可知,在相同温度下,反应达平衡时氨的摩尔分数p1 ②图8 本问考查恒压时充入惰性气体对反应平衡的影响。 在恒压时充入惰性气体 Ar ,反应混合物中各组分的浓度减小,化学平衡向气体分子数增多的方向移动,故x(NH3)应较小,图8符合。 ③33.33% 根号下3/36 本问考查转化率、平衡常数的计算。 图7中,进料组成为xH2 =0.75,xN2 =0.25,两者物质的量之比为3∶1。假设进料中氢气和氮气的物质的量分别为3 mol和1 mol,达到平衡时氮气的变化量为 x mol,则有:
