物质结构与性质易错题归类剖析
2023-05-28周玮

作者简介:周玮,教育硕士,中学高级教师,江西师范大学硕士研究生校外实践导师。主持江西省基础教育课题一项,南昌市基础教育课题两项,在各级期刊发表教育教学论文十余篇。先后有多篇论文和微课视频获省市化学教学学会一等奖。近几年辅导的学生参加高中化学竞赛获省市一、二等奖若干名。
物质结构与性质的常见题型为选择题和综合题,考查考生对结构知识体系的归纳推理能力、信息迁移能力以及综合应用能力。物质结构与性质的知识点包括原子结构(核外电子排布、杂化方式、电负性等)、分子结构(化学键、电子式、结构式、官能团等)、晶体结构(晶体类型判断、物质熔沸点高低影响因素、晶体的密度等)。本文通过对“物质结构与性质”相关易错试题的分析,发掘知识体系中学生的易错知识点,希望可以引导考生克服对“物质结构与性质”的畏难心理,厘清试题中知识脉络的关系,实现“以错题回归知识本源”的目的,从而达成以易错点形成避错策略的知识掌握核心目标。
易错点1:原子结构与性质相关知识点
原子结构与性质在试题中常见的命题角度有:原子核外电子的排布规律及其表示方法, 原子结构与元素电离能和电负性的关系及其应用。试题侧重原子核外电子排布式或轨道表示式,未成对电子数判断,电负性、电离能、原子半径和元素金属性与非金属性比较的考查。在书写基态原子电子排布时,常见的易错点为违反能量最低原理、泡利原理、洪特规则及特例;还需注意同能级的轨道半充满、全充满或全空状态的原子结构稳定,如Cr:3d54s1、Mn:3d54s2、Cu:3d104s1、Zn:3d104s2;另外需理解电离能与金属性及金属元素价态的关系,电负性与非金属性及组成化合物所形成的化学键的关系。
易错提醒:书写电子排布式的常见错误与技巧。
原子结构中共有1s、2s、2p、3s、3p这5个能级上填充有电子,故D项正确。
答案:C
例2 下列各项叙述中,正确的是( )。
A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态轉化成激发态
B.价层电子排布式为6s26p3 的元素位于第六周期第ⅢA 族,是s区元素
C.所有原子任一能层的s电子云轮廓图都是球形,但球的半径大小不同
D.24Cr 原子的电子排布式是1s22s22p63s23p63d44s2
解析:镁原子由基态转化为激发态时吸收能量,A 项错误。价层电子排布式为6s26p3 的元素位于第六周期第ⅤA 族,是p区元素,B 项错误。所有原子任一能层的s电子云轮廓图都是球形,能层序数越大,球的半径就越大,C项正确。原子轨道处于全空、全满或半充满状态时,能量最低,故24Cr原子的核外电子排布式应是1s22s22p63s23p63d54s1,D项正确。
答案:C
易错点2:分子结构与性质
分子结构与性质在试题中的常见命题角度有:围绕某物质判断共价键的类型和数目,分子的极性、中心原子的杂化方式、微粒的立体构型,氢键的形成及对物质的性质影响等。试题侧重考查微粒构型、杂化方式、中心原子的价层电子对数、配位原子判断与配位数、化学键类型、分子间作用力与氢键、分子极性等。对σ键和π键的判断,要掌握好方法;对杂化轨道的判断,要理解常见物质的杂化方式;通过三种作用力对性质的影响解释相关现象及结论。注意以下三个误区:不要误认为分子的稳定性与分子间作用力和氢键有关,其实分子的稳定性与共价键的强弱有关;不要误认为组成相似的分子,中心原子的杂化类型相同,关键是要看其σ键和孤电子对数是否相同。如BCl3 中B 原子为sp2 杂化,NCl3 中N 原子为sp3 杂化;不要误认为只要含有氢键物质的熔、沸点就高,其实不一定,分子间的氢键会使物质的熔、沸点升高,而分子内氢键一般会使物质的熔、沸点降低。
易错提醒:判断分子中中心原子的杂化轨道类型的方法。
(1)根据VSEPR 模型、中心原子价层电子对数判断,如(ABm 型)中心原子的价层电子对数为4,中心原子的杂化轨道类型为sp3;价层电子对数为3,中心原子的杂化轨道类型为sp2;价层电子对数为2,中心原子的杂化轨道类型为sp。
(2)根据等电子体原理进行判断,如CO2是直线形分子,SCN- 、N- 3 与CO2 是等电子体,所以分子的空间结构均为直线形,结构式类似,中心原子均采用sp杂化。
(3)根据分子或离子中有无π键及π键数目判断,没有π键的为sp3 杂化,如CH4 中的C原子;含1个π键的为sp2 杂化,如甲醛中的C原子以及苯环中的C 原子;含2个π键的为sp杂化,如二氧化碳分子和乙炔分子中的碳原子。
规律方法:“四方法”判断中心原子的杂化类型。
(1)根据杂化轨道的空间结构判断。
①直线形?sp,② 平面三角形?sp2,③四面体形?sp3。
(2)根据杂化轨道间的夹角判断。
①109°28'?sp3,②120°?sp2,③180°?sp。
(3)利用价层电子对数确定三种杂化类型(适用于中心粒子)。
2对?sp杂化,3 对?sp2 杂化,4 对?sp3 杂化。
(4)根据σ键数与孤电子对数(适用于结构式已知的粒子)判断。
①含C有机化合物:2个σ?sp,3个σ?sp2,4个σ?sp3。
②含N化合物:2个σ?sp2,3个σ?sp3。
③含O(S)化合物:2个σ?sp3。
例3 (1)Cu2+ 处于[Cu(NH3)4]2+ 的中心,若将配离子[Cu(NH3)4]2+ 中的2 个NH3 换为CN- ,则有2种结构,则Cu2+ 是否为sp3 杂化?_____ (填“是”或“否”),理由为_____。
(2)用价层电子对互斥理论推断甲醛中H—C—H 的键角_____120 °(填“>”“<”或“=”)。
(3)SO2Cl2 和SO2F2 都属于AX4E0 型分子,SO 之间以双键结合,S—Cl、S—F之间以单键结合。请你预测SO2Cl2 和SO2F2 分子的立体构型为_____。SO2Cl2 分子中∠Cl—S—Cl_____SO2F2 分子中∠F—S—F(填“<”“>”或“=”)。
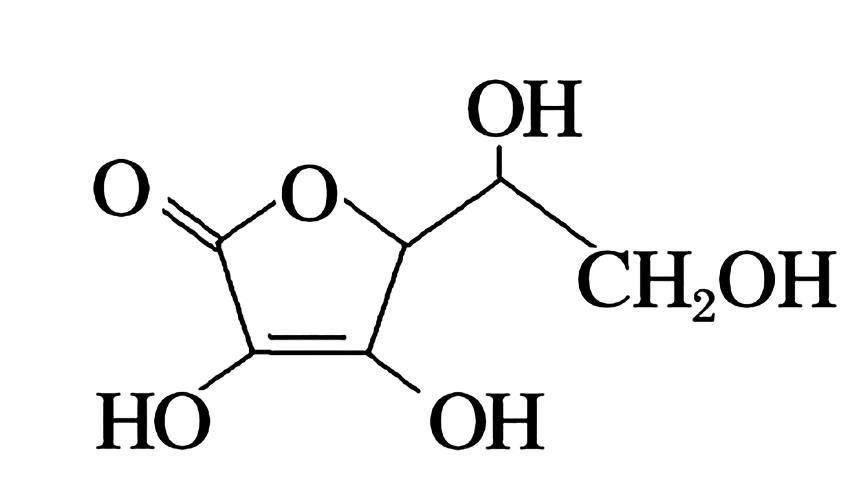
(4)抗坏血酸的分子结构如下所示,该分子中碳原子的杂化轨道类型为_____。
解析:(1)由于将配离子[Cu(NH3)4]2+中的2个NH3 换为CN- ,有2种结构,说明[Cu(NH3)4]2+ 形成平面正方形結构,Cu2+ 在平面正方形对角线的交点上。若是Cu2+ 采用sp3 杂化,由于正四面体任何两个顶点都处于相邻位置,那么[Cu(NH3)4]2+ 的空间构型为正四面体形,将配离子[Cu(NH3)4]2+ 中的2个NH3 换为CN- ,则只有1种结构,所以Cu2+ 不是采用sp3 杂化。
(2)甲醛分子中,碳氧之间为双键,根据价层电子对互斥理论可知双键与单键之间的斥力大于单键与单键之间的斥力,所以H—C—H 的键角小于120°。
(3)当中心原子的价层电子对数为4时,VSEPR模型为四面体形,硫原子无孤电子对,所以立体构型为四面体形。X 原子得电子能力越弱,A—X 形成的共用电子对之间的斥力越强,F 原子的得电子能力大于氯原子,所以SO2Cl2 分子中∠Cl—S—Cl>SO2F2分子中∠F—S—F。
(4)该分子中亚甲基、次亚甲基上C原子价层电子对个数都是4,连接碳碳双键和碳氧双键的C 原子价层电子对个数是3,根据价层电子对互斥理论,该分子中碳原子的轨道杂化类型,前者为sp3 杂化,后者为sp2杂化。
答 案:(1)否 若是sp3 杂化,[Cu(NH3)4]2+ 的立体构型为正四面体形,将配离子[Cu(NH3)4]2+ 中的2 个NH3 换为CN- ,则只有1种结构
(2)<
(3)四面体形 >
(4)sp2、sp3
易错点3:晶体结构与性质
晶体结构与性质在试题中常见的命题角度有晶体的类型、结构与性质的关系、晶体熔沸点高低的比较、配位数、晶胞模型分析及有关计算等考点。试题侧重晶体类型判断、物质熔沸点的比较与原因、晶胞中微粒数的判断、配位数、晶胞密度计算、晶胞参数、空间利用率计算的考查。易错点主要是晶胞特点的计算,如面心立方晶胞与体心立方晶胞的配位数不同;晶胞参数给定单位是nm 或pm时,忽略换算成cm。
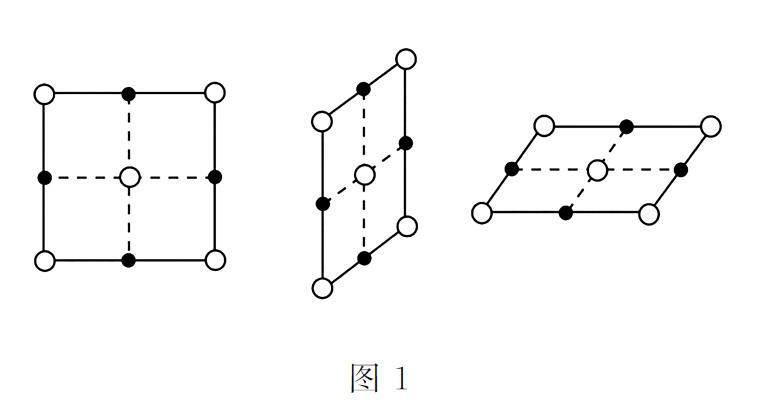
易错提醒:(1)判断某种微粒周围等距且紧邻的微粒数目时,要注意运用三维想象法。如NaCl晶体中,Na+ 周围的Na+ 数目(Na+用“○”表示)如图1所示,每个面上有4个,共计12个。
(2)常考的几种晶体主要有干冰、冰、金刚石、SiO2、石墨、CsCl、NaCl、K、Cu等,要熟悉以上代表物的空间结构。当题中信息给出与某种晶体空间结构相同时,可以直接套用某种结构。
规律方法:晶胞密度计算的基本过程。
例4 氮化钛晶体的立方晶胞结构如图2所示,该晶胞中N 和N 之间的最近距离为a pm,以晶胞边长为单位长度建立坐标系,原子A 的坐标参数为(0,0,0),下列说法错误的是( )。
答案:A
例5 芯片作为科技产业,以及信息化、数字化的基础,自诞生以来,就一直倍受关注, 也一直蓬勃发展。芯片制造会经过六个最为关键的步骤:沉积、光刻胶涂覆、光刻、刻蚀、离子注入和封装。
(1)将Mn掺杂到GaAs的晶体中替换部分Ga得到稀磁性半导体材料,晶体结构如图3(甲)所示。
