哮喘患儿IL-22、RAD50 基因多态性与易感性的关系
2023-05-26侯颖莹赵惯军贾耀丽
侯颖莹,赵惯军,贾耀丽,王 艳
1.平顶山市第一人民医院 普儿一科(平顶山467000);2.平顶山市第一人民医院 新生儿重症监护病区(平顶山467000);3.郑州大学附属儿童医院 急诊医学科(郑州 450000)
哮喘是一种以慢性气道炎症和气道高反应性为特征的呼吸道疾病[1]。流行病学调查研究显示,我国哮喘的患病率为0.5%~5.8%[2]。近年来,哮喘的发病率呈逐年上升的趋势,儿童哮喘在过去十年的发病率上升了64.52%。哮喘具有反复发作、迁延难愈的特点,不仅影响儿童身体健康和日常活动,还会对生长发育和心理造成不利影响[3]。
哮喘是一种受遗传、环境因素双重影响的多基因复杂性疾病[4]。变应原、运动等环境因素是哮喘发病的重要诱因,遗传因素则可影响个体对哮喘的易感性[5]。THOMSEN[6]等的双生子试验发现,哮喘的遗传度达到36%~78%。哮喘作为多基因遗传性疾病,单个基因对哮喘的表型影响有限,多个基因的累积效应构成了哮喘的遗传性。寻找哮喘的易感基因并分析基因间的相互作用对儿童哮喘的预防、诊断和治疗具有重要作用。白介素-22(interleukin-22,IL-22)是主要由T细胞和自然杀伤细胞合成和分泌的细胞因子。有研究指出,IL-22在诱导呼吸道炎症和形成气道高反应性方面发挥重要作用[7]。RAD50基因可编码DNA 修复蛋白,还能调控白介素-13 等相邻基因的表达[8]。动物试验发现,RAD50基因突变对哮喘小鼠气道炎症有明显的缓解作用,白介素-4、白介素-13、白介素-25 等炎症因子在RAD50基因突变小鼠的表达水平也出现明显的下降,提示RAD50基因可能与哮喘的发生发展有关[9]。本研究选取IL-22、RAD50基因的4个位点,探讨二者基因多态性与儿童哮喘易感性的关系,现将结果报道如下。
1 资料与方法
1.1 一般资料
选取2019年1月至2021年1月在河南省平顶山市第一人民医院收治的哮喘患儿76例作为观察组,年龄8个月~14岁,平均年龄(6.51±2.13)岁。纳入标准:①符合《儿童支气管哮喘诊断与防治指南》[10]诊断标准;②获得患儿及家属知情同意;③本研究符合《赫尔辛基宣言》。排除标准:合并心血管系统疾病、神经系统疾病、自身免疫障碍、恶性肿瘤等。另选取同期体检健康的儿童62例作为对照组,纳入标准:①体检健康;②依据观察组患儿性别和年龄进行匹配。
1.2 方法
1.2.1背景资料收集 收集两组年龄、性别、出生方式、出生时体重、喂养方式、1岁内抗生素使用次数、宠物饲养情况、家族过敏史、家族哮喘史、被动吸烟等情况。
1.2.2实验室检测 取两组受试对象静脉血3 mL,采用天根公司生产的血液基因组提取试剂盒提取基因组DNA。使用美国GE 公司生产的紫外分光光度计测定DNA 浓度及纯度。经Hapmap 检索IL-22、RAD50基因组序列SNP 位点,选取IL-22基因的rs17224704 位点、rs2227473 位 点,RAD50基 因 的rs6871536 位 点、rs17166050 位点。使用Primer 5.0 软件设计各位点引物序列。引物由上海生工生物公司合成。PCR反应体系如下:上下游引物各1 μL,2×Taqman 通用预混物5 μL,全基因组模板1 μL,ddH2O 2 μL,共计10 μL。反应设置条件:95 ℃8 min,42 个循环,95 ℃10 s,65 ℃25 s,72 ℃10 s。PCR产物经琼脂糖凝胶电泳检测后选取对应条带送交上海生工生物公司测序。
1.3 统计学处理
采用SPSS 23.0统计学软件分析数据,等位基因频率和位点基因型采用Hardy-Weinberg遗传平衡定律检验,计数资料用率表示,采用χ2检验,符合正态分析计量资料采用表示,采用独立t检验,影响儿童哮喘发生的危险因素分析采用Logistic 回归分析。P<0.05提示差异有统计学意义。
2 结果
2.1 两组基线资料比较
两组出生方式、1岁内抗生素使用次数、饲养宠物、家族过敏史、家族哮喘史、被动吸烟等情况比较差异有统计学意义(P<0.05),年龄、性别、出生时体重、喂养方式比较差异无统计学意义(P >0.05),见表1。
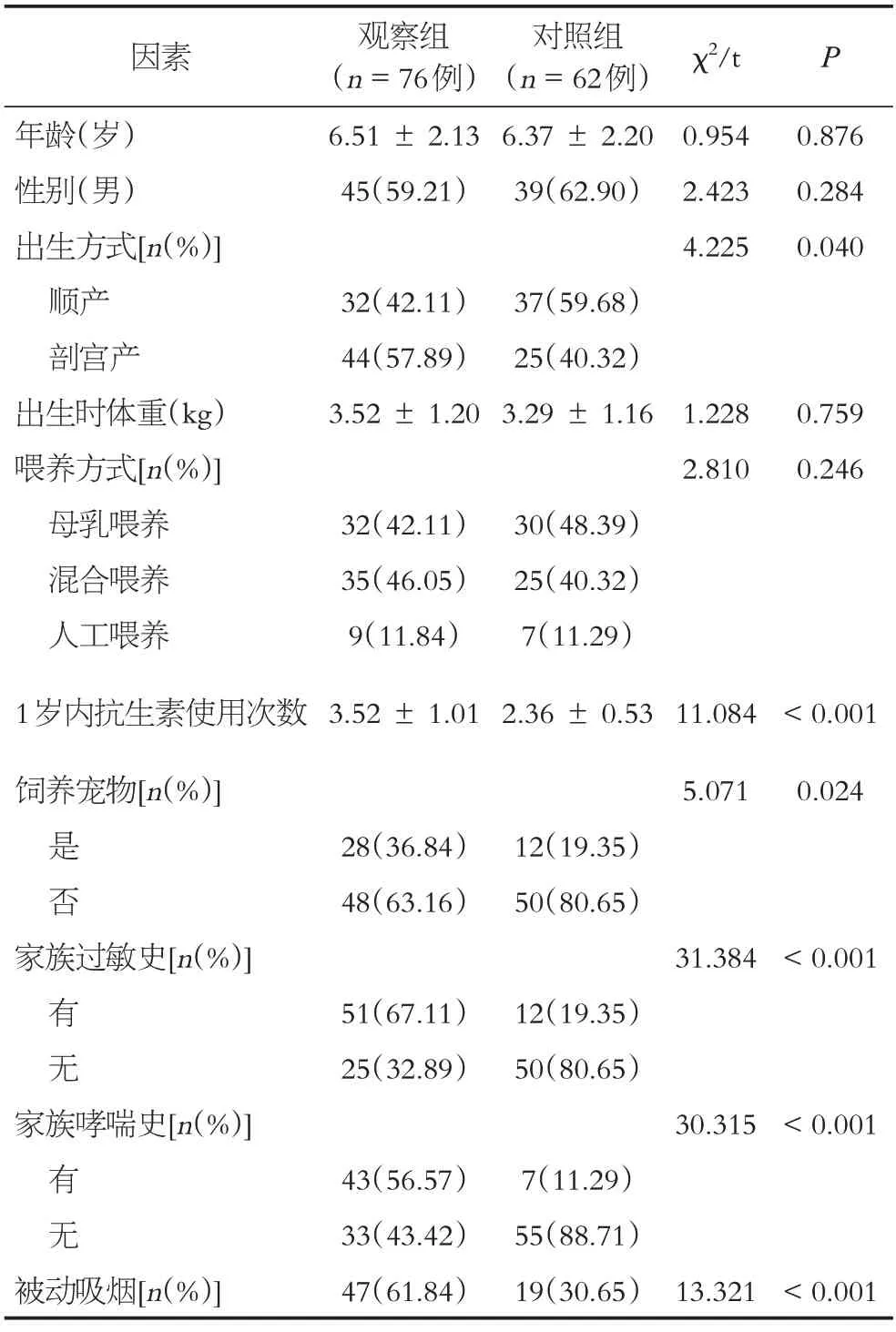
表1 两组基线资料比较[n(%)]Table 1 Comparison of baseline data between the two groups[n(%)]
2.2 两组IL-22基因型及等位基因频率分布
两组IL-22基因rs17224704 位点、rs2227473 位点基因型比较差异无统计学意义(P >0.05),见表2;两组IL-22基因rs17224704 位点、rs2227473 位点等位基因频率比较差异有统计学意义(P<0.05),见表3。
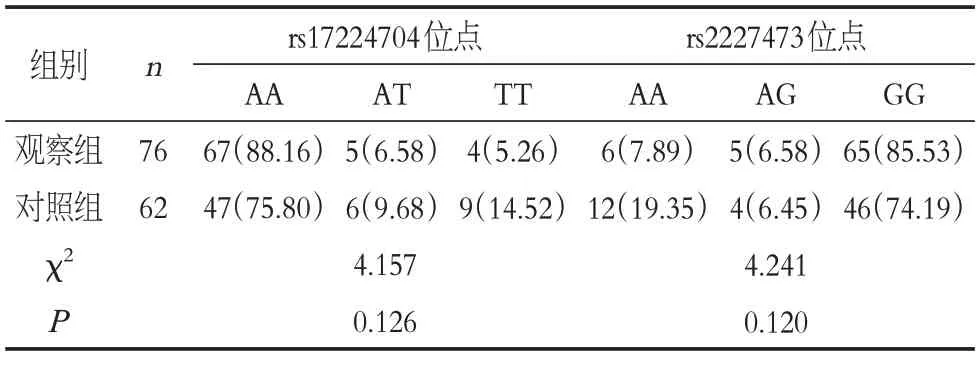
表2 两组IL-22基因型分析Table 2 IL-22 genotype analysis of the two groups
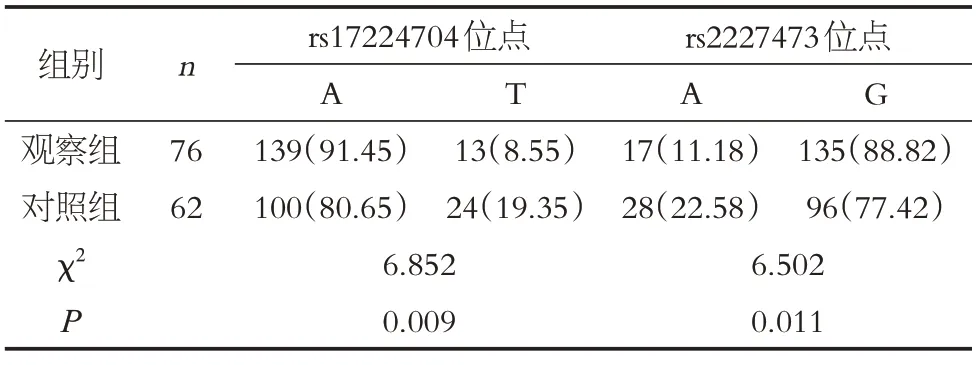
表3 两组IL-22基因等位基因频率分布Table 3 Allele frequency distribution of IL-22 gene in the two groups
2.3 两组RAD50基因型及等位基因频率分布
两组RAD50基因rs6871536 位点、rs17166050 位点基因型、等位基因频率比较差异有统计学意义(P<0.05),见表4、表5。
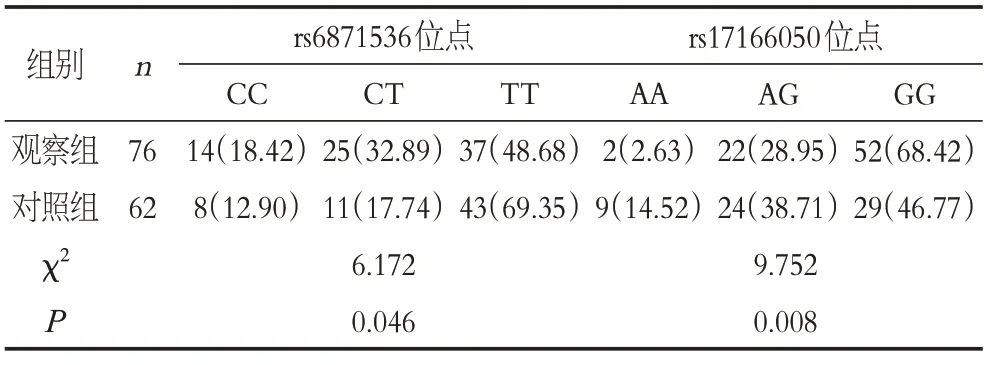
表4 两组RAD50基因型分析Table 4 RAD50 genotypes in the two groups
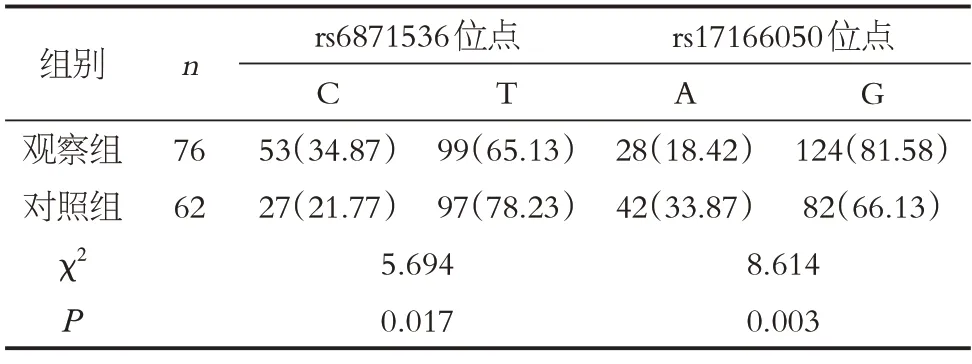
表5 两组RAD50基因等位基因频率分布Table 5 Allele frequency distribution of RAD50 gene in the two groups
2.4 基因-基因交互作用与儿童哮喘易感性分析
将分组引入因变量,位点基因型及其交互项引入Logistic回归模型自变量,其他因素作为控制变量,分析IL-22基因与RAD50基因之间的交互作用,结果显示,在相乘模型中rs17224704 位点、rs2227473 位点存在交互作用,交互项有统计学意义(P<0.05),其余交互项未观察到统计学意义(P >0.05),见表6。
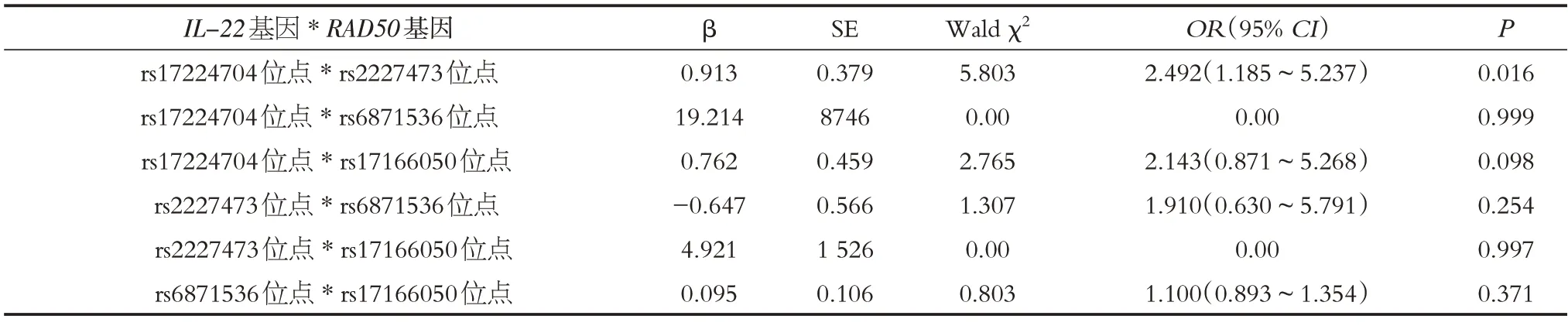
表6 基因-基因交互作用与儿童哮喘易感性分析Table 6 Analysis of gene-gene interaction and susceptibility to asthma in children
2.5 影响儿童发生哮喘的多因素回归分析
以儿童是否发生哮喘赋值(发生=1,未发生=0),纳入出生方式、1岁内抗生素使用次数、饲养宠物、家族过敏史、家族哮喘史、被动吸烟、IL-22基因rs17224704位点等位基因频率(A=0,T=1)、IL-22基因rs2227473位点等位基因频率(A=0,G=1)、RAD50基因rs6871536 位点基因型(CC=0,CT=1,TT=2)、rs6871536位点等位基因频率(C=0,T=1)、rs17166050 位点基因型(AA=0,AG=1,GG=2)、rs17166050 位点等位基因频率(A=0,G=1)等指标进行Logistic回归分析,结果显示,有家族过敏史、家族哮喘史儿童发生哮喘的风险增加(P<0.05),IL-22基因rs17224704 位点携带等位基因A 的儿童发生哮喘风险较携带T的儿童增加(P<0.05),RAD50基因rs6871536位点携带等位基因C 的儿童发生哮喘风险较携带T 的儿童增加(P<0.05),见表7。
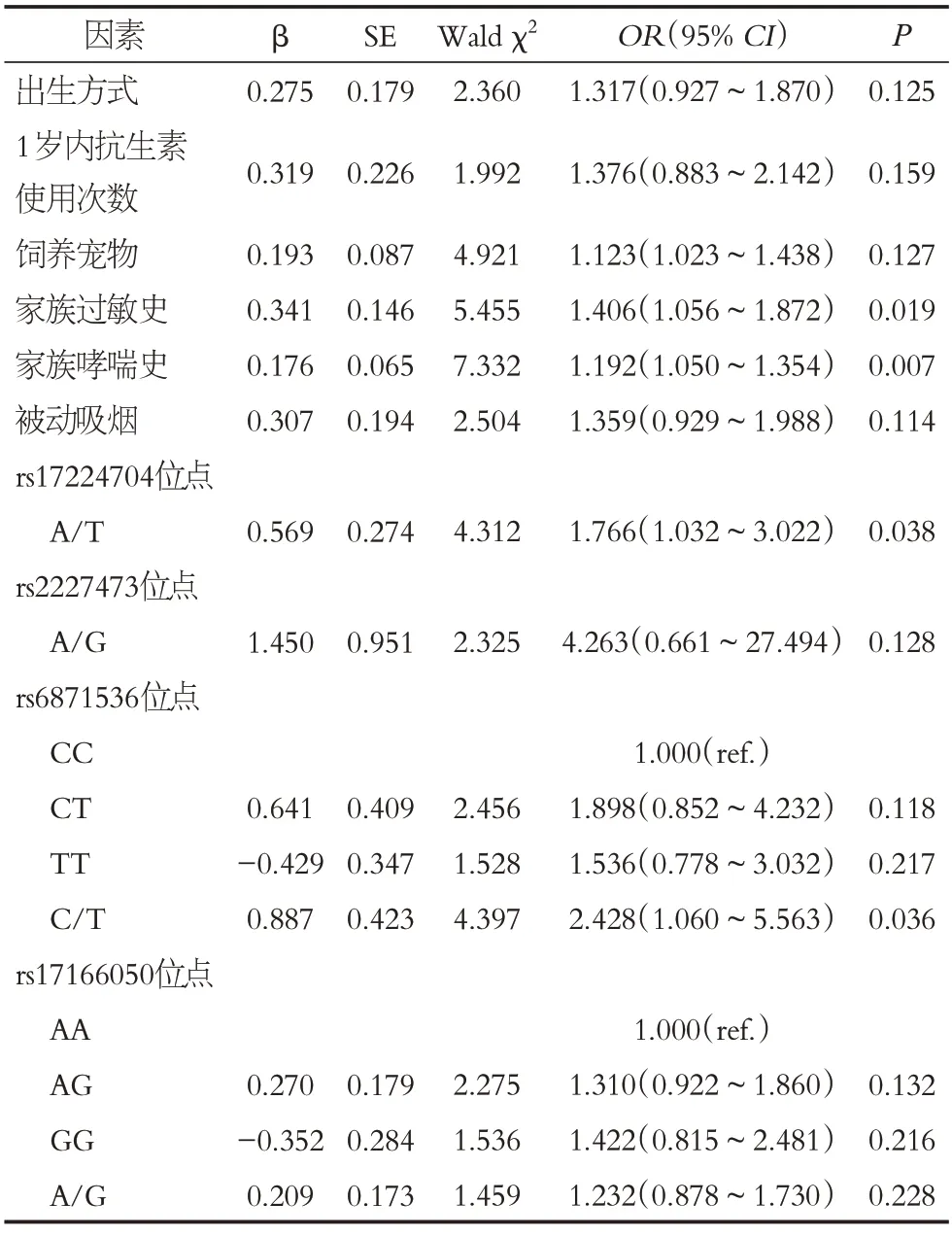
表7 影响儿童哮喘发生的Logistic回归分析Table 7 Logistic regression analysis of asthma in children
3 讨论
哮喘易感基因的筛选和确定,不仅是哮喘发生高危人群诊断和制定干预决策的科学依据,也是哮喘发病机制研究、靶向基因及药物治疗的基础[11]。随着哮喘易感基因研究的不断深入,已发现大量易感基因与哮喘的发生密切相关。BRANDT[12]等在排除了对照组中既往有哮喘家族史和过敏症状的儿童,实行更佳严谨的对照关联研究发现,表面活性蛋白D 基因的rs721917 位点的C/C 基因携带儿童罹患哮喘的风险降低。钟丹丹[13]等的研究发现,哮喘患者血清IL-18水平降低,携带(-607C/A)AA 基因型的人群罹患哮喘风险增加。STAT3基因内含子11rs2293152C/G 的多态性与川南地区儿童哮喘的易感性相关,可作为儿童哮喘潜在预测性标志物之一[14]。
IL-22基因于2000年经Dumoutier在研究T淋巴细胞时首次发现。IL-22基因长约6 kb,定位于染色体12q15 上。IL-22基因编码的蛋白经剪切、修饰作用后可与其受体结合,发挥多种生物学效应[15]。动物试验发现,与正常小鼠对比,哮喘模型小鼠外周血IL-22 水平显著增加,差异有统计学意义;进一步对肺组织分析发现,哮喘组IL-22mRNA水平、IL-22蛋白表达水平也明显高于正常对照组[16]。张国伟[17]等的研究指出,哮喘患者治疗前外周血IL-22呈现较高水平,经雾化吸入治疗后患者临床症状明显缓解,血清IL-22 显著降低。TAUBE[18]等的对比研究发现,IL-22基因剔除的哮喘小鼠模型较正常哮喘小鼠模型肺部炎性反应明显减轻,炎性细胞、嗜酸性细胞数目显著降低,支气管管腔狭窄和平滑肌细胞增生等气道重塑现象明显减轻。以上研究表明,IL-22的表达与哮喘的炎症状态及气道重构有关,其在哮喘的疾病发生发展中扮演重要角色。有研究显示,IL-22基因多态性与肿瘤、炎症反应性疾病的易感性有关。但IL-22基因多态性与儿童哮喘的易感性尚未见报道。本研究选取rs17224704、rs2227473 两个与炎症相关的SNPs 位点,经对比研究发现,哮喘患儿rs17224704位点等位基因A携带频率显著高于正常对照组;进一步行Logistic回归分析发现,rs17224704位点携带等位基因T 的儿童罹患哮喘的风险降低,结合上述数据推测,IL-22基因rs17224704位点多态性可能对其表达水平有一定影响,rs17224704 位点携带等位基因A 的儿童IL-22基因转录水平或活性较携带等位基因T 的儿童更高,接触过敏原等环境刺激后气道炎症反应更为强烈,因而具有更高的易感性。RAD50基因位于染色体5q31.1 区域,其编码的大分子蛋白是DNA双链断裂的主要感受器,并参与DNA修整恢复、信号转导等一系列环节。此外,RAD50基因靠近白介素-3、白介素-4、白介素-5、白介素-13 等炎症因子的编码区域,上述炎症因子的可刺激B 淋巴细胞分泌免疫球蛋白E(IgE),与嗜酸性粒细胞,肥大细胞结合后可引起组胺的释放,从而引发哮喘[19]。目前RAD50通过引起Th2t 细胞对呼吸道上皮细胞炎症反应从而诱发哮喘的途径已经得到证实[20]。一项纳入1 707 例儿童的研究显示,在排除人口学差异、环境暴露等多方面的干扰因素后发现,RAD50基因多态性对儿童哮喘的发生具有显著预测价值(AUC=0.70)[21]。MURK[22]等的研究显示,RAD50基因rs2750347 位点的基因多态性与哮喘的发生风险具有关联性。于美丽[23]等利用质谱SNP技术对160例儿童的对比研究发现,哮喘患儿RAD50基因rs6871536 位点基因型与等位基因频率与正常儿童存在显著差异,与本研究结果相近。Logistic回归分析结果显示,RAD50基因rs6871536位点等位基因C 频率增加是儿童罹患哮喘的独立危险因素,综合上述因素推测原因如下:①执行错配修复功能时增加哮喘相关易感基因突变频率,激发转录活性;②调控临近炎症因子的转录效率和转录活性,从而影响机体的免疫反应性,形成过敏性体质,增加哮喘易感性。目前认为单一基因对哮喘易感性的影响效果有限,多基因之间的交互作用在哮喘的发生和发展中具有重要作用。本研究对选取的4 个基因位点进行分析,结果显示,rs17224704 位点与rs2227473 位点存在交互作用,说明多基因的相互作用、相互积累发挥的功能可能高于单个基因的效用。
本研究结果显示,具有家族过敏史和家族哮喘史是儿童哮喘发生的独立危险因素。具有家族过敏史的儿童一般伴随着机体对尘螨、花粉等特定物质产生高反应性。这种高反应性针对不同的部位表现形式各异,如过敏性结膜炎、过敏性鼻炎、荨麻疹等。过敏体质儿童受到外界变应原刺激时机体IgE数量异常升高,哮喘的发生风险大大增加[24]。哮喘在临床表现的家族聚集性很早就受到关注。近年来随着遗传学的发展,哮喘的多基因遗传性得到普遍证实。有研究指出,父母均患哮喘的儿童哮喘发生率为42.1%~60.5%,直系血亲无哮喘病史的儿童发病率只有6%~9%左右[25]。胡倩[26]等的研究发现,直系亲属患有哮喘是哮喘患病的独立危险因素,证实家族遗传对儿童罹患哮喘具有重要影响,因此具有哮喘家族史的儿童应日常提高防护能力。具有家族过敏史和哮喘史的儿童应避免接触过敏原,做好日常防护和监测,防止哮喘的发生。本研究样本量较小,结果还需扩大样本量进行验证,并深入研究。
4 结论
IL-22基因rs17224704位点、RAD50基因rs6871536位点基因多态性均与儿童哮喘易感性密切相关,IL-22基因rs17224704位点携带等位基因A的儿童发生哮喘风险较携带T 的儿童增加,RAD50基因rs6871536 位点携带等位基因C的儿童发生哮喘风险增加。
