甲巯丙脯酸功能化金纳米团簇对小鼠皮肤黑色素瘤的体外光热/光动力抗癌活性
2023-05-26刘欣雨钟文彩唐冬梅郑有坤
刘欣雨 ,钟文彩 ,肖 静 ,唐冬梅 ,叶 脉 ,郑有坤
1.西南医科大学药物与功能性食品研究中心(泸州646000);2.西南医科大学临床医学院(泸州 646000)
皮肤黑色素瘤是一种起源于皮肤黑色素细胞的恶性肿瘤,占皮肤癌患者死亡人数的80%以上[1]。手术治疗是目前治疗皮肤黑色素瘤最主要的方法,但手术治疗易遗留瘢痕,且黑色素瘤细胞的转移性扩散也使得术后预后较差,极易引起肿瘤复发和伤口感染[2]。此外,药物化疗对患者身体毒副作用较大,对患者的生存获益相对有限[3]。因此,急需寻找更加理想的治疗策略用于临床皮肤黑色素瘤治疗。
光热疗法(photothermal therapy,PTT)和光动力疗法(photodynamic therapy,PDT)是应用于癌症治疗的两种主要光疗法,可在光敏剂存在的条件下通过激光照射产生光热效应和诱导生成具有细胞毒性的活性氧物种,如单线态氧(1O2),进而杀死癌细胞[4-6]。目前将PTT 和PDT 联用主要通过将光热转化剂和光敏剂共载,联合PTT/PDT 以增强抗肿瘤疗效[7]。然而,现有的PTT/PDT 联合多为物理性结合,大多将彼此相对独立的光热试剂和光敏剂整合,组装体系稳定性差,治疗时常需采用两种不同波长光源,难以实现在单一光源激发下同时发挥光热和光动力效应[8],因此其临床推广和治疗效果均相对有限。
纳米医学的发展为单一光源下实现PTT/PDT联合治疗提供了新的方向。金纳米团簇(AuNCs)是一类尺寸小于2 nm的纳米聚集体,由于其独特的物理化学性质和卓越的生物相容性,在生物医学领域得到广泛关注[9-11]。甲巯丙脯酸(captopril)是一种血管紧张素转化酶抑制剂,具有抑制血管生成、改善肿瘤转移的药效[12-13]。前期研究发现,该小分子抑制剂功能化的AuNCs 可在近红外激光下同时激发光热效应和诱导1O2生成。因此,本研究在对该PTT/PDT纳米体系性能表征的基础上,以小鼠黑色素瘤细胞B16F10 为对象,研究其体外抗黑色素瘤的潜力和生物安全性,为皮肤黑色素瘤治疗提供新的研究思路。
1 材料与方法
1.1 主要材料
甲巯丙脯酸、HAuCl4、N-乙酰半胱氨酸(NAC)、NaBH4和NaOH购买于阿拉丁试剂;小鼠黑色素瘤细胞株B16F10 购买于中科院上海细胞生物所;Cell Counting Kit-8(CCK-8)细胞活性检测试剂盒购买于碧云天生物;单线态氧检测试剂(Singlet Oxygen Sensor Green,SOSG)购买于ThermoFisher;超滤离心管(3 kD)购买于Millipore。
1.2 AuNCs的合成与表征
AuNCs 的合成采用Xie 等[14]建立的NaOH 介导NaBH4还原法进行。在磁力搅拌下,将0.25 mL 20 mM的HAuCl4与2 mL 5 mM 的甲巯丙脯酸混合溶于2.35 mL水中,形成甲巯丙脯酸-Au(I)复合物。随后,将0.3 mL 1 M 的NaOH 加入上述反应体系,并将0.1 mL 溶于0.2 M NaOH 的NaBH4(112 mM)再快速加入该反应体系,继续反应3 h。待反应结束后,采用超滤离心对AuNCs进行纯化。
AuNCs 的形貌和分散性采用JEM-2100 TEM 进行表征,粒径统计采用Nano Measurer 进行;使用756S 型紫外可见分光光度计记录AuNCs 的光谱特征;AuNCs的zeta 电位采用Malvern Nano ZS Zetasizer 90 测定;采用ULVAC-PHI5000 Versaprobe XPS 表征AuNCs 中金属的价态。
1.3 AuNCs的光热效应测定
采用2 W/cm2808 nm 激光照射不同浓度的AuNCs 10 min,每隔1 min采用FLIR C5热成像仪拍照,记录溶液温度变化。为评估AuNCs 的光热稳定性,待激光照射AuNCs 10 min后即移除激光,自然降温10 min,记录温度变化过程,以上过程重复3 次循环。光热转化效率(η)根据文献[15]的方法计算。
1.4 AuNCs的光动力效应测定
采用SOSG 检查808 nm 激光照射不同时间时体系中的1O2生成情况,以评估AuNCs 的光动力效应。1O2生成的相对浓度以488 nm 激发波长条件下530 nm 波长的荧光强度进行统计。
1.5 AuNCs对B16F10的细胞毒性研究
为评估AuNCs 的生物安全性,采用CCK-8 法评估了不同浓度处理对B16F10 的细胞毒性。AuNCs 的终浓度分别设定为0、1、2、4、8、16、32、64、128、256 μg/mL。细胞存活率(%)以实验组与空白对照组观测值的比值表示。以细胞存活率大于85%为安全浓度,测定对B16F10细胞安全的AuNCs浓度。
1.6 近红外激光激发下AuNCs对B16F10的杀灭效应
将B16F10 种植于96 孔板中,设置空白对照组、AuNCs治疗组、激光照射组、AuNCs+激光照射组,每组5 个重复,AuNCs 组和AuNCs+激光照射组各孔内添加最大安全浓度的AuNCs,避光培养2 h。激光组和AuNCs+激光照射组各孔细胞均采用2 W/cm2808 nm激光照射10 min。同时,采用热成像仪和SOSG法分别检测细胞温度变化及1O2生成情况。37°C 培养24 h 后,采用CCK-8 法检测各组细胞存活率。此外,为区分PTT 和PDT 对抗癌活性的贡献,在上述实验分组的基础上添加AuNCs+激光照射+NAC 组、AuNCs+激光照射+冰浴组以分别去除1O2和热效应的影响。
1.7 统计学分析
采用Origin 8.0 软件进行统计学分析,使用t检验进行两组数据间的差异性比较,P<0.05为差异有统计学意义。
2 结果
2.1 AuNCs的表征
通过NaOH介导NaBH4还原,甲巯丙脯酸功能化的AuNCs被成功合成。如图1A所示,合成的AuNCs溶液呈棕色,在440、552、670、760 nm 处均具有一定的紫外吸收峰,这与Au25(SR)18(SR=配体)的特征吸收峰一致[14,16-17],表明该AuNCs 可能具有Au25的结构特征。高分辨TEM 显示,AuNCs 呈颗粒状团簇,平均粒径(1.6±0.2)nm,分散均匀(图1B、1C)。XPS 结果显示,Au4f5/2和Au4f7/2的结合能分别为87.5 eV 和83.8 eV(图1D),表明AuNCs金核存在Au(0)和Au(I)两种价态[18]。通过电位测定,AuNCs 的表面带负电荷,zeta 电位为(-34.8±4.98)mV。
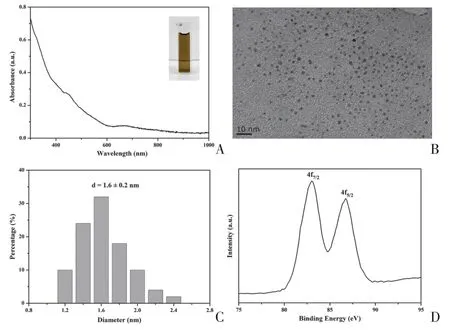
图1 AuNCs的表征Figure 1 Characterization of AuNCs
2.2 AuNCs的光热和光动力效应
AuNCs 的光热效应结果如图2A~2C 所示。相比对照组(0 μg/mL),AuNCs 组体系温度快速升高,并伴有显著的浓度依赖特征。在200 μg/mL 浓度下激光照射10 min体系温度即可升至60°C以上,10 min内升温幅度(ΔT)接近40°C,显示出卓越的光热效应。通过连续3个升温-降温循环过程,体系温度也可维持在60°C以上,表现出良好的光热稳定性。根据文献[15]的方法计算得到AuNCs的光热转化效率(η)为34.4%。
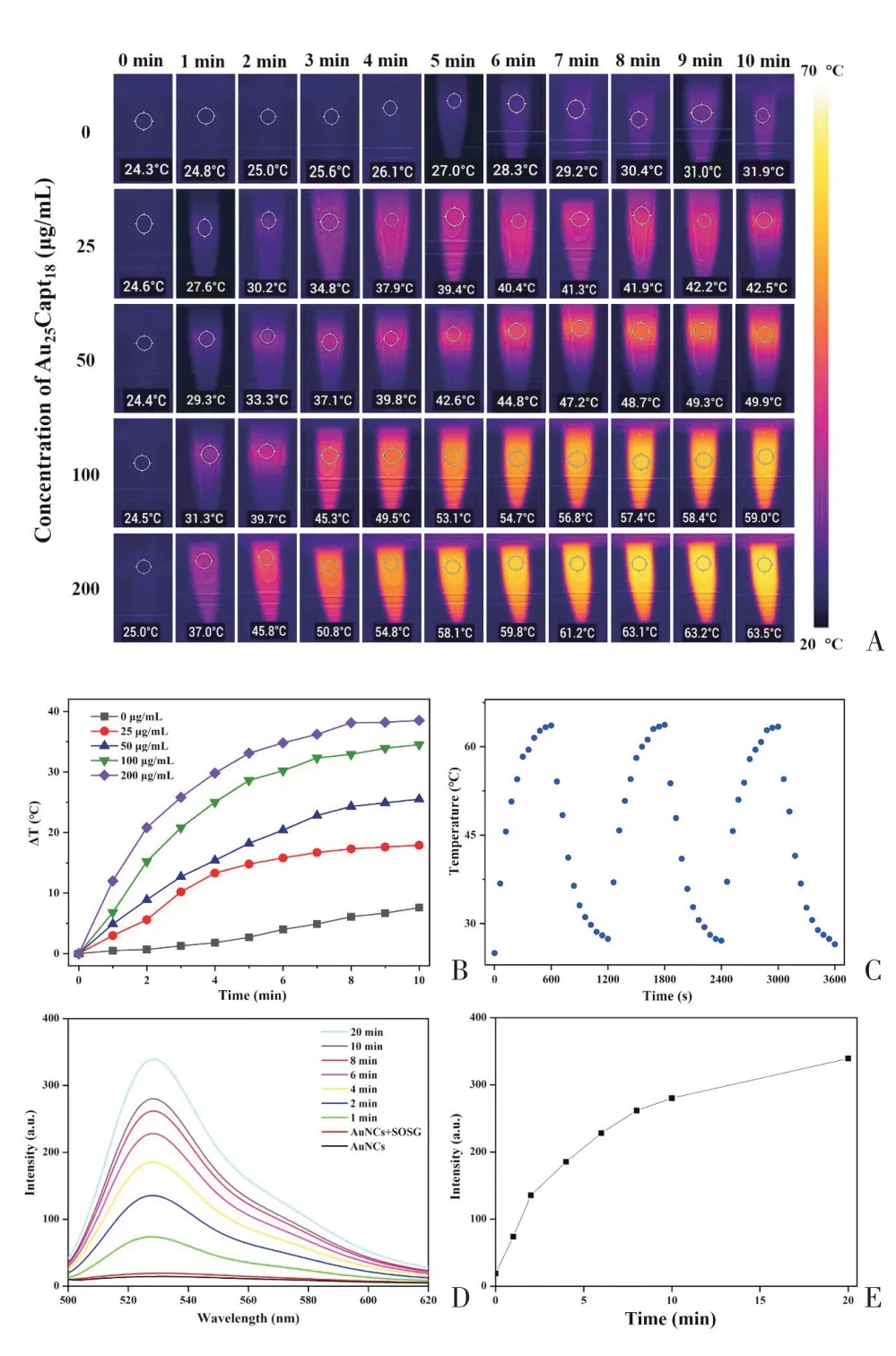
图2 AuNCs的光热/光动力效应Figure 2 Photothermal effect of AuNCs
采用SOSG 测定AuNCs 不同时间1O2生成情况,以评估AuNCs的光动力效应,结果如图2D~2E所示。在未施加激光照射下,体系中未检测到1O2存在。当激光照射后,体系中产生大量的1O2,1O2生成随激光照射时间增加而升高,显示出AuNCs良好的光动力特征。
2.3 AuNCs对黑色素瘤细胞B16F10的毒性
AuNCs对B16F10的细胞毒性结果如图3所示。在AuNCs浓度为128 μg/mL以内,黑色素瘤细胞与AuNCs孵育24 h 后,细胞存活率均大于85%。当AuNCs 浓度达到256 μg/mL 时,细胞存活率为(73.2±3.1)%,与其他各浓度组细胞存活率存在差异,差异具有统计学意义(P<0.05)。128 μg/mL 浓度组细胞存活率为85.9±2.4)%,与64 μg/mL 浓度组细胞存活率比较,差异无统计学意义(t=3.57,P>0.05)。从CCK-8 结果可以看出,在浓度为128 μg/mL以内,AuNCs对B16F10不存在明显的细胞毒性。
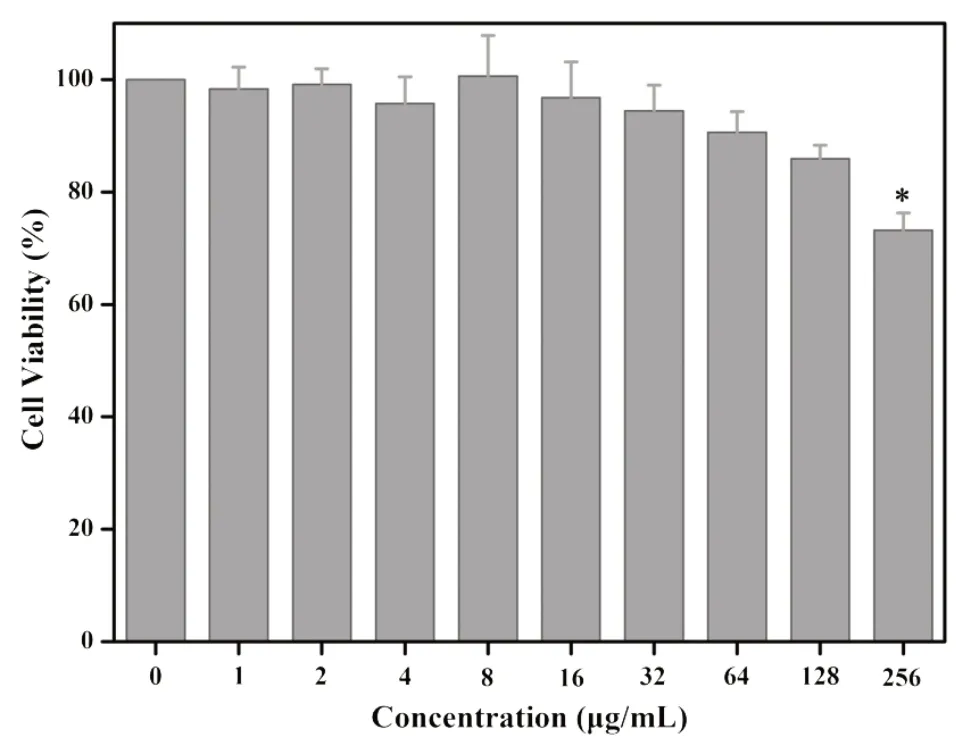
图3 小鼠黑色素瘤细胞B16F10与不同浓度AuNCs孵育24 h后的细胞存活率Figure 3 Cell viability of melanoma cells B16F10 treated with different concentrations of AuNCs for 24 h.
2.4 808 nm 激光照射下AuNCs 对B16F10 的杀伤效应
根据细胞毒性及光热/光动力效应结果,在100 μg/mL 浓度下继续评估AuNCs 的PTT/PDT 抗癌活性。如图4A 所示,相比对照组,AuNCs 治疗组激光照射后温度从(26.6±0.2)°C 升高到(58.7±2.4)°C,升温幅度超过30°C,差异具有统计学意义(P<0.05)。相应地,AuNCs+激光照射组在激光照射后1O2产率显著上升(P<0.05),超过对照组水平的7倍(图4B)。采用CCK-8测定了各治疗组激光照射后的细胞存活率,结果如图4C 所示。相比对照组,AuNCs 治疗组、激光照射组、AuNCs+激光照射组的细胞存活率分别为(88.6 ±5.6)%、(93.4±4.1)%、(38.8±2.8)%,AuNCs+激光照射组细胞存活率均显著低于其他治疗组(P<0.05)。对照组、AuNCs 治疗组、激光照射组3 组之间细胞存活率差异无统计学意义(P>0.05)。此外,为探究PTT 和PDT 对AuNCs 抗癌活性的贡献,分别以NAC 和冰浴去除1O2和热效应的影响,结果如图4D所示。结果显示,添加NAC 后,细胞存活率从(38.8±2.8)%增加到(52.6± 3.8)%;而在冰浴组中,细胞的存活率为(69.3 ±3.2)%。在该体系中,AuNCs的PTT效应对抗癌活性的影响显著高于PDT效应。
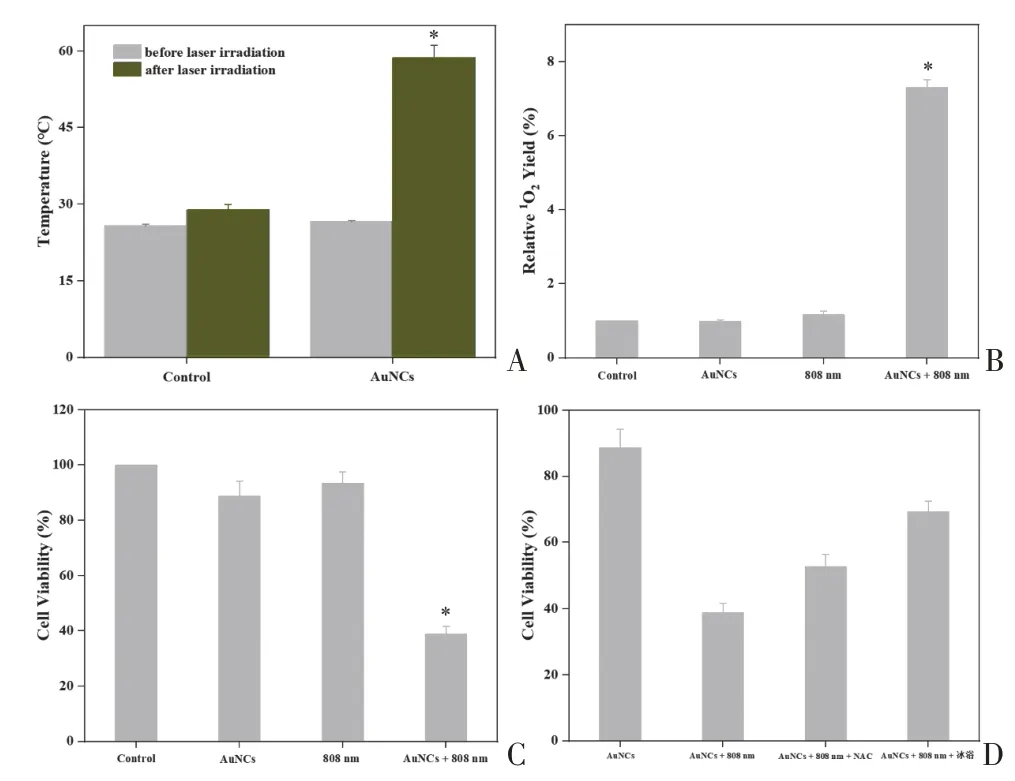
图4 808 nm激光照射下AuNCs对B16F10的PTT/PDT杀伤效应Figure 4 The PTT/PDT effects of AuNCs on B16F10 under 808 nm laser irradiation
3 讨论
皮肤黑色素瘤具有高转移性和侵袭性特征,其临床治疗仍是一个急需解决的难题[19]。手术切除、化疗、激光疗法等是目前治疗皮肤黑色素瘤的主要手段,但其各自的局限性也使得治疗效果不尽人意[20-21]。随着纳米医学的发展,各种基于纳米材料的黑色素瘤治疗策略被提出。例如,将阿霉素负载于细胞膜纳米囊泡,可显著改善黑色素瘤细胞对阿霉素的摄入[19]。将纳米金与抗肿瘤血管生成药物恩度结合,可显著抑制小鼠黑色素瘤的肺转移[22]。依赖普鲁士蓝卓越的光热效应,李蒙等[3]将其应用于皮肤黑色素瘤的光热治疗,取得了显著的疗效。本文针对恶性黑色素瘤开展新型治疗方法的研究,发现生物安全的AuNCs 对黑色素瘤细胞具有卓越的PTT/PDT 抗癌活性,有望为皮肤黑色素瘤治疗提供新的策略。
AuNCs 是一类被广泛关注的新型纳米材料,在肿瘤治疗方面具有广阔的应用前景[11]。相比石墨烯等其他纳米材料,AuNCs 具有卓越的生物相容性[16]。在过去的研究中,AuNCs通常仅被作为载体使用,通过负载抗癌药物或抑癌基因发挥抗癌活性[23-24]。此外,一些AuNCs也可被作为光敏剂用于肿瘤光热治疗[25]。本研究发现小分子抑制剂甲巯丙脯酸功能化的AuNCs 在808 nm 激光照射下同时具有光热和光动力效应,可有效杀灭皮肤黑色素瘤细胞,其抗癌活性与其PTT/PDT效应息息相关,显示出诱人的应用前景。免疫激活响应可能是增强PTT/PDT 抗肿瘤的主要作用机制之一[26-27],甲巯丙脯酸本身具有抑制肿瘤血管生成、改善肿瘤转移的功效[12-13]。因此,进一步开展动物和临床研究,深入阐释该PTT/PDT 体系抗皮肤黑色素瘤治疗策略的疗效和作用机制,对于发展新型的恶性黑色素瘤治疗策略具有重要意义。
4 结论
本研究以甲巯丙脯酸为功能配体通过NaOH-介导的NaBH4还原制备了一种在近红外激光下同时具有光热和光动力效应的AuNCs。AuNCs对小鼠皮肤黑色素瘤细胞具有卓越的抗癌活性,且在该体系中,AuNCs的PTT效应对抗癌活性的影响显著高于PDT效应。
