适用于单细胞测序的肾脏消化及CD45+单细胞分离方法
2023-05-26谭睿陟
贾 建,谭睿陟,王 丽
西南医科大学附属中医医院中西医结合研究中心(泸州 646000)
单细胞测序(single-cell sequencing,SCS)是指在单个细胞水平上对其携带的遗传信息进行测序,可深层次了解同类细胞不同亚群的分布状态、作用过程及协作机制等[1-2]。由于单细胞测序的特殊性,要求单细胞悬液中有活性的细胞总数大于10万个,此外单细胞悬液中细胞成团率、细胞活性状态及细胞内RNA 的完整性也直接决定了研究结果的准确性[3-4],不同组织解离单细胞所需要的消化酶、消化时间、温度和浓度不同[5]。然而肾脏组织结构复杂,肾脏细胞线粒体比例高,因此肾脏组织消化程度难以把控,目前尚没有成熟的肾脏单细胞悬液制备方法,导致肾脏CD45+单细胞分离更加困难。胰蛋白酶和Ⅳ型胶原酶是目前研究中的两种动物组织消化的常用试剂,包括小鼠的脑、肝脏组织等[6-7]。本文旨在比较胰蛋白酶和Ⅳ型胶原酶在不同消化条件下对小鼠肾脏组织的消化效果,以确定最佳消化方案,然后对最佳消化方案消化所得肾脏细胞悬液中的CD45+细胞进行磁珠分离后送单细胞测序并评估测序结果,为今后肾脏组织消化或肾脏其它重要细胞的单细胞测序前处理提供技术参考。
1 实验与方法
1.1 实验材料
1.1.1实验动物 实验动物选用雄性6~8 周龄SPF 级C57BL/6小鼠,体重约为18~20 g,共6只,购于成都达硕实验动物有限公司[SCXK(川)2020-030],饲养于西南医科大学实验动物中心[SYXK(川)2020-065],饲养温度20~24 ℃,饲养相对湿度50%~60%,12 h 光照12 h黑暗循环交替。本研究通过西南医科大学动物伦理委员会审核同意(审批号:2021DW027)。
1.1.2主要试剂与仪器 抗体生物素化试剂盒(Thermo Fisher Scientific,11060D)、磁珠分选试剂盒(Thermo Fisher Scientific,2232848)、Ⅳ型胶原酶(Worthington Biodchemical Corporation,LS004188)、胰蛋白酶(Beyptime,C0201)、DMEM 培养基(Gibico,812044)、CD45 抗体(Biolegend,103101)、恒温水浴锅(HHS-11,中国)、离心机(Eppendorf,美国)、倒置显微镜(Nikon,日本)。
1.2 方法
1.2.1实验分组 实验分为胰蛋白酶消化组和Ⅳ型胶原酶消化组,每种消化酶作用时间分别设置15、30 min和先消化15 min收集上清液后再加入新的消化液继续消化15 min(15min+15min组)。
1.2.2取材及前处理 按照50 mg/kg 腹腔注射浓度为10 mg/mL 的戊巴比妥钠溶液麻醉小鼠,75%酒精消毒小鼠皮肤,心脏采血法抽净小鼠血液,沿腹腔中线剖开小鼠腹腔,钝性分离双肾并去除肾脏包膜,将6只小鼠肾脏取出后,统一在冰上用手术刀片剁碎至肉泥状,最后将其平均分成6份待消化处理。
1.2.3肾脏组织消化 将剁碎后的肾脏组织用10 mL PBS 重悬,随后在50 g 离心力作用下离心5 min 后弃去上清液以除去红细胞,随后将组织用10 mL DMEM 培养基(含5% FBS)重悬,各组分别加入Ⅳ型胶原酶(10μ/mL)和胰蛋白酶(30μ/mL)于37 ℃水浴消化,消化过程中均加入50U脱氧核糖核酸酶Ⅰ以去除死亡细胞释放的DNA减少细胞聚集。消化完成后用70 μm细胞筛过滤去除未消化完全组织,1200 rpm/min 离心5 min后收集上清液,加入红细胞裂解液重悬细胞沉淀破除红细胞,40 μm细胞筛过滤去除红细胞碎片,1 200 rpm/min 离心5 min 弃去上清,加入1 ml PBS 重悬洗涤细胞沉淀并重复两次。最终将细胞沉淀重悬收集于500 μl DMEM培养基中。
1.2.4形态学观察 各组分别取消化完成的细胞悬液10 uL 涂于载玻片上,在Nikon 倒置光学显微镜下采集图片,观察组织消化后所得细胞混悬液状态,比较组织消化完全度、单细胞数量、细胞成团情况和细胞状态。
1.2.5消化效果比较 取各组消化完成后的肾脏单细胞悬液稀释10倍,后取稀释后的细胞悬液9 μL与1μL 0.4%浓度的台盼蓝溶液混匀,再取1 μL混合液加到细胞计数板上,在倒置显微镜下计数4 个大方格内的细胞数和台盼蓝着色细胞数,各组单细胞总数目=(4 个大方格细胞数之和/4)×104×细胞原液量(mL)×10;细胞活力=4 个大方格台盼蓝着色细胞总数/4 个大方格细胞总数;细胞成团率=4个大方格成团细胞总数/4个大方格细胞总数。比较各组细胞计数差异性。
1.2.6CD45+单细胞分选 根据肾脏消化效果比较结果,选择消化所得细胞存活率高、细胞总数多和成团率低的消化方案进行消化,并对肾脏细胞悬液中的CD45+细胞进行分离。提前参照DSB-X™Biotin Protein Labeling Kit 使用说明将CD45+抗体生物素化,再根据Dynabeads®FlowComp™Flexi 试剂盒将生物素化后的抗体与磁珠结合,然后将消化所得肾脏细胞悬液与结合了CD45+抗体的磁珠共同孵育30 min 使肾脏CD45+细胞与磁珠结合,最后在磁力作用下可将结合了磁珠的CD45+细胞分离。分离完成后500 rpm/min 离心1 min收集上清液以去除较大细胞团。
1.2.7分离后的CD45+细胞计数、活力及成团率测定选择消化效果最好的消化方案所得肾脏细胞悬液CD45+单细胞悬液9 uL与1 μL 0.4%浓度的台盼蓝溶液混匀,再取1 μL混合液加到细胞计数板上,在倒置显微镜下计数4 个大方格内的细胞数、成团细胞数以及台盼蓝着色细胞数。
1.2.8单细胞测序结果质控 根据单细胞测序结果分析各组细胞线粒体基因表达量,CD45+细胞阳性率以及各种免疫细胞亚群分群情况评价细胞状态。
1.3 统计学分析
使用GraphPad Prism 9软件进行数据统计学分析,组间比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 细胞状态观察
随消化时间的增加,肾脏组织消化程度越明显,在消化时间达30 min时,所有组织均已被消化完全,溶液呈悬浊液状。光镜下,相同消化时间内胰蛋白酶消化能力明显弱于Ⅳ型胶原酶,并且消化过程中产生大量细胞碎片,不利于后续分选及测序。Ⅳ型胶原酶消化能有效减少细胞碎片的产生,并且优化后的15 min+15 min消化法与30 min直接消化法相比所得细胞数量多、产生的细胞碎片少、细胞形态更完整(见图1)。

图1 不同消化条件消化所得肾脏细胞悬液(×100)Figure 1 The suspension of kidney cells was digested under different digestive conditions(×100)
2.2 不同消化方法所得细胞差异性比较
各组消化所得单细胞数量见图2 所示:不论胰蛋白酶还是Ⅳ型胶原酶组,消化时间为30 min 所得单细胞数量均明显高于15 min,消化更为完全,Ⅳ型胶原酶在各时间段消化所得单细胞数均高于胰蛋白酶,而15 min+15 min的消化方式相对直接消化30 min所得细胞总数显著增加(P<0.001),所得死亡细胞数明显减少(P<0.05),并且单细胞悬液中成团细胞数显著降低(P<0.01),为后续CD45+细胞的进一步分选提供了足够的细胞数量和质量保障。

图2 不同消化方式所得细胞状态比较Figure 2 Comparison of cell states obtained by different digestion methods
2.3 CD45+单细胞分离
经磁珠分选后所得CD45+单细胞悬液细胞形态完整,但混有很多体积较大细胞碎片和细胞团(见图3A),通过300 rpm/min离心1 min弃沉淀取上清液能够有效去除较大的组织碎片和成团细胞(见图3B),可防止测序过程中对仪器设备造成损害,和提高测序结果的准确性,最终所得单细胞悬液各项指标均符合单细胞测序标准(见表1)。

表1 磁珠分选细胞后细胞状态Table 1 Cell status after magnetic beads sorting

图3 CD45+单细胞悬液细胞状态Figure 3 Cell state of CD45+single cell
2.4 单细胞测序结果
线粒体基因表达量通常反应了细胞状态的好坏,由单细胞测序报告我们发现各组测序所用细胞的线粒体基因表达量大部分处于5%左右(见图4A)。将各组用于测序细胞共计85 924 个统一纳入分析,结果显示CD45+细胞为81 254 个,阳性率为94.56%(见图4B,绿色即为CD+细胞),并且其中的T 细胞、B 细胞、巨噬细胞等重要免疫细胞均能够根据细胞的种类分为明显的亚群,对后续单细胞结果分析有利(见图4C)。
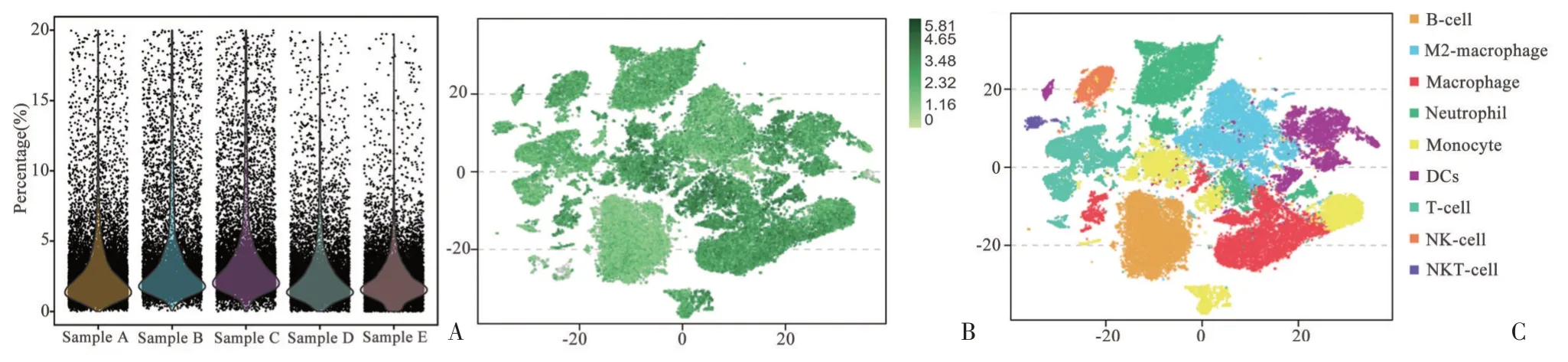
图4 CD45+单细胞悬液细胞状态Figure 4 Cell state of CD45+single cell
3 讨论
近年来肾脏疾病已成为全球公共卫生问题,越来越受到研究者的关注,通过单细胞测序技术对其进行研究能够让我们更深层次了解肾脏中同类细胞不同亚群的分布及状态,作用过程及协作机制等,对挖掘新的研究思路和寻找新的药物作用靶点起到积极的作用[8-10]。FUJ[11]等构建糖尿病小鼠模型开展单细胞测序,比较模型组与正常组巨噬细胞细胞表型变化的差异性发现M1型巨噬细胞比例明显增加,揭示了M1型巨噬细胞在糖尿病炎症反应过程中起重要作用,此外研究者们还在急性肾损伤和纤维化、狼疮肾炎和肾脏肿瘤反应等方面开展单细胞测序,均揭示了重要的研究价值[12-15]。肾脏疾病发生过程中大多伴随着炎症反应的发生,通过单细胞测序研究CD45+细胞在疾病中遗传信息的变化情况有助于更深入了解其发病机理和开发新的药物治疗作用靶点[16-20]。单细胞悬液制备情况的好坏直接影响单细胞测序结果,由于肾脏结构复杂,消化存在一定难度,并且肾脏组织内所含细胞种类繁多,导致CD45+阳性细胞分离更为困难,目前尚无用于单细胞测序的肾脏单细胞悬液制备方法的报道,更无有效的肾脏CD45+细胞分离方法,因此在目前肾脏单细胞测序需求日益增加的情况下,摸索肾脏单细胞悬液制备方法尤为重要。
不同种酶对不同组织消化效果不尽相同,常用的组织消化酶有胰蛋白酶、胶原酶、弹力蛋白酶等[21-22],胰蛋白酶是目前使用最广泛的消化试剂,通过作用于与赖氨酸或精氨酸相连接的肽键,除去细胞间粘蛋白及糖蛋白,影响细胞骨架,从而使细胞分离[23-24],胶原酶通过水解细胞间质的脯氨酸使细胞离散,对于细胞间质胶原的消化作用很强,消化能力不受血清蛋白影响[25]。本研究发现在相同消化时间内Ⅳ型胶原酶对肾脏组织的消化效率优于胰蛋白酶,肾脏组织结构的复杂性,胰蛋白酶单一的消化机理是其消化能力不如Ⅳ型胶原酶的重要原因,所以选用Ⅳ型胶原酶对肾脏进行消化有利于提高所得单细胞数量及细胞状态。消化前将剁碎后的肾脏组织用PBS洗涤再低速离心弃掉上清液能除去大量红细胞,从而减少细胞碎片的产生。采用15 min+15 min 的消化方式能够减少消化酶对已经消化下来的细胞的作用时间,对细胞状态起保护作用,并且能够减少细胞碎片的产生。在组织消化过程中难免有细胞死亡,死亡细胞裂解释放的DNA 具有较强粘附性,是导致细胞聚集成团的主要原因,通过在消化液中加入脱氧核糖核酸酶Ⅰ后能够有效减少单细胞悬液细胞成团现象[26-27]。消化完成后用PBS 重悬洗涤细胞沉淀两次能够有效去除消化产生的组织、细胞碎片,有助于排除对单细胞测序结果的影响。
在组织消化或细胞分离过程中细胞常因外界刺激导致出现应急反应和线粒体基因的大量释放,线粒体基因表达量常用于评价细胞状态好坏的标准,一般线粒体基因表达量低于20% 的细胞可视为正常细胞[28-30]。所以单细胞悬液的制备要求快速准确,以避免RNA 降解或细胞相关基因活化导致测序结果出现偏差[31],尽可能缩短单细胞悬液制备时间尤为重要。免疫磁珠分选法是一种通过磁珠从细胞群中分离目的细胞的技术,通过抗体、生物素或亲和素与目标细胞上特定的细胞表面蛋白结合后在磁力的作用下起到将目标细胞与非目标细胞分离的目的[32-34],分离完成后通过300 rpm/min 离心1min 弃掉沉淀取上清能够有效去掉较大的细胞团,能够有效降低细胞成团率。该方法相对流式分选法操作更为简单,所需时间短,并且能够避免仪器对细胞造成的损伤。由单细胞测序结果可以看出磁珠分离法分离所得CD45+细胞纯度高且细胞状态好,各重要免疫细胞亚群分布明显,说明磁珠分离法不仅操作简单,并且能够有利于保护细胞状态,分离所得细胞适用于单细胞测序。
4 结论
在相同消化时间条件下,Ⅳ型胶原酶相对胰蛋白酶消化所得细胞悬液中细胞数量更多,细胞存活率更高,更适合应用于肾脏组织消化,所得细胞悬液通过磁珠分离法所得CD45+单细胞悬液各项指标均符合单细胞测序要求,表明本肾脏单细胞悬液制备方法适用于单细胞测序。
