基于肿瘤微环境设计的高分子前药的研究进展
2023-05-25徐玉怡王东凯
徐玉怡,王东凯
(沈阳药科大学 药学院,辽宁 沈阳 110016)
随着人们对肿瘤病理特征的不断了解,对于抗肿瘤药物的研究已从传统的靶向到肿瘤细胞的单一受体发展到根据肿瘤组织微环境的特点进行药物的设计[1]。前药作为一个经典的药物化学理论,于 1958 年由 Albert 提出[2]。抗肿瘤前药是指对母药分子进行结构修饰,修饰后的药物进入体内到达肿瘤部位后,由于肿瘤组织的特殊微环境会使药物发生裂解,释放出母药,杀死肿瘤细胞[3]。与传统靶向药物相比,前药能够提高生物利用度,使母药具有更好的靶向性,减少对正常组织或细胞的不良反应。因此,近年来被广泛用于抗肿瘤药物的研究。
高分子前药与传统的小分子前药的设计理念不同。高分子前药策略是通过特异性连接臂将高分子载体和活性药物偶联,并通过调控其组装行为和靶部位药物释放性能来构建纳米级前药[4]。高分子前药不仅可以通过响应肿瘤部位的微环境释药,还可以通过肿瘤部位的高通透性和强滞留效应(EPR 效应)提高药物在肿瘤组织的富集能力[5],避免了小分子药物选择性差、多药耐药等问题[6-7],可显著提高临床治疗效果。
1 基于肿瘤微环境的高分子前药
肿瘤微环境是肿瘤发生、肿瘤细胞繁殖的地方,主要由肿瘤细胞、内皮细胞、成纤维细胞、免疫细胞、血管淋巴管及其代谢产物组成[8]。肿瘤微环境有如下几个显著特点:pH 值低、缺氧、谷胱甘肽(GSH)浓度高、活性氧(ROS)水平高、酶活性独特、三磷酸腺苷(ATP)含量高等[9-10]。因此,可以通过肿瘤组织特殊的微环境来设计靶向抗肿瘤药物。
1.1 酸敏感性高分子前药
由于肿瘤组织的增殖和代谢异常快速,肿瘤细胞会通过糖酵解途径产生大量乳酸,使得乳酸水平显著提高,使环境酸化,pH 值一般保持在 6.2~6.9 之间[11]。因此,可以根据肿瘤组织和正常组织 pH 的差异设计 pH 敏感性不同的前药。除此之外,还可以根据肿瘤细胞溶酶体的特殊酸化环境(pH=4.5~6.0)进行 pH 响应型载体的设计[12]。
酰胺、酯键等结构在酸性条件下易水解。因此,这些结构常用于 pH 敏感性药物的设计。5-氟尿嘧啶(5-FU)及其衍生物是一种广谱的抗肿瘤药物,在临床上被广泛使用。其可通过多种途径干扰肿瘤细胞的核酸代谢、抑制脱氧胸苷酸合成酶的作用、抑制 DNA 的合成,对各期肿瘤细胞都可以发挥作用。但由于存在首过效应、临床不良反应等,使其抗肿瘤效果受到限制。李大鹏[13]通过酰胺反应将 5-氟尿嘧啶衍生物(5-FUA)和高分子聚合物聚原酸酯相连,制成 P-FUA 聚合物前药(见图 1),并和阿霉素连用制成前药胶束。实验结果显示,pH 为 6.5 的条件下,酸敏感的酰胺断裂造成粒子体积增加,在很大程度上增加了药物在肿瘤处的富集能力;而 pH 在 5.5时可快速崩解,有利于药物快速释放达到有效浓度杀死肿瘤细胞。
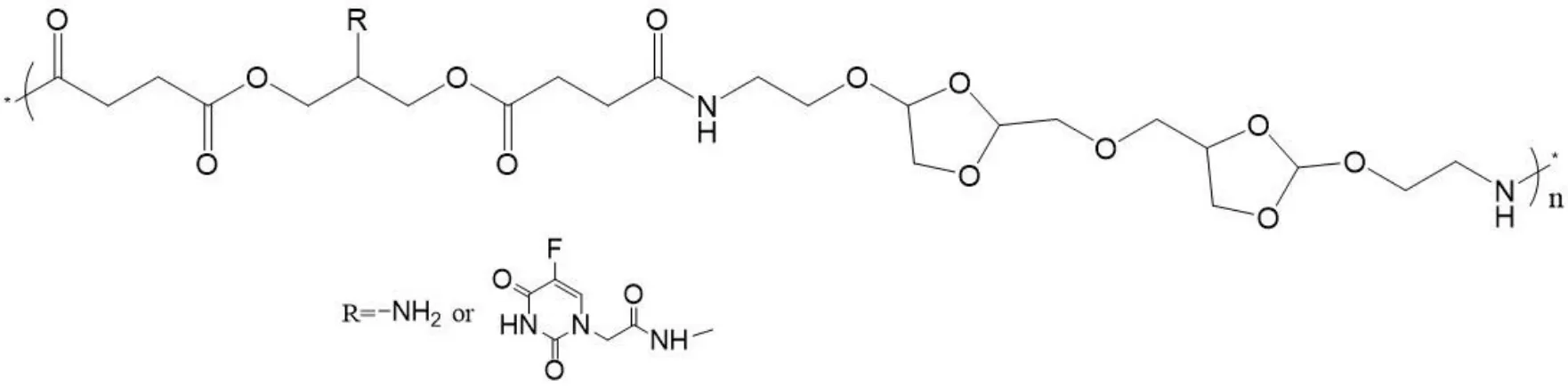
Fig.1 The structure of polymer prodrug P-FUA图1 高分子前药 P-FUA
因亚胺结构在酸性条件下也能够水解,所以,近年来也被应用于抗肿瘤药物的研究。阿霉素(Doxorubicin,DOX)是一种蒽环类抗肿瘤药物,具有强大的抗肿瘤活性。但因有严重的心脏毒性、肾毒性[14]等不良反应,使其在临床上仅被用作二线药物[8]。Kalva 等[15]通过亚胺键将 DOX 和聚合物 TPEPC-g-PEG 相连得到聚合物前药 TPEPC-g-PEG/DOX(见图 2),其中 DOX 与pH响应的亚胺键共价连接。实验结果表明,在酸性 pH 5.0 条件下,高分子前药通过酸裂解希夫碱键释放 DOX 的速度比生理 pH 7.4 条件下快。此外,发现其能有效抑制癌细胞的生长,对癌症治疗有效。Li 等[16]通过酸性不稳定亚胺键将 DOX 连接到联氨功能化交联碳量子点(CQD)、聚乙二醇双丙烯酸酯(PEGBA)和肼(N2H4)形成的高分子(C-CQDPEGBA-Hy)上,从而设计出了一种新型的抗肿瘤纳米药物。实验结果表明,在体外药物释放过程中,pH 值触发的药物释放效果良好,有望用于通过 pH 触发的 DOX 释放的癌症治疗中。
此外,因脲、原酸酯等结构在酸性条件下会发生断裂,所以,也可用于 pH 响应前药的设计。
1.2 还原响应性高分子前药
谷胱甘肽(Glutathione,GSH)是一种由L-谷氨酸、半胱氨酸和甘氨酸组成的含硫三肽[8],其在肿瘤细胞中的浓度高于血浆和细胞外基质中的浓度[17-19]。因此,可以通过肿瘤细胞与正常细胞GSH 浓度的不同进行前药的设计。
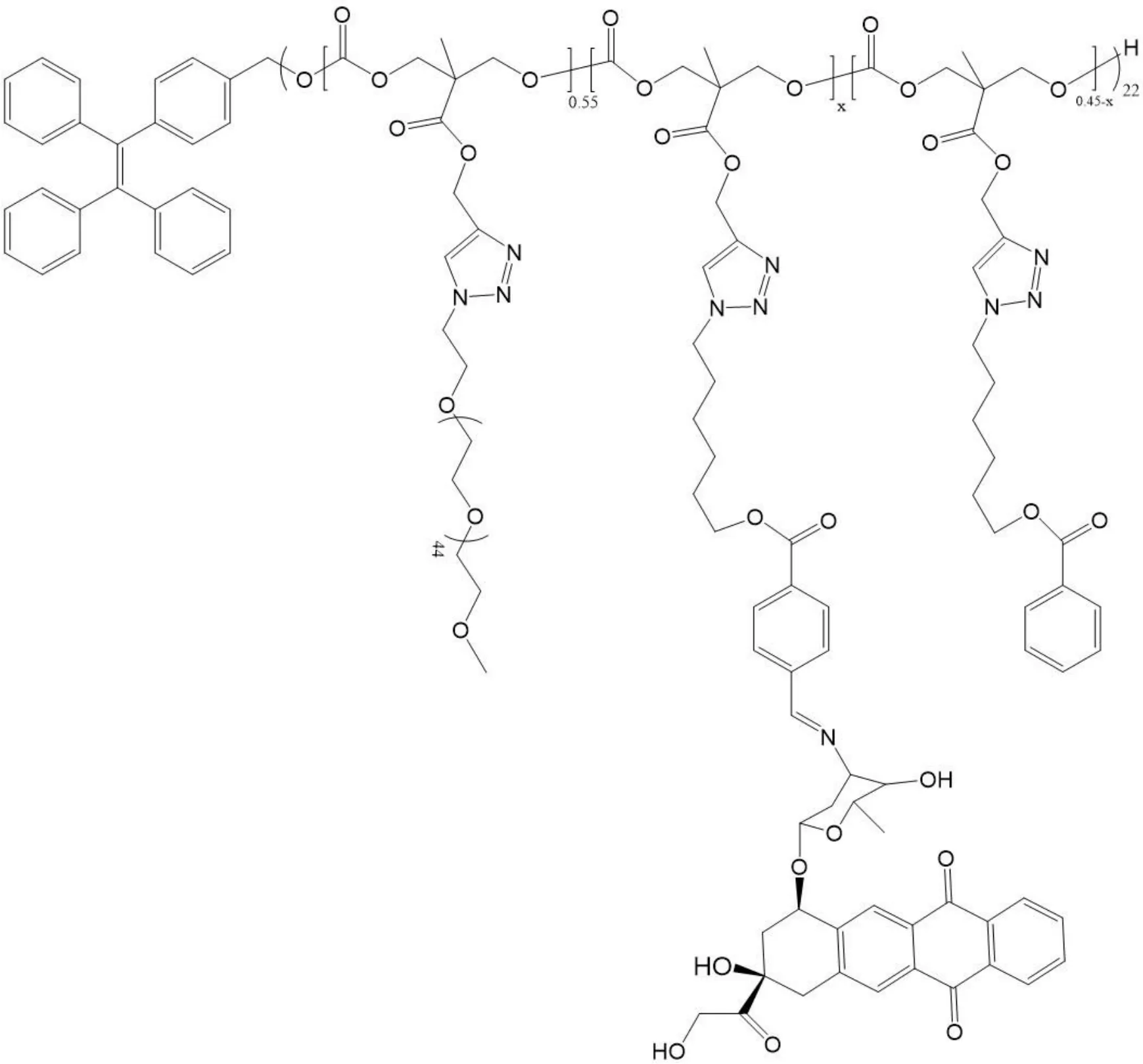
Fig.2 The structure of polymer prodrug TPEPC-g-PEG/DOX图2 高分子前药 TPEPC-g-PEG/DOX
因二硫键易被 GSH 还原,所以常被用于前药的设计。顺铂是目前应用最广泛的铂基抗癌化疗药物之一。然而,因其低溶解度、严重的副作用和渐趋严重的耐药性限制了其在临床的进一步应用。Jia 等[20]通过二硫键将顺铂(Pt)和高分子支化聚乙烯亚胺(BPEI)偶联,形成了 BPEISS-Pt 聚合物,并用透明质酸(HA)通过静电吸附作用对其表面进行修饰,构成了一种纳米靶向系统,可增强对肿瘤细胞高表达的 CD44 受体的靶向作用。实验结果表明,体外实验中该给药系统具有实现肿瘤特异性靶向和快速细胞内药物释放的潜力,可提高治疗效果、减少副作用。通过体内实验,结果表明阳性肿瘤细胞明显增加,该给药系统能有效诱导肿瘤细胞凋亡。除了通过二硫键将活性药物和聚合物直接相连外,其还可将含有二硫键的化合物和活性药物、聚合物相连。Lei 等[21]通过可逆加成-断裂(RAFT)聚合法合成了阿霉素高分子前药。先将含有二硫键的功能化的三醋酸纤维素(Cellulose triacetate,CTA)CTA-SS-CTA 与聚马来酸(HPMA)反应,生成polyHPMA-SS-polyHPMA 聚合物,再将该聚合物同合成的功能化单体(MA-SS-DOX)反应,最终制备了一种二硫键桥联的聚合物前药 polyDOX-block-(polyHPMA-SS-polyHPMA)-blockpolyDOX(见图 3)。该前药可自组装成刺激响应性纳米颗粒,并用于封装卟啉家族的 NPs (Ce6)。实验结果表明,该药物可以抑制 4T1 小鼠乳腺癌细胞的生长,在携带 4T1 小鼠乳腺肿瘤的BALB/c 小鼠体内具有显著的抗肿瘤效果,该聚合物前药可以作为治疗乳腺癌的高效纳米药物。

Fig.3 The structure of polymer prodrug polyDOX-block-(polyHPMA-SS-polyHPMA)-block-polyDOX图3 高分子前药 polyDOX-block-(polyHPMA-SS-polyHPMA)-block-polyDOX
除二硫键外,还可通过 GSH 的加成或取代反应[22-23]进行前药的设计。Wang 等[24]利用酸和谷胱甘肽(GSH)与碳碳双键之间的 Michael 加成反应,设计了 GSH 双响应的高分子前药。通过逆向增强-原子转移自由基聚合(DE-ATRP)[25]将酸响应的单体二 (2-丙烯酰氧基乙氧基)-(4-甲氧基苯基) 甲烷(ACD)接到大分子引发剂——溴代聚乙二醇单甲醚(PEG2KBr)上,合成了两亲性聚合物 PEG-b-PACDs。其中 ACD 两端都是双键,可以与 GSH 发生加成反应,进而释放药物。实验结果表明,当该聚合物负载光敏剂二氢卟吩 e6 自组装成胶束进入肿瘤细胞后,可通过 GSH 和酸响应释放药物,有助于光动力治疗,为肿瘤治疗提供了新思路,具有广阔的应用前景。
此外,2,4-二硝基苯磺酰基、巯基等基团也可以与 GSH 发生反应,也可用于 GSH 响应型抗肿瘤药物的研究。
1.3 ROS 激活性高分子前药
活性氧(Reactive oxygen species,ROS)是一系列具有化学活性的含氧分子,如过氧化氢(H2O2)、超氧(O2-)、羟基自由基(·OH)等,在细胞信号转导中起着不可或缺的生理作用[26]。肿瘤细胞中的活性氧(ROS)水平远高于正常细胞,且 ROS 触发的药物释放已证明是有效的癌症治疗方法[27-30]。因此,可以利用这一特点来设计前药,选择性的靶向到肿瘤细胞。
硼酸盐,包括硼酸酯和硼酸,可以与 H2O2反应,是用于设计 ROS 反应的重要化学官能团[31-34]。Dong 等[35]通过苄基硼酯将 PEG 与紫杉醇(Paclitaxel,PTX)连接,开发了一种新型 ROS响应性前药 PEG-B-PTX(见图 4)。实验结果表明,PEG-B-PTX 前药载药量高,经 ROS 氧化后会在肿瘤部位快速释放 PTX,比无反应的 PEG-H-PTX 前药和未经修饰的 PTX 表现出更强的靶向性和抗肿瘤活性。此外,与 PTX 相比,PEG-B-PTX 前药表现出更低的全身毒性。

Fig.4 The structure of polymer prodrug PEG-B-PTX图4 高分子前药 PEG-B-PTX
硫缩酮(Thioketal,TK)也能与 ROS 反应,当 TK 暴露于 ROS 时,TK 会被裂解成含有硫醇的基团[36]。马法兰(MelpHalan,MpH)是临床上一款对恶性胶质瘤有很好治疗作用的药物,但其较差的水溶性和选择性是其在临床应用中存在的问题。Oddone 等[37]通过 TK 基团将MpH 和甲氧基聚乙二醇(Methoxy Polyethylene Glycol,mPEG)相连,合成了一种 ROS 响应性前药mPEG-TK-MpH(见图 5)。其既有亲水部分 mPEG,又有疏水部分 MpH,前药可以进行自组装,同时改善了 MpH 水溶性差的问题。实验结果表明,TK 基团在 ROS 高水平时断裂,相比于非 ROS 响应的前药,表现出更高的抗癌活性和细胞毒性,实现了 MpH 的精确释放。不仅能够改善药物的溶解度和介导选择性 ROS 触发的药物释放,还可以改善细胞渗透性差的高细胞毒性药物的转运。
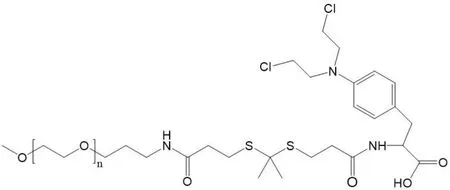
Fig.5 The structure of polymer prodrug mPEG-TK-MpH图5 高分子前药 mPEG-TK-MpH
2 总结
尽管从前药原理提出至今已有几十年,但随着人们对肿瘤机制的不断研究,设计前药的原理也随之完善。母药在肿瘤部位的释放从依靠肿瘤组织的水解酶,发展到可以依靠肿瘤部位特殊的微环境或特异性酶。这为设计抗肿瘤前药提供了新思路。高分子前药相比于传统小分子前药,具有更强的滞留能力。同时,还可以改善小分子前药选择性差、易被清除的问题。因此,在肿瘤治疗中有着较广泛的应用。此外,近几年还有高分子前药联合其他治疗,如光动力疗法等,也取得了很大的进步。相信随着科研工作者的不断努力与探索,未来会有更多更好的抗肿瘤前药上市,造福患者、造福人类。
