明胶修饰的 β-胡萝卜素亚微乳的制备与处方优化
2023-05-25陈稞垒熊婷婷朱柯武
徐 歌,敖 莎,陈稞垒,熊婷婷,朱柯武,骆 翔
(绍兴文理学院,浙江 绍兴,312000)
β-胡萝卜素(β-Carotene)(结构式见图 1)是一种天然果蔬中大量含有的有色天然化合物,可使水果和蔬菜呈现出黄色和橘色等颜色,人体无法自主合成。β-胡萝卜素的分子式为 C40H56,相对分子质量为 536.88,在水中几乎不溶,在乙醇和乙醚等有机溶剂中微溶,易溶于异丙醇、氯仿以及各类油中[1]。
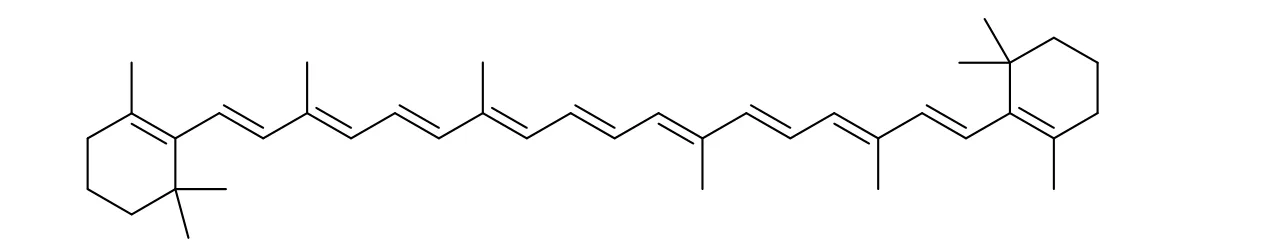
Fig.1 The structure of β-carotene图1 β-胡萝卜素化学结构式
β-胡萝卜素经人体吸收后可在酶的作用下转变为对人体有益的维生素 A。因此,β-胡萝卜素也被称为“前维生素 A”(Provitamin A)。β-胡萝卜素具有良好的维生素 A 源活性,具有抗炎[2]、抗肿瘤[3]、预防心脏病[4]、提高机体免疫能力[5]、抗氧化[6]等重要作用。并且,已被联合国粮农组织(FAO)和世界卫生组织(WHO)联合食品法规委员会认证为安全可食用的食品添加剂。鉴于类胡萝卜素中β-胡萝卜素在体内转化率较高,且不会因摄食过量β-胡萝卜素而造成维生素 A人体蓄积中毒。因此,往往选择β-胡萝卜素用以补充维生素 A。
尽管β-胡萝卜素的效果优异,但水溶性差且生物利用度低,在氧气和光照充足、高温的条件下易发生化学降解[7-8]。因此,对β-胡萝卜素进行分离纯化,并且选择合适的载体材料将其制备成纳米乳液对提高β-胡萝卜素生物利用度至关重要。人体食用含有β-胡萝卜素的食物,进入小肠后通过被动扩散被小肠上皮细胞细胞膜吸收[9-10],在进入淋巴系统和循环系统之前与乳糜微粒结合,根据这一机制,将β-胡萝卜素制成亚微乳,使其以小液滴的形式精密地分散于水相中稳定存在,实现药物在体内循环时间的延长和生物利用度的提高[11]。亚微乳是一种新型纳米级的药物递送系统,乳化剂和助乳化剂的存在使得制剂中的乳滴可以稳定地存在于该体系中[12]。亚微乳具有提高药物的疗效[13]、增加药物的生物利用度[14]、提高亲脂性药物稳定性[15]等优势。
明胶是一种人体亲和性极高的生物可降解高分子材料,是天然的乳化剂和稳定剂,无毒无害,无免疫原性,且具有良好的药物缓释作用,被广泛用于食品和医疗等邻域[16]。因此,选用明胶作为亚微乳的乳化剂可以通过缓释作用提高药物稳定性、降低毒副作用[17]。
本实验制备β-胡萝卜素亚微乳,使用 Design-Expert 11 软件,用星点设计-响应面法优化β-胡萝卜素亚微乳处方。此方法的优点在于应用 3D 响应面和数学模型得出的轮廓图可确定最佳条件,采用星点设计-响应面优化法,可减少多余的实验处方,提高实验精度,使得理论值与实验值更加接近等。近年来,此方法在药物制剂领域应用十分广泛[18]。
1 材料和方法
1.1 药物与试剂
β-胡萝卜素(β-Carotene,天津希恩思生化科技有限公司,纯度 ≥ 98%),磷酸二氢钠(NaH2PO4,国药集团化学试剂有限公司,批号:20190917),磷酸氢二钠(Na2HPO4,国药集团化学试剂有限公司,批号:20180725),无水乙醇(C2H6O,上海麦克林生化科技有限公司,批号:E809061),异丙醇(C3H8O,上海麦克林生化科技有限公司,批号:I811925),大豆油(益海嘉里金龙鱼粮油食品股份有限公司),大豆卵磷脂(SPC-98A,艾伟拓(上海)医药科技有限公司,纯度 98%),明胶(罗赛洛(广东)明胶有限公司,平均分子量为 35 kDa),娃哈哈纯净水(杭州娃哈哈集团有限公司),其余试剂均为分析纯。
1.2 仪器
JY92-IIN 型超声波细胞粉碎机(宁波新芝生物科技股份有限公司),TG16-WS 台式高速离心机(湖南湘仪离心机仪器有限公司),DF-101S 集热式恒温加热磁力搅拌器(巩义英峪予华仪器厂),ME204E 分析天平(梅特勒-托利多仪器(上海)有限公司),UV-2600 紫外分光光度计(岛津企业管理(中国)有限公司),TopPette 微量移液器(北京大龙兴创实验仪器有限公司),透析袋(截留分子量 10 kDa,美国光谱医学公司),JEM-1011 透射电子显微镜(日本电子株式会社)。
1.3 β-胡萝卜素标准曲线的建立和专属性实验
1.3.1 对照品储备液的制备
精密移取 50 mL 大豆油至 100 mL 烧杯中,精密称取 0.500 gβ-胡萝卜素加入大豆油中。在该烧杯中加入磁力搅拌转子,在 37 ℃ 下搅拌约 3 h,充分溶解后,将溶有β-胡萝卜素的大豆油进行超速离心。用滴管吸取上清液,弃去底部未溶解的β-胡萝卜素,得到β-胡萝卜素-大豆油溶液。作为油相,用于β-胡萝卜素亚微乳的制备。
1.3.2 标准曲线的绘制
精密称取 5 mgβ-胡萝卜素对照品,置于西林瓶中,加异丙醇完全溶解,将其定量转移至量瓶中,用异丙醇定容至 10 mL,得到对照品储备液。分别精确吸取对照品储备液 100、150、200、250、300、350 μL 于 10 mL 量瓶中,用异丙醇定容至刻度,即得质量浓度为10、15、20、25、30、35 μg·mL-1的对照品溶液。使用紫外分光光度仪,将异丙醇作为本底,对β-胡萝卜素异丙醇溶液进行全波长扫描,确定其最大吸收波长。并且,以β-胡萝卜素吸光度(A)对β-胡萝卜素浓度(μg·mL-1)进行线性回归,绘制β-胡萝卜素标准曲线。
1.3.3 专属性实验
任选一组实验处方,按照处方量称取适量大豆油、磷脂作为油相。称取处方量的明胶,将其加入 pH 7.4 PBS(10 mmol·L-1)中加热搅拌,完全溶解作为水相。在 65 ℃ 磁力搅拌的条件下缓慢将水相注入油相中,转速约 20 r·min-1,搅拌 10 min,65 ℃ 下恒温孵育得到初乳。孵育完成后转移至 10 mL EP 管中。使用超声波细胞粉碎机,前后分别设置功率为 10% 2 min 和 20 %4 min 进行超声,得到空白亚微乳,用于专属性试验。精密吸取制得的空白乳 400 μL,将其置于 10 mL 量瓶中。用异丙醇定容至 10 mL,用紫外分光光度计对其进行全波长扫描。
1.4 处方设计优化
1.4.1β-胡萝卜素亚微乳的制备
在 Design-Expert 11 软件中限定各处方的范围[19-21],软件生成需要制备的处方。称取处方量的β-胡萝卜素-大豆油溶液、大豆油、磷脂作为油相。称取处方量的明胶,将其加入 pH 7.4 PBS(10 mmol·L-1)中加热搅拌,完全溶解作为水相。将两相分别置于磁力搅拌恒温水浴锅中,确保两相温度相同后,在磁力搅拌下,将水相缓缓加入到油相中。继续搅拌 10 min,65 ℃ 下恒温孵育得到初乳。孵育完成后转移至 10 mL EP 管中,EP 管外放置冰水浴防止制剂温度过高。用超声波细胞粉碎机,前后分别设置功率为 10 % 2 min 和 20 % 4 min 进行超声得到亚微乳[22-23],将超声完的β-胡萝卜素亚微乳装入西林瓶中。
1.4.2β-胡萝卜素亚微乳粒径测定[24]
采用 ZS90 马尔文激光粒度仪测定亚微乳粒径。精密移取各个处方的亚微乳 1 mL 于样品池中,加入适量的 pH 7.4 PBS(10 mmol·L-1)稀释到适宜浓度。打开样品池盖,放入测量池中(带▼符号面朝向测量者),开始测量,测量结束后进行结果分析。
1.4.3β-胡萝卜素亚微乳载药量测定
精密吸取各个处方的亚微乳 2 mL,过 0.8 μm 微孔滤膜,将未被装载在乳滴中的β-胡萝卜素除去。再精密吸取过微孔滤膜后的β-胡萝卜素亚微乳 400 μL,置于 5 mL 容量瓶中,用异丙醇定容至 5 mL,振摇后转移至 10 mL EP 管中,置于超声波清洗器中,在超声波的作用下使得β-胡萝卜素亚微乳中的β-胡萝卜素可以完全溶于异丙醇。完全溶解将 EP 管放入高速离心机中去除部分不溶明胶,在 5000 r·min-1的转速下离心 2 min,完成后小心取出样品。精密移取上清液后,以空白亚微乳的异丙醇溶液为本底,用紫外分光光度计在特征波长 451 nm 处测定上清液的吸光度,记录各个处方的吸光度。在测定吸光度时必须确保其吸光度数值落在标准曲线所测得的吸光度范围内,再根据标准曲线计算出不同处方制备的β-胡萝卜素亚微乳的载药量。
1.4.4β-胡萝卜素亚微乳的离心稳定性考察
分别精密吸取未过膜β-胡萝卜素亚微乳 1 mL 至 2.5 mL EP 管中。将 EP 管放入离心机中,在5000 r·min-1的转速下离心 2 min。离心完成后精密吸取上层液体 100 μL,将其装入另一 2.5 mL EP管中,再加入异丙醇定容。精密吸取未离心的β-胡萝卜素亚微乳 100 μL,做相同的处理用于检测。
使用紫外分光光度计,以空白亚微乳的异丙醇溶液作为本底,在特征波长451 nm 处测定各溶液吸光度。离心后上层的β-胡萝卜素亚微乳吸光度记为A1,将未经过离心的β-胡萝卜素亚微乳吸光度记为A0。分别将各组的A1和A0代入稳定常数(Ks)计算公式,计算各个处方β-胡萝卜素亚微乳的Ks。计算公式如下:
1.4.5 中心复合设计Central Composite Design(CCD)
本实验采用响应曲面实验设计中的中心复合设计(CCD),研究三个不同因素对确定响应个体效应和协同效应。通过描绘三个不同考察因素的响应效应面,运用软件对效应面进行分析,得到理论最优处方。该方法可以减少评估各参数的主要影响及其相互作用所需的实验次数。其特点是:2n阶乘运行,2n轴运行和 6 中心运行。在本例中,我们将其转化为 8 个阶乘点,6 个轴向点和 6 个中心重复。根据公式N=2n+2n+nc共得到 20 个处方。其中,n是因数的个数。Nc是中心点的数量(6 个重复)。自变量被编码为 +1 和 1,分别表示 8 个阶乘点的低和高水平。6 个轴向点位于 (±α,0,0),(0,±α,0),(0,0,±α),在中心 (0,0,0) 进行 6 个重复,检验实验误差和数据的重现性。其中α为轴向点到中心的距离。使设计可旋转,其值固定在 1.732。可旋转性α的值取决于实验中参数的个数,由公式:α=Np1/4决定。
响应预测结果采用最优二次模型确定,具体公式如下:
其中,Y为预测响应,b为线性效应,b0为偏移项,bi为平方效应,Xi是被考虑变量的编码值多项式模型的拟合质量,用相关系数(R²)表示。使用F值(Fisher 变异比)、概率值(Prob >F)进一步解释所使用模型的重要性和充分性。
本实验选择β-胡萝卜素亚微乳处方以大豆油为油相、明胶为乳化剂、磷脂为助乳化剂,通过对三种主要成分分别进行单因素考察,采用星点设计设计-效应面法分析得到理论最优处方。以大豆油用量(X1)、乳化剂用量(X2)和助乳化剂用量(X3)为自变量,以载药量 EE(Y1)、粒径Size(Y2)、离心稳定性Ks(Y3)作为响应值,用 Design-Expert 11 软件进行处方优化,根据理论最优处方进行再验证,最终确定最优处方。
1.4.6 方差分析和显著性检验
对载药量 EE(Y1)、粒径 Size(Y2)、离心稳定性 Ks(Y3)进行方差分析和显著性检验。通过P值(P-value)的大小可知该结果是否具有显著性差异。
1.4.7 残差的正态概率
如果残差的正态概率图中的数据分布为一条直线,就表明该组正态分布的结果较好。
1.4.8 效应面优化与预测
本实验运用 Design-Expert 11 软件建立数学模型,通过确定某一实验变量,控制另两组实验变量,利用软件绘制出三维效应面模型。
1.4.9 理论最优处方
运用 Design-Expert 11 软件,对各组数据进行分析,得到理论最优处方。
1.5 最优处方确证
根据 Design-Expert 11 软件预测的最优处方(No.1)配比,制备理论最优处方β-胡萝卜素亚微乳。并对其载药量 EE(Y1)、粒径 Size(Y2)、离心稳定性Ks(Y3)进行检测。
1.6 模拟体内药物释放
人体在补充β-胡萝卜素时,只有β-胡萝卜素具有良好的生物可利用性时才有益于健康,这只能通过消化来确定[25-27]。虽然利用人体来研究生物利用度是理想的,但由于成本高、个体间差异大以及实验耗时长,在体内进行本实验是不切实际的。因此,本实验选用体外释放模拟实验,其重复性高、实验耗时短并且可以同时检测大量样品,在药物制剂研究领域广泛应用。
配置释放介质为 pH 7.4 的磷酸氢二钠-磷酸二氢钠(10 mmol·L-1)和十二烷基硫酸钠缓冲液用于模拟人体体液环境。将制得的最优处方β-胡萝卜素亚微乳装入透析袋中作为实验组,将浓度相同的β-胡萝卜素-十二烷基硫酸钠水溶液装入相同的透析袋中作为对照组。将实验组和对照组透析袋同时分别放入盛有 100 mL 释放介质的烧杯中,置于水温恒定为 37 ℃ 的摇床中,模拟体内药物释放。在 0.5、1、2、4、6、16、24 h 时间段分别精密吸取 3 mL 释放溶液,同时补加 3 mL 磷酸氢二钠-磷酸二氢钠缓冲液。在特征波长 451 nm 处测定各个时刻的释放溶液的吸光度,得到时间-释放度曲线。
1.7 透射电镜观察
采用磷钨酸负染法制备β-胡萝卜素亚微乳透射电镜样品。样品稀释到合适浓度后,吸取 10 μL稀释后的样品滴于在覆盖碳膜的铜网上,滴加 pH 7.0 的 2%(w/ v)磷钨酸进行负染 1 min。用滤纸吸取剩余液体,于室温自然挥干后,置于透射电子显微镜下观察β-胡萝卜素亚微乳的形态并拍照。
2 结果
2.1 β-胡萝卜素标准曲线的建立和专属性实验
用紫外分光光度仪对β-胡萝卜素异丙醇溶液进行全波长扫描,在 特征波长 451 nm 处呈现特征吸收峰。再分别测定各溶液在特征波长 451 nm 处的吸光度。以吸光度(A)对浓度(C)进行线性回归:A=0.011 5C+0.097 4(R2=0.999 5)。表明在该浓度范围内,吸光度(A)与浓度(C)曲线呈良好的线性关系,能用于后续β-胡萝卜素含量的测定。
β-胡萝卜素亚微乳和空白乳剂在 200~800 nm 的波长下扫描测定的吸收光谱如图 2、图 3.结果表明,β-胡萝卜素异丙醇溶液在特征波长 451 nm 处呈现特征吸收峰。空白乳液中其他成分在β-胡萝卜素亚微乳全波长扫描中没有出现特征峰,不会影响后续β-胡萝卜素亚微乳的含量测定。
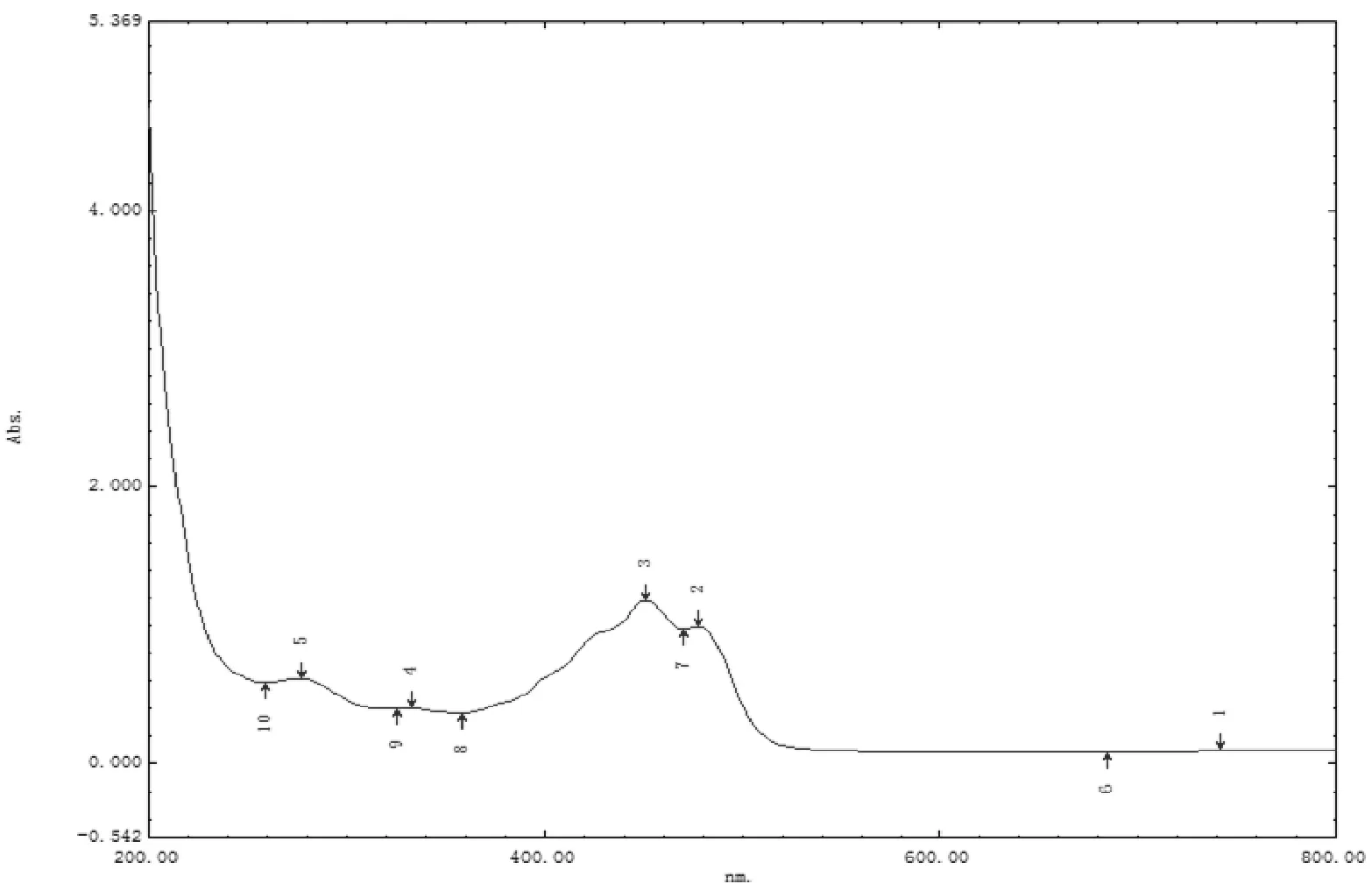
Fig.2 The full wavelength scan of β-Carotene图2 β-胡萝卜素全波长扫描图
Fig.3 The full wavelength scan of blank emulsion图3 空白乳剂全波长扫描图
2.2 处方设计优化的确定
2.2.1β-胡萝卜素亚微乳的离心稳定性考察
计算公式中的Ks值越小,代表该处方制得的β-胡萝卜素亚微乳中分散的乳滴在离心力作用下上浮或下沉的数量越少,即所制备的β-胡萝卜素亚微乳稳定性越高(见图 4)。

Fig.4 The photo of β-carotene sub-milk centrifugal layering图4 β-胡萝卜素亚微乳离心分层
2.2.2 中心复合设计(Central Composite Design,CCD)
本组实验考察因素的水平的代码值分别为 ±1.732、±1 和 0,实验数据与结果见表 1、表 2。
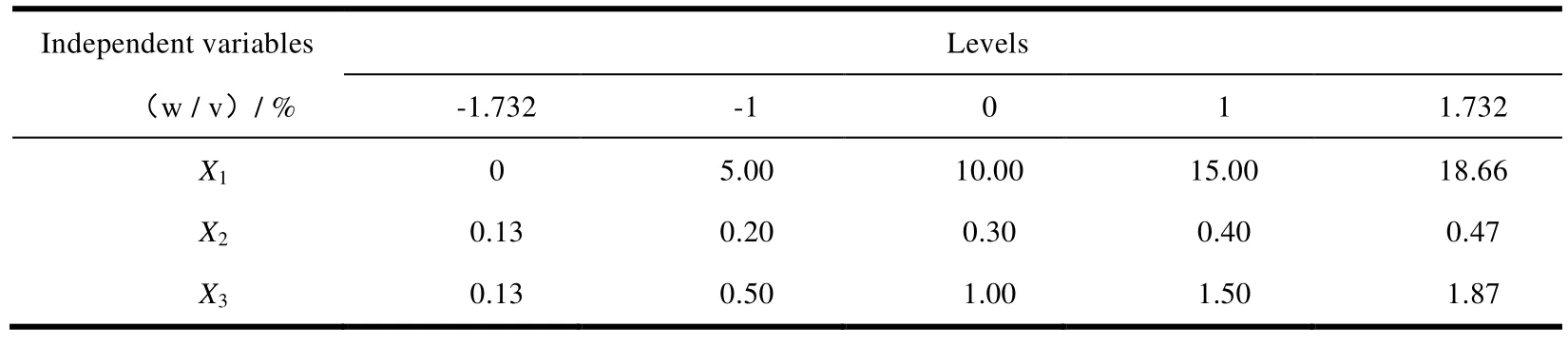
Table 1 Independent variables and their correspondent values in coded and physical form表1 各个因素水平的代码及实际操作物理量
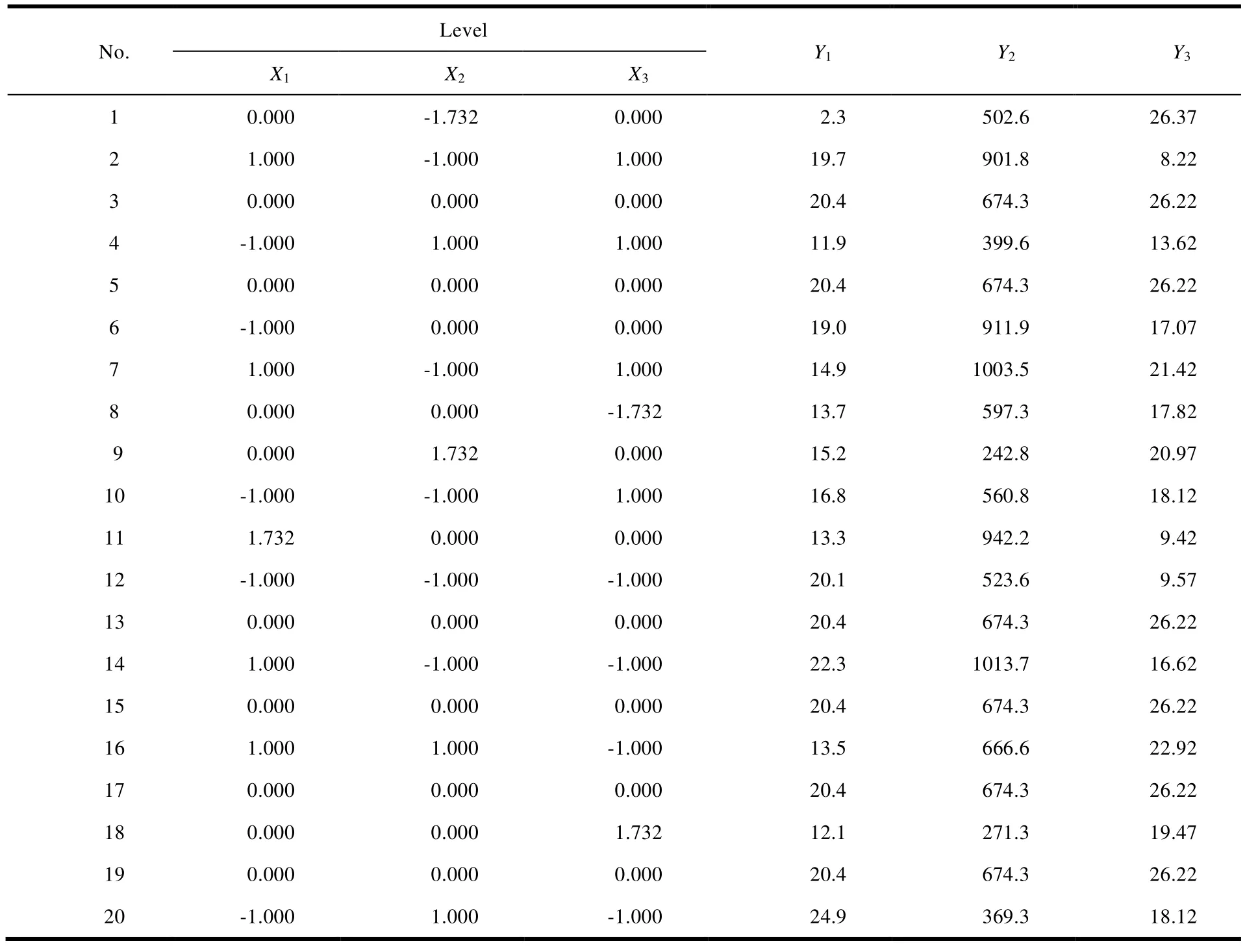
Table 2 Experimental arrangement and results of central composite design表2 中心复合设计实验设计及响应值结果
2.2.3 方差分析和显著性检验
载药量 EE(Y1),粒径 Size(Y2),离心稳定性Ks(Y3)的方差分析和显著性检验结果分别见表 3、表 4 和表 5,当P< 0.05 时即表示该变量具有显著性差异[28]。
对表 3、表 4 和表 5 进行分析,粒径 Size(Y2),离心稳定性 Ks(Y3)项的P< 0.05,均具有显著性差异,而载药量 EE(Y1)的P>0 .05,显著性差异不够明显。
回归方程如下:
Y1=20.137 5 -1.181 9X1-1.303 1X2-1.447 9X3-0.487 5X1X2-1.887 5X1X3+0.487 5X2X3-0.042 3X1² -2.845 0X2² -1.461 7X3² (R²=0.503 9,P< 0.000 1,F> 0.05)
Y3=26.109 5 -1.459 6X1-0.871 6X2-0.213 7X3-1.368 7X1X2-1.743 7X1X3-4.068 7X2X3-6.585 4X1² -0.847 7X2² -2.522 7X3² (R²=0.976 2,P< 0.000 1,F> 0.05)
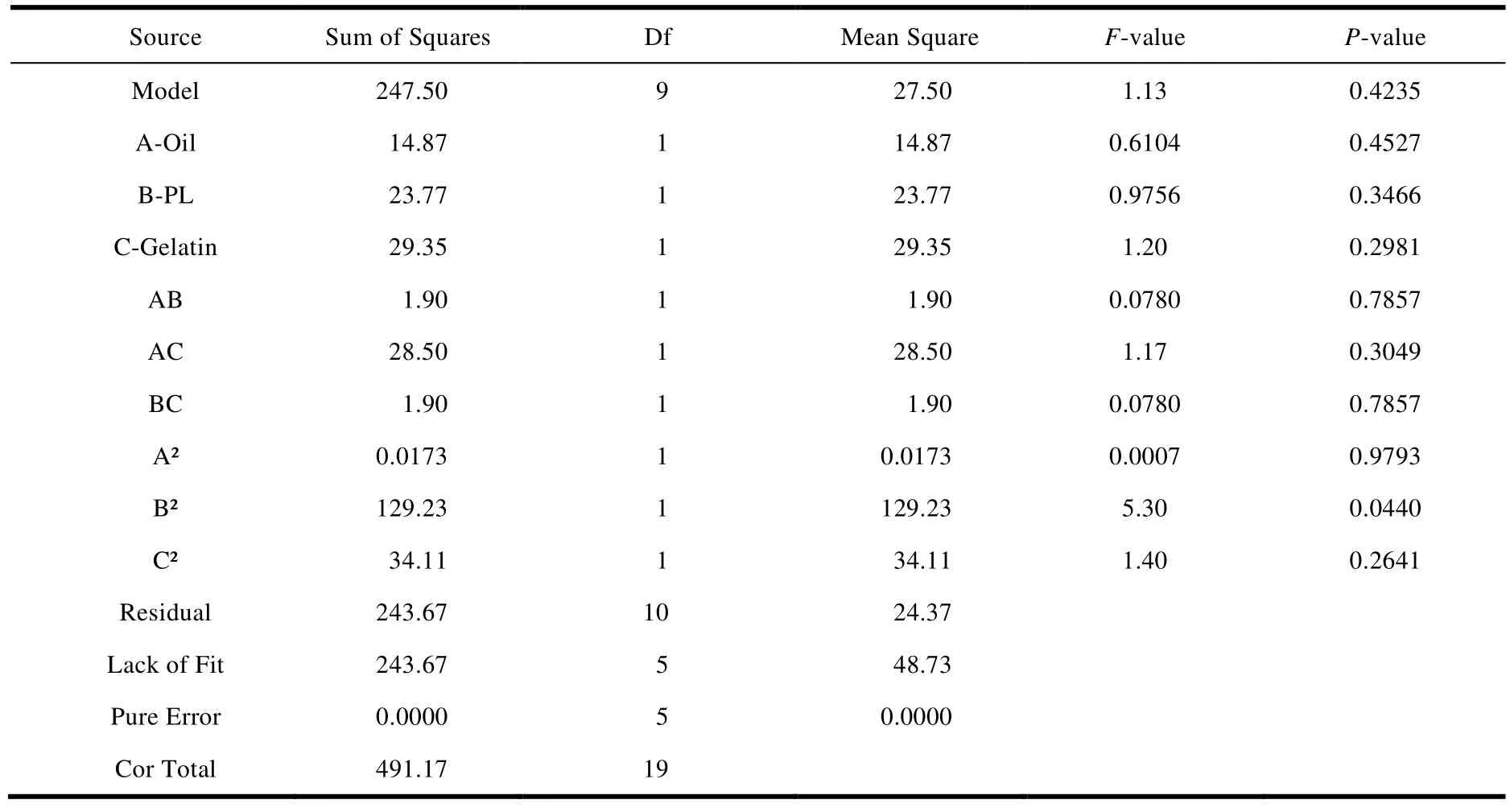
Table 3 ANOVA for response surface quadratic model of Y1表3 响应面模型对 Y1 的方差分析
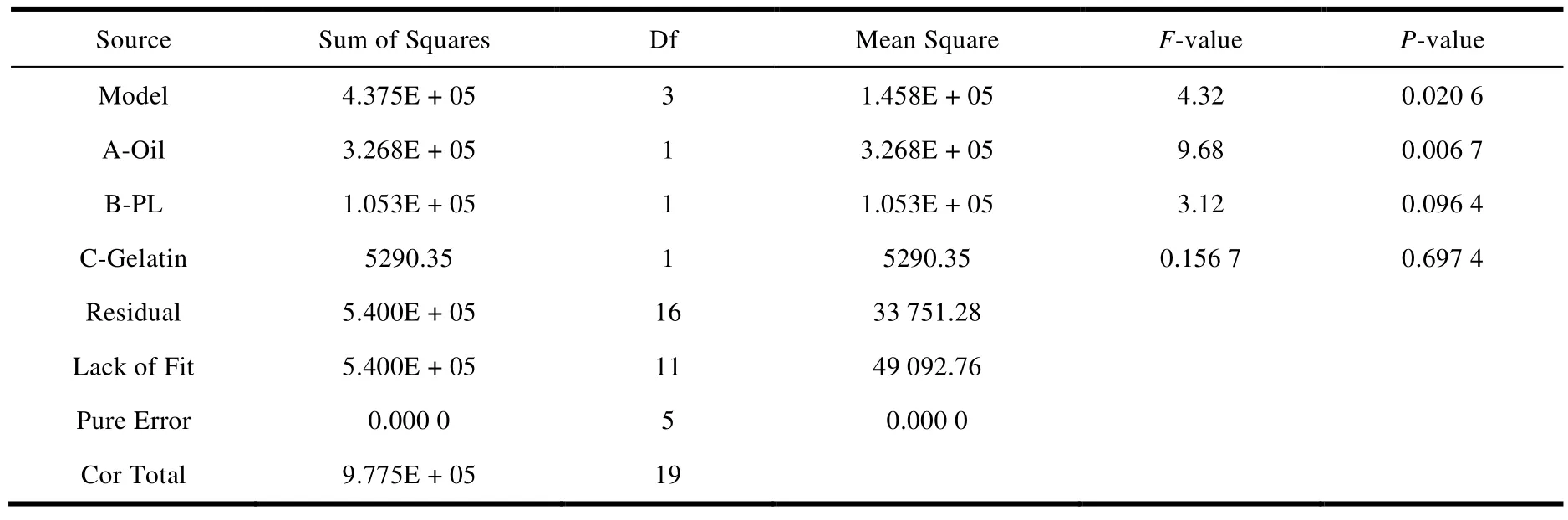
Table 4 ANOVA for response surface quadratic model of Y2表4 响应面模型对 Y2 的方差分析
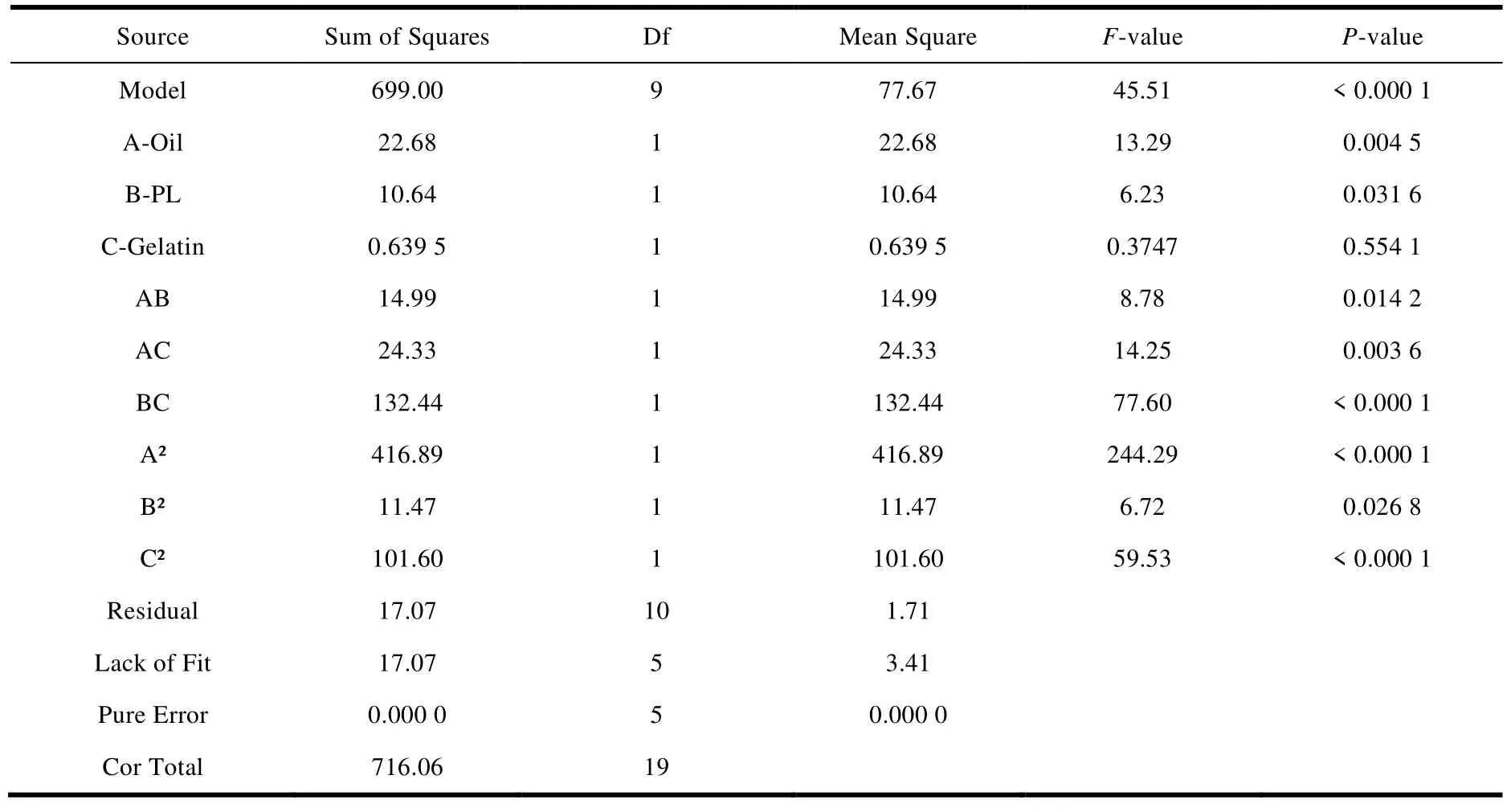
Table 5 ANOVA for response surface quadratic model of Y3表5 响应面模型对 Y3 的方差分析
2.2.4 残差的正态概率图
如图 5、图 6、图 7 所示,本次实验所得到载药量 EE(Y1)、粒径 Size(Y2)、离心稳定性Ks(Y3)三组数据的分布都接近一条直线,表明载药量 EE(Y1),粒径 Size(Y2),离心稳定性Ks(Y3)三组数据都符合正态分布。
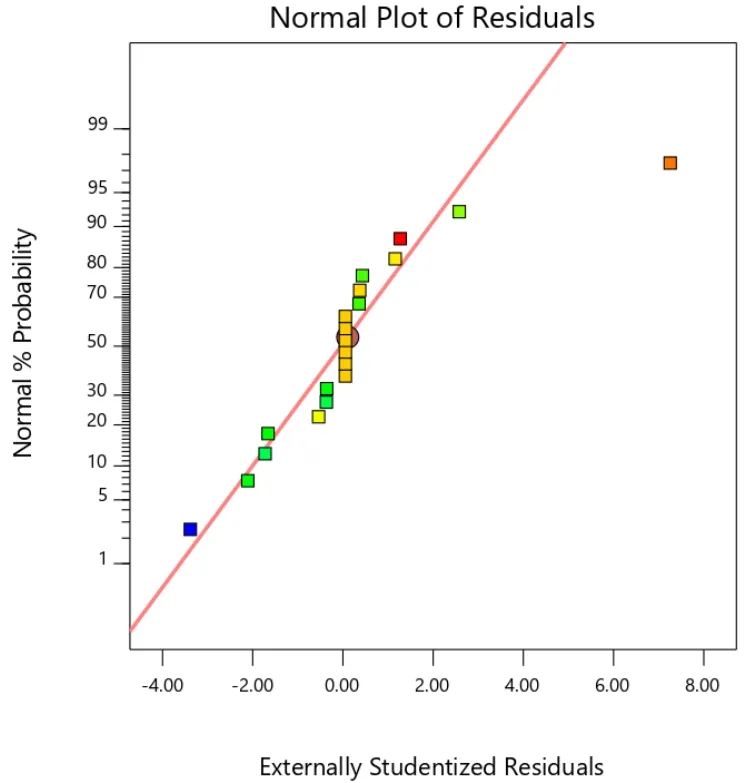
Fig.5 Residual normal probability diagram of effect surface: EE图5 载药量效应面的残差正态概率图

Fig.6 Residual normal probability diagram of effect surface: Size图6 粒径效应面的残差正态概率图
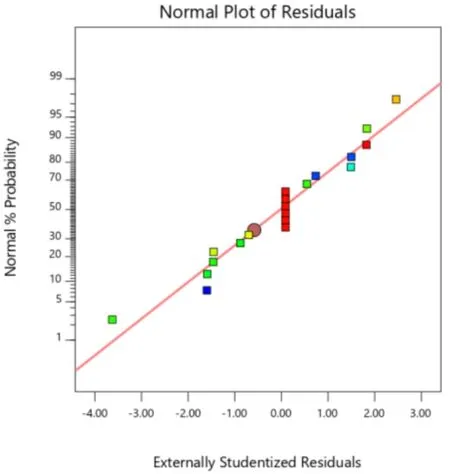
Fig.7 Residual normal probability diagram of effect surface: Ks图7 离心稳定性效应面的残差正态概率图
2.2.5 效应面优化与预测
在载药量 EE、粒径 Size、离心稳定性Ks的响应面图中,响应面的曲率越大或越小,表明该因素对响应值的影响越大。在等高线图中,等高线越大或越小,表明该因素对响应值的影响越大。具体结果见图 8~图 13。
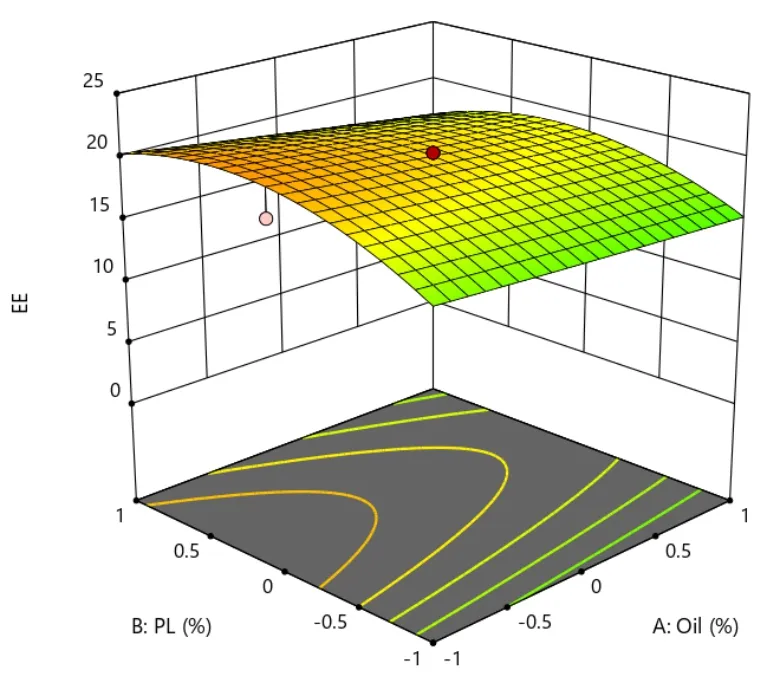
Fig.8 Predicted response surface of Y1 as a function of X1 and X2图8 Y1 对 X1 和 X2 用量的预测效应面
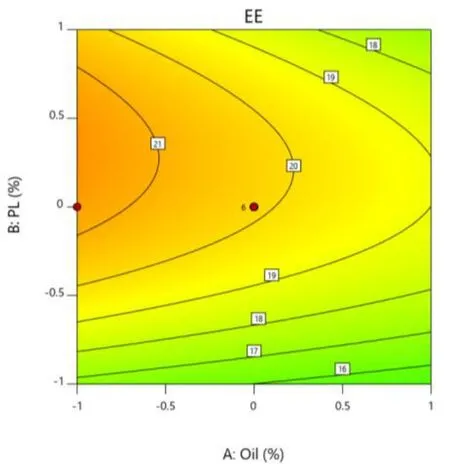
Fig.9 Contour map of Y1 as a function of X1 and X2图9 Y1 对 X1 和 X2 用量的等高线图
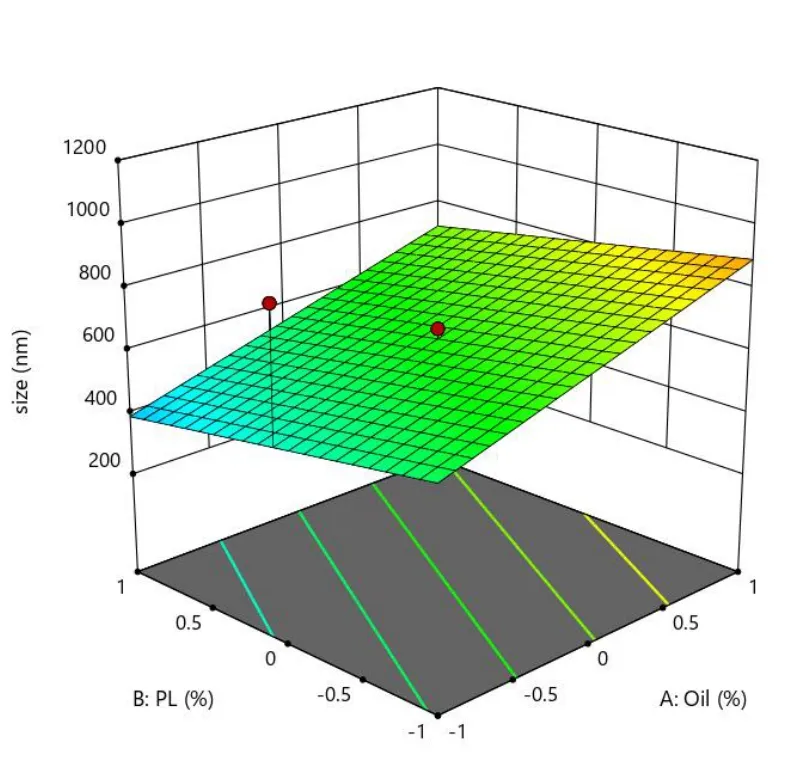
Fig.10 Predicted response surface of Y2 as a function of X1 and X2图10 Y2 对 X1 和 X2 用量的预测效应面
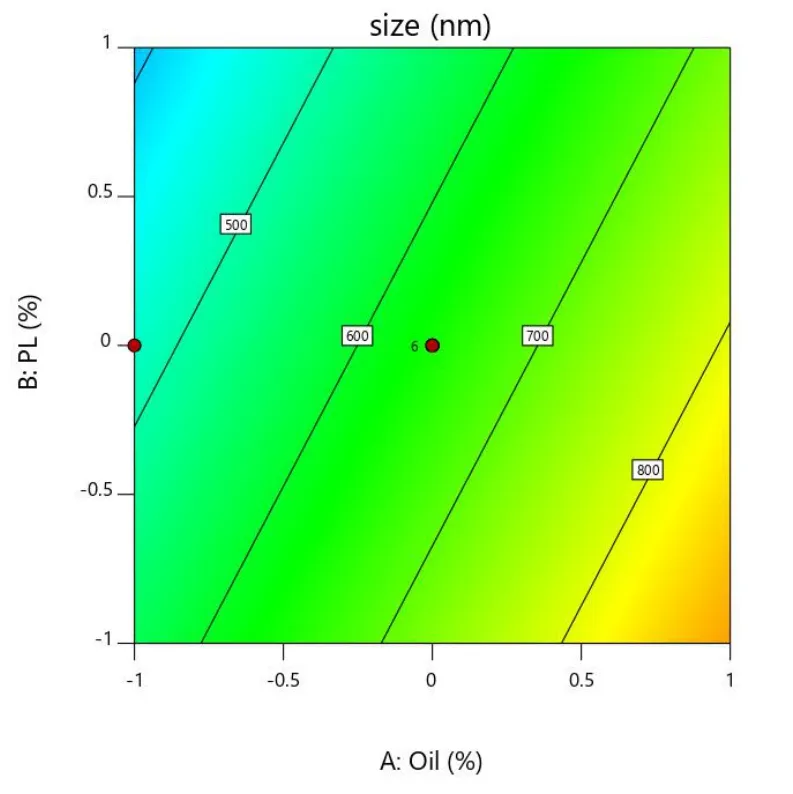
Fig.11 Contour map of Y2 as a function of X1 and X2图11 Y2 对 X1 和 X2 用量的等高线图
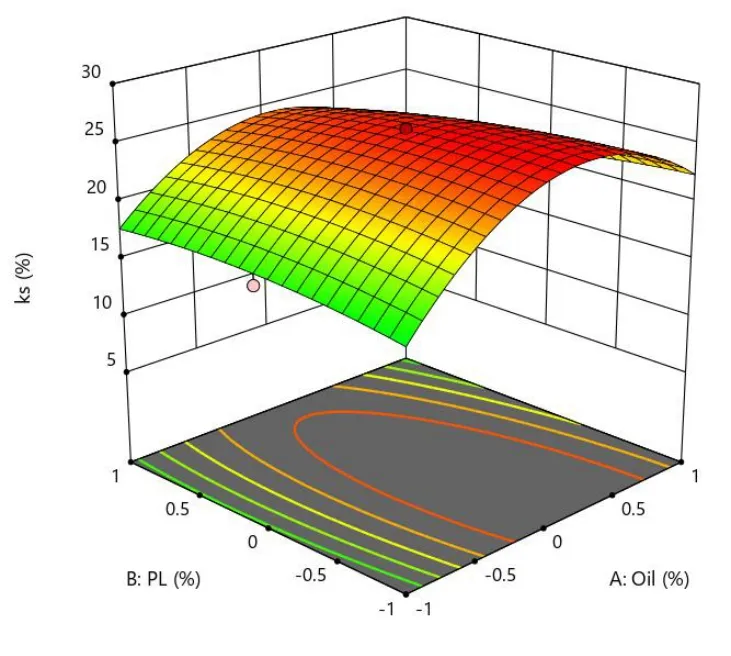
Fig.12 Predicted response surface of Y3 as a function of X1 and X2图12 Y3 对 X1 和 X2 用量的预测效应面
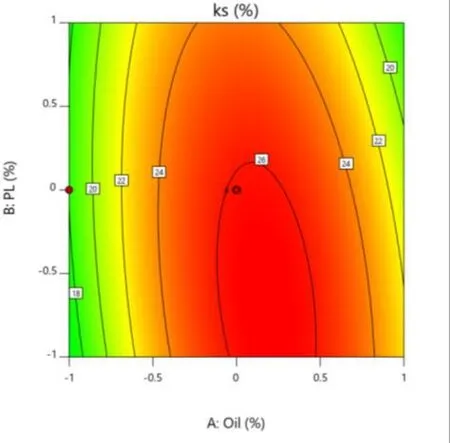
Fig.13 Contour map of Y3 as a function of X1 and X2图13 Y3 对 X1 和 X2 用量的等高线图
2.2.6 理论最优处方
如表 6、表 7 所示,对各组数据进行分析,结果表明软件预测的最优处方配比(No.1)为:5.00 % 的大豆油、0.729 % 的磷脂、0.200 % 的明胶。
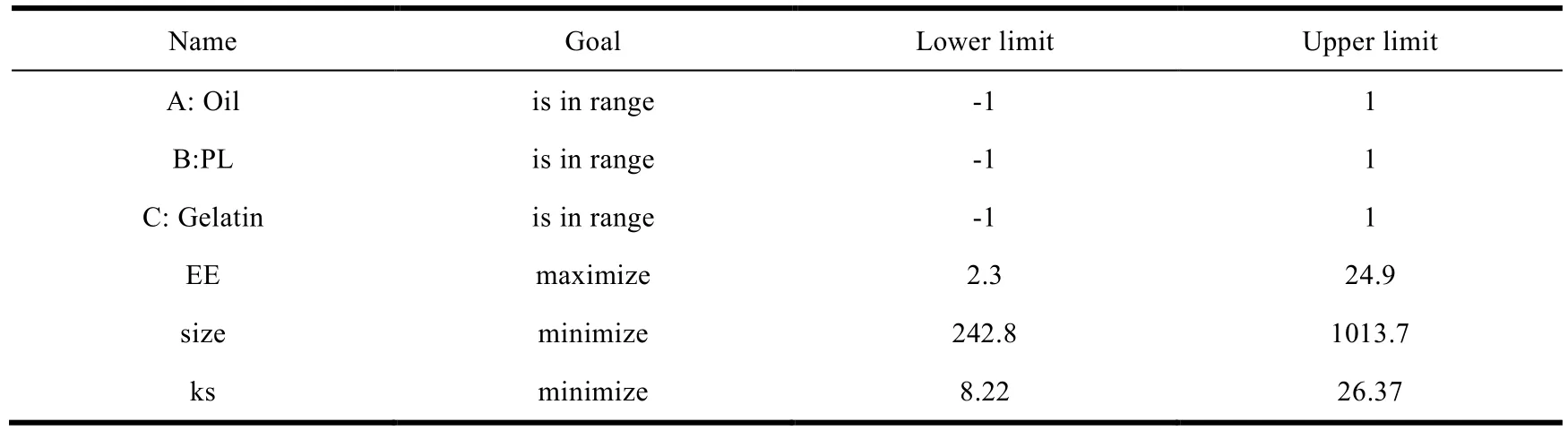
Table 6 Constraints for formula and response表6 响应值与效应值的限制
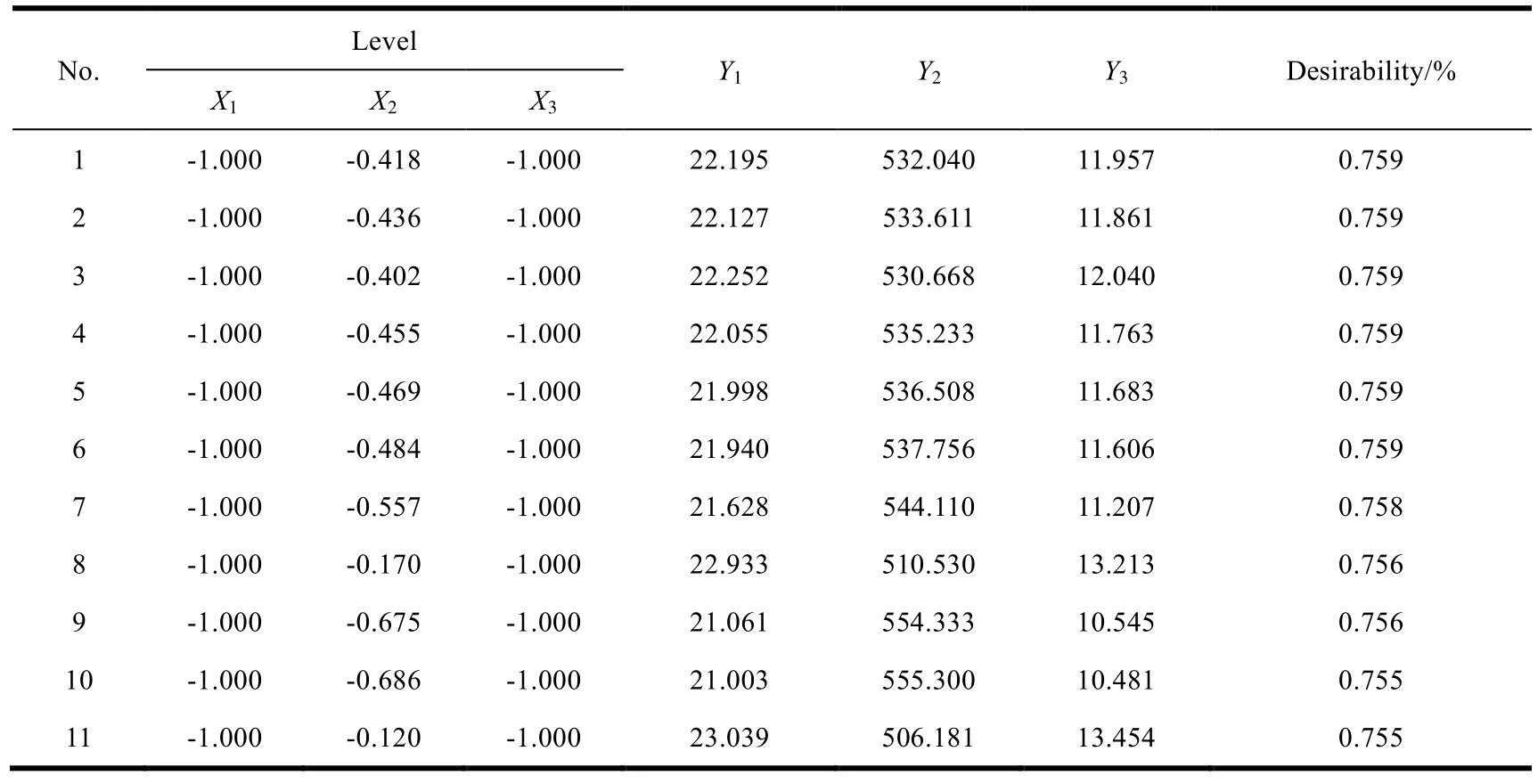
Table 7 The preparation of submicron emulsion solutions表7 亚微乳处方优化方案
2.3 最优处方验证
软件预测的最优处方(No.1)配比如图 14 所示:5.00 % 大豆油、0.200 % 明胶、0.788 %磷脂。
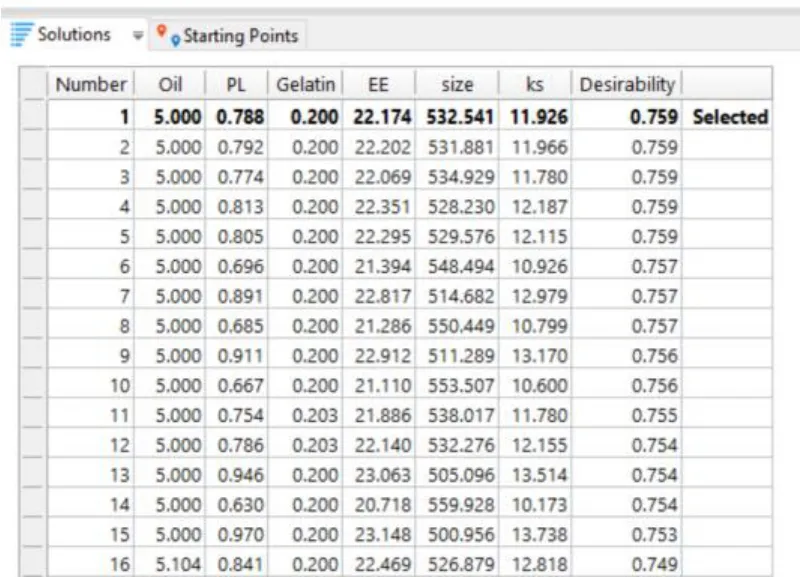
Fig.14 The best prescription predicted by the software图14 软件预测最优处方
理论最优处方的载药量 EE(Y1)、粒径 Size(Y2)、离心稳定性Ks(Y3)结果见表 8。

Table 8 Predicted and measured values of Y1,Y2,Y3 and bias prepared according to the optimal experimental conditions (X1=-1,X2=-1,X3=-1)表8 最优处方下制剂的 Y1、Y2、Y3 的理论值与实测值及其偏差(X1=-1,X2=-1,X3=-1)
由表 7 的验证结果可知,根据预测最优处方制备的β-胡萝卜素亚微乳的载药量 EE(Y1)、粒径 Size(Y2)的实际值和理论之间相对偏差较低。而离心稳定性Ks(Y3)实际值和理论值之间的相对偏差较高。但是,最优处方离心稳定性的实际值优于理论值。表明该模型较为准确地预测了最优处方,可以很好地协助试验,减少试验次数,提高试验精准度。
2.4 模拟体内药物释放
如图 15 所示,从实验组和对照组的β-胡萝卜素释放曲线可得对照组的释放度大于实验组。表明明胶修饰的β-胡萝卜素亚微乳具有一定的缓释作用。
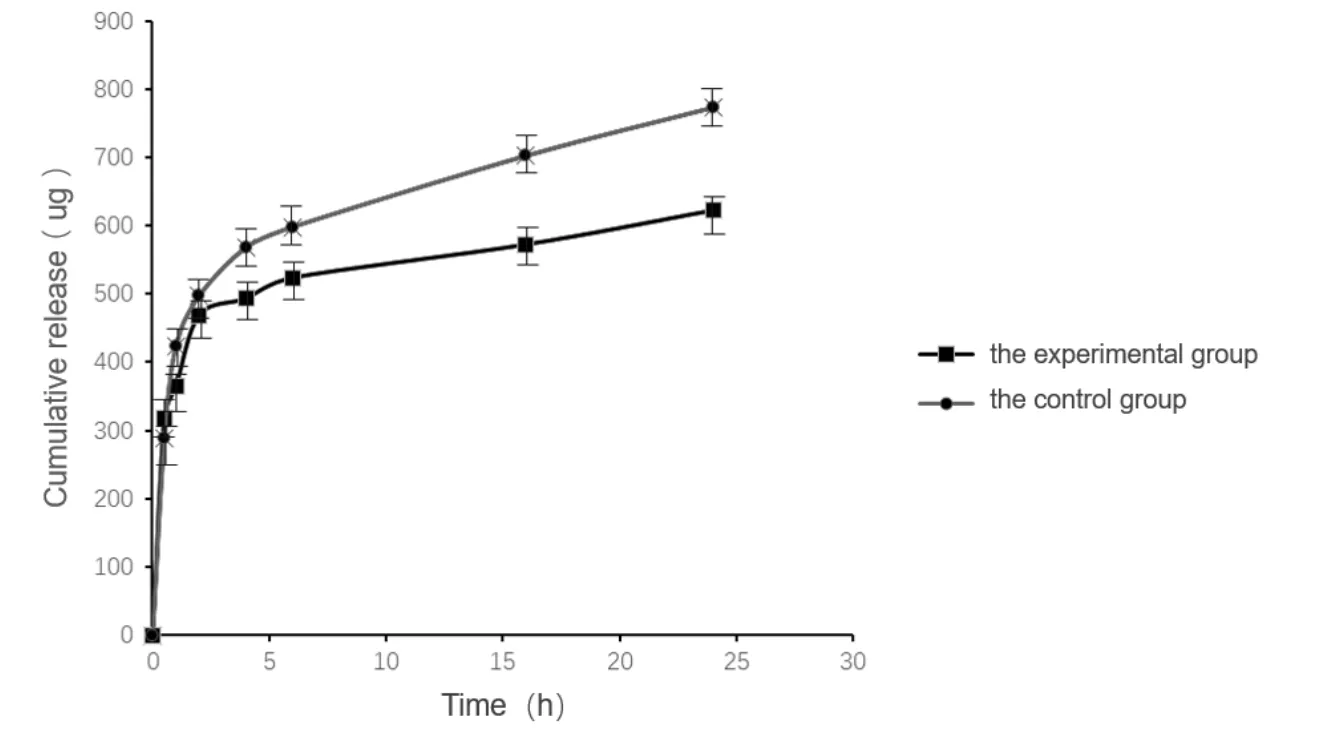
Fig.15 In vitro release curves of β-carotene submicron emulsion图15 β-胡萝卜素亚微乳体外释放曲线
2.5 透射电镜观察
明胶修饰β-胡萝卜素亚微乳透射电镜如图 16。结果表明明胶修饰的β-胡萝卜素亚微乳为圆球形,粒径分布较均匀,粒子分散不聚集,其平均粒径在 300~400 nm 左右。

Fig.16 Transmission electron micrograph of β-carotene submicron emulsion图16 β-胡萝卜素亚微乳透射电镜图
3 讨论
本次实验采用星点设计-效应面法建立可信的数学模型。已知三个因素的大致可取范围,运用Design-Expert 11 软件对结果进行优化处理与分析,减少评估各参数的主要影响及各因素相互作用所需的实验次数。
通过数学建模的方法,得出各因素的回归方程。正值表示各个因素与响应值之间的正相关,负值表示各个因素与响应值之间的负相关。通过t检验在P< 0.05,删除掉多余冗杂的系数项后,再进行非线性估计,最终达到优化简化模型,提高精确度的目的。回归方程如下:
Y1=20.137 5 -1.181 9X1-1.303 1X2-1.447 9X3-0.487 5X1X2-1.887 5X1X3+0.487 5X2X3-0.042 3X1² -2.845 0X2² -1.461 7X3² (R²=0.503 9,P< 0.000 1,F> 0.05)
Y3=26.109 5 -1.459 6X1-0.871 6X2-0.213 7X3-1.368 7X1X2-1.743 7X1X3-4.068 7X2X3-6.585 4X1² -0.847 7X2² -2.522 7X3² (R²=0.976 2,P< 0.000 1,F> 0.05)
Design-Expert 11 软件预测到的最优处方为:5.00 % 大豆油、0.200 % 明胶、0.729 % 磷脂。β-胡萝卜素亚微乳的载药量 EE(Y1)、粒径 Size(Y2)的实际值和理论之间相对偏差较低,而离心稳定性Ks(Y3)实际值和理论值之间的相对偏差较高。但是,最优处方离心稳定性的实际值优于理论值,表明星点设计-效应面法所建立的数学模型能够较好的应用于β-胡萝卜素亚微乳制剂的处方设计与优化中。
综上所述,本实验制备的β-胡萝卜素亚微乳通过星点设计-效应面法建立的数据模型能对β-胡萝卜素亚微乳制剂的处方进行较好的预测。此外,应用 3D 响应面和数学模型得出的轮廓图来确定最佳处方,去除多余的实验步骤,减少试验次数,提高试验精准度。能够很好地用于β-胡萝卜素亚微乳处方的筛选与亚微乳的制备。
