溴结构域蛋白4在糖尿病及其并发症中的作用研究进展
2023-05-23李艳雯高文欣廖梓妤胡奕鸣李加林2吴素珍
杨 梦,李艳雯,2,高文欣,周 璇,廖梓妤,胡奕鸣,李加林2,,吴素珍,2
(1. 赣南医学院基础医学院;2. 赣南医学院心脑血管疾病防治教育部重点实验室;3. 赣南医学院药学院,江西 赣州 341000)
糖尿病是引起心血管疾病的原因之一,其在全球的发病率逐年上升,并因此导致一系列并发症,常会造成患者组织器官的不可逆损伤。糖尿病是常见的代谢性疾病,是由于胰岛β 细胞受损导致胰岛素分泌障碍,从而在高血糖状态下造成机体代谢功能紊乱,导致一系列并发症的发生发展[1-2]。由于机体长期受到高血糖影响,患者各器官组织受到的损伤在不断加重,从微血管和神经损伤逐渐发展至大血管损伤和主要器官受损,常见的糖尿病并发症有糖尿病视网膜病、糖尿病认知障碍、糖尿病心肌病、糖尿病肾病以及糖尿病足等[3-4]。对于糖尿病的治疗并无特异性药物,良好的生活方式协同药物治疗及对各类并发症特异性针对治疗仍是当前研究的重要方向。
表观遗传指的是在基因的核苷酸序列不发生改变的情况下,基因表达发生可遗传变化。表观遗传的现象很多,已知的有DNA甲基化(DNA methylation)、基因组印记(Genomic imprinting)、母体效应(Maternal effects)、基因沉默(Gene silencing)、核仁显性、休眠转座子激活和RNA 编辑(RNA editing)等,在这些表观遗传现象中,尤其是DNA 甲基化和组蛋白修饰,在多种疾病中发挥着重要作用[2-3]。
溴结构域和超末端外(Bromodomain and extra terminal proteins,BET)蛋白家族是表观遗传读取器,可通过溴结构域与组蛋白和主转录因子上的乙酰化赖氨酸残基结合,调节基因转录,调控疾病的进程[4]。据研究报道,溴结构蛋白家族中的溴结构域蛋白4(Bromodomain-containing protein 4,BRD4)参与了糖尿病及其各类并发症的进程[5-8]。因此进一步探索BRD4 的具体作用机制,可为未来治疗糖尿病提供较好的治疗策略。
1 溴结构域蛋白与糖尿病
BRD4 是BET 蛋白家族成员之一,是BET 蛋白家族中被研究最多的成员[9]。BET 是一类含有溴结构域(Bromodomain,BD)的蛋白,在人类中有61 个,是组蛋白和其他蛋白上乙酰化赖氨酸残基的“阅读器”。BET 家 族 由4 个 成 员 组 成:BRD2、BRD3、BRD4 及BRDT。BRD2、BRD3、BRD4 普遍表达,而BRDT 仅表达于男性生殖细胞。BET 蛋白含两个保守的N 端溴代结构域(BD1 和BD2)、一个端外结构域(Extraterminal domain,ET)和一个羧基末端结构域(C-terminal domain,CTD)(图1)。BDs是蛋白质-蛋白质发生相互作用的氨基酸疏水区域,可以作为表观遗传的“阅读器”;ET结构域负责招募不同的蛋白质,这些蛋白质是转录复合物的组成部分;SEED 结构域是保守的区域,富含丝氨酸-谷氨酸-天冬氨酸;CTD 仅由BET 蛋白家族中的两个成员(BRD4 和BRDT)拥有,这是招募正向转录延伸因子(Positive transcriptional elongation factor b,P-TEFb)所 必 需的[4]。BET 蛋白可与位于“超级增强子”或基因启动子区域的组蛋白的乙酰化赖氨酸结合,结合后BET蛋白通过CTD 结构域募集转录复合物调控基因转录。BET 蛋白作为基因转录的表观调控因子,在细胞生长、分化及炎症中具有重要的调控作用。同时,这些蛋白位于细胞核,调节许多细胞活动,包括基因转录、DNA 复制、细胞周期进程等[3-4]。有多项研究表明,BET蛋白家族参与了多种疾病的进程,如纤维化、白血病、癌症及炎症等[10-12]。
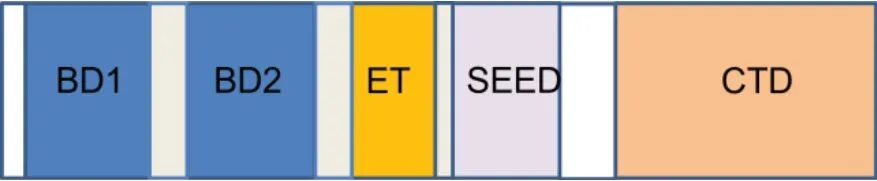
图1 溴结构域蛋白4(BRD4)分子结构模式图
根据文献报道,BET 蛋白在糖尿病中有重要作用,其可通过参与糖尿病的血管生成调控疾病的发展[13]。在1 型糖尿病(Type1diabetes,T1D)中,胰岛细胞中的衰老相关分泌表型(Senescence-associatedsecretory phenotype,SASP)受BET 蛋白的转录调控,BRD4 在SASP 活性调控区域结合,促进SASP 因子的转录激活和分泌,进而加快疾病进程[14]。在2 型糖尿病(Type 2 diabetes,T2D)中,BET蛋白通过调控炎症因子的表达促进疾病的发生发展[15]。因此,设计和合成靶向BRD4 的药物,在糖尿病的治疗中有重要意义。
2 BRD4在糖尿病并发症中的作用
2.1 BRD4 与糖尿病心肌病 糖尿病心肌病是糖尿病的并发症之一,是体内糖脂代谢失调的结果。体内代谢机制的紊乱导致氧化应激增加和多种炎症途径的激活,这些炎症途径介导细胞和细胞外损伤、病理性心脏重塑以及舒张和收缩功能障碍[16]。在糖尿病患者中,心血管疾病是导致患者死亡的主要原因。糖尿病心肌病发病机制复杂,涉及心肌细胞代谢紊乱、钙稳态失调、胰岛素抵抗、氧化应激、心肌细胞自噬与凋亡、心肌纤维化及心室重塑等,各个因素相互作用促进疾病的进程[17]。因此,需要明确各个机制具体的靶点以指导临床。有数据表明,组蛋白去乙酰化酶影响心肌细胞的病理生理过程,包括心肌细胞肥大、纤维化、炎症和上皮-间质转化,在组蛋白乙酰转移酶的调控下,BET蛋白识别乙酰化的组蛋白,进而调控细胞增殖、凋亡和炎症的基因表达[18]。文献报道,BRD4 的高表达参与了心肌病理性肥厚过程[19]。
有研究报道,BRD4 在糖尿病心肌病的发展过程中有重大意义[5]。当用高糖(High glucose,HG)刺激H9C2 细胞48 h 后,BRD4 蛋白表达水平增加。同时,心肌肥大标志物、心钠素、细胞骨架蛋白α-肌动蛋白和纤维化相关基因上调,包括转化生长因子-β(Transforming grouth factor-β,TGF-β)、SMAD 家族成员3、结缔组织生长因子和Ⅰ型胶原蛋白等。这项研究也揭示了HG 刺激下AKT 通路会被显著激活。然而,服用特定的BRD4 抑制剂JQ1,AKT 通路激活被抑制,心肌肥大标志物及纤维化蛋白的表达也相应减弱[5]。在链脲佐菌素(Streptozotocin,STZ)诱导的糖尿病心肌病小鼠模型中,使用BRD4 抑制剂JQ1,心脏纤维化被抑制,且心脏功能也得到了改善[20]。进一步研究发现高糖刺激的心肌成纤维细胞BRD4 表达上调。同时,高糖状态下,Caveolin-1蛋白表达被抑制,Caveolin-1是小窝蛋白的主要结构蛋白,是TGF-β1信号转导的负调控因子。使用JQ1后,恢复了Caveolin-1 的表达,抑制了TGF-β1/Smad3 信号通路,Caveolin-1直接将小窝蛋白支架结构域组分与TGF-β Ⅰ型受体(Transforming growth factor-β Ⅰreceptor,TβRⅠ)结合,通过TGF-β 受体降低Smads的下游信号传导,进而减轻心脏的纤维化,进一步表明BRD4 参与了糖尿病心肌病的发生过程[20]。最新实验数据表明,糖尿病小鼠心脏中BRD4 上调抑制了PINK1/Parkin 介导的线粒体自噬,导致受损线粒体积聚,并随后损害心脏结构和功能[7]。这些效应依赖于BRD4 驱动的转录重组和PINK1 的抑制。小分子溴结构域抑制剂JQ1 抑制BRD4 溴结构域后,可改善线粒体功能,修复糖尿病心脏的心脏结构和功能[7]。这些研究均表明,BRD4参与了糖尿病心肌病进程,抑制BRD4 是治疗糖尿病心肌病的有效策略。
2.2 BRD4 与糖尿病认知功能障碍 认知功能是指大脑对外界信息加工并反馈,包括记忆力、视空间定向、计算能力、执行能力、语言理解和表达及应用等方面[21]。糖尿病认知功能障碍(Diabetes cognitive impairment,DCI)是以认知缺陷为主要特征的糖尿病慢性并发症,是糖尿病的慢性并发症之一,在T1DM 和T2DM 中均可发生[22]。由糖尿病引起的认知功能障碍发病率远高于非糖尿病患者。近年关于DCI 的发病机制有很多报道,包括糖脂代谢紊乱、中枢胰岛素抵抗(Insulin resistance,IR)、氧化应激、炎症反应、血脑屏障受损、内质网应激等[22]。氧化应激被认为是糖尿病认知功能障碍发生和发展的潜在机制。目前,有研究[23]发现,BRD4在糖尿病认知障碍中起重要作用,在该项研究中,糖尿病的认知功能障碍伴随着海马内NADPH 氧化酶4(NADPH oxidase 4,Nox4)表达升高,NFE2 相关因子2(NFE2-related factor 2,Nrf2)/血红素氧化酶1(Heme oxygenase 1,HO-1)轴受损,使用JQ1 治疗恢复了Nox4-Nrf2氧化还原失衡,减轻了海马的氧化损伤、炎症和凋亡,促进了神经元存活。超氧化物歧化 酶(Superoxide dismutase,SOD)和 丙 二 醛(Malondialdehyde,MDA)作为氧化应激的检测指标,在STZ 诱导的糖尿病认知障碍大鼠模型中,可以观察到海马中SOD 活性显著下降及MDA 水平显著升高[23]。使用JQ1 后,不仅降低MDA 水平和增加SOD活性,减轻氧化应激损伤,还下调了炎性细胞因子(IL-1β、TNF-α)水平。该项结果表明,糖尿病认知功能障碍大鼠在接受JQ1 治疗后,神经元存活和认知功能均有所改善。在糖尿病大鼠海马中,Nrf2/HO-1 水平显著降低,Nox4 表达增加[23]。因此,海马中Nox4-Nrf2 氧化还原平衡的恢复可能是糖尿病认知功能障碍的有效治疗策略。JQ1 治疗可逆转糖尿病认知障碍,表明BRD4 可能是治疗糖尿病认知障碍的重要靶点。
2.3 BRD4 与糖尿病视网膜病变 糖尿病视网膜病变是糖尿病引起的微血管并发症之一,由于长期血糖控制不佳,体内代谢紊乱,诱发的炎症可引发神经和视网膜细胞功能障碍、氧化应激、血管内皮生长因子(Vascular endothelial growth factor,VEGF)产生和视网膜血管渗漏导致视力模糊、视力下降等[24]。血管病变是视网膜并发症的基础,而血管内皮损伤是血管病变的主要原因,当血管内皮损伤后,则会导致微血管并发症的产生,进而引起糖尿病视网膜病变[25]。糖尿病视网膜病变的病因是多因素的,最佳的治疗方法是改善炎症,减缓血管损伤,从而减轻光感受器细胞的功能障碍。近年来,糖尿病视网膜病变的发病率显著增加,已成为视力损害和失明的主要原因[26-27]。
BRD4 可诱导视网膜炎症,在视网膜变性中起作用。在STZ 诱导的糖尿病小鼠的视网膜病变中,pERK5和BRD4的表达均增加[28]。细胞外信号相关激酶5(Extracellular signal-related kinase-5,ERK5)是丝裂原活化蛋白激酶(Mitogen-activated protein kinase,MAPK)信号通路的末端成员,可通过一系列磷酸化级联反应诱导炎症。ERK5 磷酸化后,pERK5 易位到细胞核,可诱导生长因子和炎性细胞因子的基因转录。BRD4 的结构中包含两个溴结构域,可识别乙酰化的赖氨酸残基进而调控基因转录,在视网膜和神经细胞功能障碍和变性中发挥作用。
XMD8-92 是一种小分子抑制剂,源于polo 样激酶1(Polo-like kinase 1,PLK1),可 阻 断ERK5 和BRD4 上的乙酰赖氨酸结合并终止下游的炎症活动。XMD8-92 治疗可明显改善糖尿病介导的视网膜炎症发生、VEGF 生成和氧化应激。闭锁连接蛋白-1(Zonula occludens-1,ZO-1)是一种与视网膜血管通透性相关的紧密连接蛋白,高血糖会损害视网膜血管系统中紧密连接蛋白ZO-1的表达和分布,从而影响血管通透性。目前研究已证明糖尿病显著降低视网膜中的ZO-1。接受XMD8-92 治疗阻止了糖尿病小鼠ZO-1 的降解。XMD8-92 与BRD4 的乙酰赖氨酸结合部分相互作用,中断了BRD4 依赖性的炎性细胞因子和生长因子的产生,同时它也与ERK5 的双肾上腺皮质激素样激酶2、Polo 样激酶4和非受体酪氨酸激酶1 部分结合,抑制pERK5 向细胞核的移位和ERK5 依赖性炎症的诱导,XMD8-92在糖尿病引起的视网膜病变中发挥较好的治疗效果,可明显改善糖尿病介导的视网膜炎症、VEGF 生成和氧化应激[28]。这些结果表明,抑制ERK5 和BRD4 是一个治疗糖尿病视网膜病变的新治疗靶点,但BRD4 在糖尿病视网膜病变发病中的作用机制有待进一步阐明。
2.4 BRD4 与糖尿病椎间盘退变 椎间盘退变性疾病是常见的脊柱外科疾病,但其发病机制复杂,目前尚未明确。椎间盘由髓核、纤维环和软骨终板这几个部分组成。主要的营养途径有两种:第一种是终板途径;第二种是纤维环途径。若其中涉及的相关基因出现问题,则会促进椎间盘发生病变[29]。椎间盘退变主要特征为在多种病理因素刺激下多种分子介导的髓核细胞数目减少,细胞外基质(Extracellular matrix,ECM)代谢失衡[30]。有研究[31]表明,糖尿病的发生可能会引起椎间盘退行性病变(Intervertebral disc degeneration,IVDD),并且也表明了BRD4 可能是调控糖尿病椎间盘退行性病变的靶点。BRD4 作为BET 蛋白家族成员,已被证明与慢性炎症有关。髓核细胞的ECM 代谢是一个动态过程,基质金属蛋白酶-13(Matrix metalloproteinase-13,MMP-13)是髓核细胞(Nucleuspulposus cells,NPC)ECM 代谢的主要分解代谢因子之一。有研究[31]表明,在糖尿病髓核组织以及晚期糖基化终末产物(Advanced glycationendproducts,AGEs)处理的NPC中BRD4 和MMP-13 的表达升高。为了进一步探索BRD4 与MMP-13 之间的联系,分别构建了体内外IVDD 模型[31]。在AGES 处理的NPC 体外模型中,MMP-13 表达上调,同时激活了MAPK 和NF-κB 炎症信号通路以及自噬。之后分别使用p38 抑制剂SB202190、NF-κB 抑制剂BAY-11-7082、自噬激动剂Rapa和自噬抑制剂3-MA处理AGES诱导的NPC,发现使用P38及NF-κB的抑制可降低MMP-13的表达,同时自噬激动剂Rapa抑制了MMP-13水平,而自噬抑制剂3-MA上调了AGEs-BSA处理的NPC中MMP-14的表达。进一步研究发现,在敲除或抑制BRD4 后,不仅抑制p38 和JNK 以及NF-κB 信号通路的激活,也促进NPC 中的自噬。同时发现无论是在体内还是体外抑制BRD4 的活性,均下调MMP 的表达水平,并改善糖尿病引起的IVDD。糖尿病NPC 中MMP-13 受MAPK、NF-κB 信号通路和自噬调节[31]。同时,BRD4 是MAPK、NF-κB 信号通路和自噬上游的调节因素。因而,BRD4 可作为未来治疗糖尿病诱发的椎间盘退行性疾病的治疗靶点。
2.5 BRD4 与糖尿病肾病 糖尿病肾病(Diabetic nephropathy,DN)是由糖尿病引起的微血管并发症之一,是目前导致终末期肾病(End stage renal disease,ESRD)的首要病因。DN 发病机制较为复杂,遗传因素、代谢紊乱、炎症因子与细胞因子、氧化应激和自噬均是其影响因素,各个因素相互作用推进疾病的发生发展[32-33]。糖尿病肾病的主要特征是大量的蛋白尿、肾小球硬化水平逐渐升高及肾小球滤过率降低,最终发展为ESRD。当人体患有糖尿病,肾脏则处于高血糖状态,这会破坏肾小球基底膜的结构完整性,继而扩大系膜间隙,导致肾小球白蛋白渗漏。同时,肾小管和间质结构也发生了改变,使肾功能下降。糖尿病肾病典型的病理特征是肾小球基底膜增厚,间质纤维化和肾小管萎缩,同时伴有炎症细胞浸润。高血糖在DN 的发生发展中起至关重要的作用,长期的高糖状态导致代谢机制紊乱,从而激活体内多种信号通路。因此,严格控制血糖水平对治疗DN是必要的。研究报道,在高糖诱导的足细胞损伤中,BRD4 表达上调,BRD4 过度表达加重了高糖诱导的足细胞损伤和抑制了Nrf 相关因子2(NF-E2-related factor 2,Nrf2)/抗氧化反应元件(Antioxidant response element,ARE)的转录活性[34]。Nrf2 可通过激活血红素加氧酶和NADPH 醌氧化还原酶1的转录保护细胞免受氧化损伤。当通过小干扰RNA或其化学抑制剂(JQ1)抑制BRD4,可显著抑制HG 诱导的细胞凋亡和活性氧(Reactive oxygen superoxide,ROS)的产生。同时,BRD4 抑制促进Nrf2 核转位,上调Nrf2/抗氧化反应元件(Antioxidant response element,ARE)的转录活性,表明BRD4 参与了糖尿病肾病的进程[6]。在高糖刺激的人肾小球系膜细胞株(Human renal mesangial cells,HMCs)中,BRD4表达上调,促进增殖相关基因(Myc protooncogene,c-Myc)、α-平滑肌肌动蛋白(Alpha smooth muscle actin, α-SMA)、Ⅳ型 胶 原(Collagen type-Ⅳ,Collagen-Ⅳ)等蛋白的表达。在使用JQ1 后,BRD4 的功能被抑制,c-Myc、α-SMA、Collagen-Ⅳ蛋白表达被下调。该研究还表明,BRD4是HG 介导NF-κB 活化的重要因素,NF-κB 炎症信号通路被激活后释放的细胞因子及炎症介质进一步促进肾小球系膜细胞肥大和基质扩张,从而进一步加重肾脏损伤,但JQ1 处理后,NF-κB 亚基中的P65核转位明显减少[34]。上述研究均表明,BRD4在糖尿病肾病中具有重要的研究意义,其可作为进一步治疗糖尿病肾病的重要靶向。
3 以BRD4 为靶点的抗糖尿病及其并发症的药物
BRD4 参与了多种肿瘤的发生发展,如肾细胞癌、乳腺癌、急性髓细胞白血病及结直肠癌等[35-37]。此外,其在非癌性疾病中也发挥重要作用,如炎症、艾滋病及心血管系统疾病等。因此,开发针对BRD4 的小分子抑制剂是必要的,其可作为治疗BRD4 相关疾病的重要靶向性药物。目前已知的BRD4 小分子抑制剂主要有异恶唑类、喹啉类、四氢喹啉类、萘啶类、乙酰化赖氨酸类似物等[38]。JQ1 是第一个被报道且应用最为广泛的BRD4抑制剂,JQ1可同时抑制BRD4的BD1和BD2,从而抑制BRD4识别乙酰化的赖氨酸[38]。在结直肠癌(Colorectal cancer cells,CRC)中,CRC 的发生和进展依赖于活跃的Wnt 通路和异常的MYC 表达,MYC癌基因的转录依赖于BRD4。当使用这种细胞可渗透的小分子抑制剂JQ1 占据BRD4 的溴结构域,可阻止其与乙酰化组蛋白结合,即可选择性抑制MYC癌基因和MYC依赖基因的转录,从而为治疗CRC 提供有效策略[11]。CPI-203,一种新型的溴结构域抑制剂,可选择性抑制BRD4。处于潜伏期的人类免疫缺陷病毒1 亚型宿主的持续存在是治疗艾滋病的主要障碍,目前使用的药物没有一种具有足够的效力重新激活潜伏病毒或消除体内潜伏的人类免疫缺陷病毒1亚型宿主。CPI-203 可在潜在感染的细胞系中激活处于潜伏期的人类免疫缺陷病毒,同时减轻其诱发的“细胞因子风暴”[39]。
BRD4 参与了糖尿病及其并发症的发生。在STZ 诱发的大鼠糖尿病认知障碍模型中,糖尿病认知功能障碍伴随NADPH 氧化酶4(Nox4)表达升高,海马NFE2 相关因子2(Nrf2)/血红素加氧酶1(HO-1)轴受损[23]。经BET/BRD 抑制剂JQ1 治疗后,改善了小鼠认知能力,海马氧化应激、神经炎症和细胞凋亡减少,神经细胞形态也明显改善,同时增加了p-AKT、Nrf2和HO-1的表达。JQ1处理可恢复Nox4-Nrf2 氧化还原失衡,减轻海马氧化损伤、炎症和凋亡[23]。
在STZ诱导的糖尿病性视网膜病变中,BRD4在小鼠视网膜中的表达量呈上调趋势,BRD4 可诱发视网膜炎症,在视网膜变性中发挥作用。炎症作为糖尿病视网膜病的关键危害性因素,减轻其引起的神经和视网膜细胞功能障碍、氧化应激、VEGF 生成和视网膜血管渗漏等,是治疗视网膜病变的有效方法。XMD8-92是一种小分子抑制剂,阻止了ZO-1的降解,ZO-1 是一种紧密连接蛋白,与视网膜中的血管通透性有关。研究表明,XMD8-92 可治疗糖尿病介导的血管渗漏和毛细血管变性,为未来治疗糖尿病视网膜病变提供新的治疗途径[28]。
糖尿病心肌病是糖尿病患者心力衰竭的主要原因,心肌纤维化及心肌细胞凋亡是该病的重要特征。有研究报道,BRD4 在心肌肥厚中具有重要作用[18]。在STZ 诱导的糖尿病心肌病体内实验及HG诱发的H9C2 细胞糖尿病心肌病细胞模型和高脂肪饮食诱导的糖尿病性心肌病动物模型中,BRD4 均表达上调,在使用BRD4 抑制剂JQ1 后,心肌肥厚标志物、心房利钠肽、细胞骨架蛋白α-肌动蛋白和纤维化相关基因表达量减少[5]。同时,在糖尿病心肌病动物模型中,JQ1 的使用抑制了BRD4 的功能,从而改善线粒体功能,修复糖尿病心肌病的心脏结构和功能[7]。因此,BET 抑制剂JQ1 治疗糖尿病性心肌病有较好前景。
糖尿病肾病是糖尿病引起的慢性并发症之一,也是全球性终末期肾病高发的重要病因。在HG 诱导的人肾系膜细胞HMCs 糖尿病肾病模型及HG 诱导的足细胞损伤模型中,BRD4 的表达水平明显提高。在这两种糖尿病肾病模型中,均给予JQ1治疗,发现在使用JQ1 处理后,人肾系膜细胞HMCs 的增殖和肥大均被抑制[34]。同时HG 对足细胞的损伤也因JQ1 的使用,使Nrf2/ARE 抗氧化信号通路表达增强,从而对足细胞产生保护作用[6]。
1 型糖尿病是由于自身免疫缺陷导致的胰腺β细胞的进行性丢失和损伤。在非肥胖糖尿病(Nonobese diabetics,NOD)小鼠模型的T1D 中,β 细胞获得一种衰老相关的分泌表型(Senescence-associated secretory phenotype,SASP),它是促进疾病进程的主要驱动因素,研究表明,胰岛细胞中的SASP 受BET蛋白的转录控制,包括BRD4[14]。通过对NOD胰岛中关键β细胞SASP基因的染色质分析,发现BRD4在活性调控区域结合。使用BET 蛋白抑制剂iBET-762,其不仅降低了SASP 因子的转录激活和分泌,还降低了非细胞自主活性和DNA损伤[14]。
同时,在非肥胖糖尿病小鼠模型中,使用溴结构域小分子抑制剂I-BET151 进行治疗,发现该抑制剂可预防或清除胰岛炎。I-BET151还诱导胰岛β细胞再生,诱导β 细胞分化/功能关键转录因子基因的增殖和表达。且使用表观遗传修饰剂I-BET151 治疗NOD 小鼠仅2周,就可终生预防NOD 糖尿病的发展[40]。I-BET151 可通过NF-κB 途径诱导胰腺MF 群体产生抗炎表型,促进β 细胞增殖[40]。溴结构域抑制剂的应用为未来预防T1D提供了新途径。
临床试验数据表明,RVX-208 是一种选择性BET 蛋白抑制剂,对炎症、内皮功能障碍、血栓形成和血管钙化相关的途径起有益作用,通过选择性抑制BET 蛋白诱导apoA-I 表达,导致体内葡萄糖浓度降低,还诱导了HDL脂质组成和HDL颗粒大小分布的显著变化,促进脂类转化,从而调节糖尿病前期患者HDL 脂质水平和糖代谢[41]。同时,二期临床数据表明,在2 型糖尿病患者中RVX-208 对重大不良心血管事件产生有利影响[42]。
我们将有关治疗糖尿病及其并发症的溴结构域抑制剂进行归纳总结,见表1。BRD4 对糖尿病及其并发症有重要的调控作用,JQI 是目前应用于研究该疾病最多的溴结构抑制剂,但JQ1半衰期短,毒副作用较大。因此探寻新颖且特异性较高的溴蛋白抑制剂是必要的,是未来治疗糖尿病的重要靶向。溴结构域抑制剂的作用模式如图2所示。
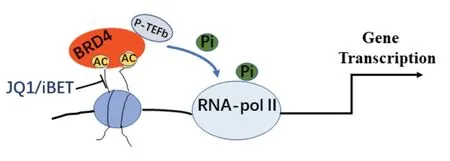
图2 溴结构域抑制剂抑制BRD4调控基因转录的作用模式图
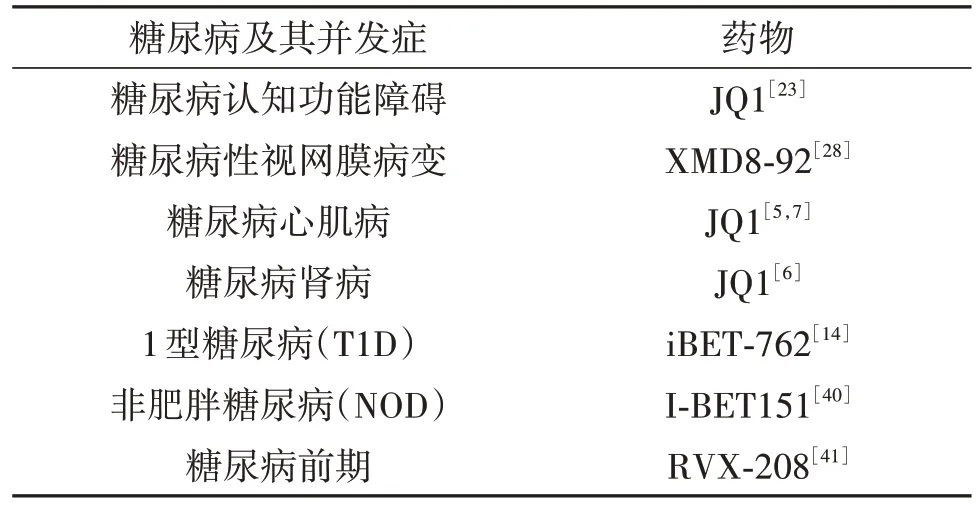
表1 以BRD4为靶点的抗糖尿病及其并发症的药物
4 小结
BRD4 在糖尿病的几大并发症中具体作用机制尚不明确,但其在疾病中高表达促进了病理改变,加重组织器官损伤。在使用其抑制剂后,这一现象可明显改善,但溴结构抑制剂应用于治疗糖尿病的临床试验较少。目前,治疗糖尿病还是基于对血糖水平的控制,尚无药物可逆转该疾病的发生发展。因此,BRD4 可能是治疗糖尿病的一个潜在靶点,深入探索其在糖尿病中的作用机理,可为未来治疗糖尿病提供新的治疗手段。
