两个八仙花品种花色苷的提取、鉴定和理化稳定性
2023-05-22李清韵唐倩雯陈冠群申晓辉
李清韵 唐倩雯 陈冠群 申晓辉


摘 要:為优化八仙花花色苷提取条件,探究具有不同花色可调性的八仙花花色苷组分和理化稳定性差异,初步解释八仙花花色可调性存在差异的原因,该文以花色不可调的‘蒂亚娜(Tijana)和花色可调的‘拉维布兰(Ravi Brent)八仙花(Hydrangea macrophylla)为材料,通过L9(33)正交试验确定超声波法提取花色苷的最优条件,利用UPLC-Q-TOF-MS法进行花色苷组分的鉴定,分析离体条件下温度、光照、金属离子和糖类对八仙花花色苷理化稳定性的影响。结果表明:(1)花色苷提取的最优条件是‘蒂亚娜和‘拉维布兰的乙醇浓度分别为70%和80%,料液比均为1∶20,提取时间均为20 min。(2)二者的主要花色苷组分均为飞燕草素-3-O-葡萄糖苷。(3)八仙花花色苷在温度≤ 70 ℃暗处保存效果更好。(4)花色不可调的‘蒂亚娜八仙花花色苷对光照、糖类和大多金属离子更稳定;只有花色可调的‘拉维布兰八仙花花色苷加入中低浓度(10~30 mmol·L-1)Al3+ 后由粉色变为蓝色且稳定性提高,而 ‘蒂亚娜无此颜色变化,表明八仙花花色可调性的差异与其理化稳定性有关。该研究结果为八仙花花色苷提取、保存、花色改良以及干燥花护色等提供了理论依据。
关键词: 八仙花, 花色苷, 超声提取, 鉴定, 理化稳定性
中图分类号:Q945
文献标识码:A
文章编号:1000-3142(2023)04-0765-12
Abstract:To explain the reason for different flower color adjustabilities of Hydrangea macrophylla, non-adjustable color ‘Tijana and adjustable color ‘Ravi Brent of Hydrangea macrophylla were used as experimental materials. The extraction conditions were optimized and the components of H. macrophylla anthocyanins were measured. Their physical-chemical stabilities were also explored, aiming to explore the mechanism of flower color adjustability. The optimal extraction conditions of Hydrangea anthocyanins by the ultrasonic method were determined through L9(33)orthogonal experiments. The anthocyanin components were separated and identified by UPLC-Q-TOF-MS. And the effects of temperature, light, metal ions and sugars on the physical-chemical stabilities of H. macrophylla anthocyanins were also explored in vitro conditions. The results were as follows: (1) The optimal conditions for extraction of H. macrophylla anthocyanins were that the ethanol concentration for ‘Tijana and ‘Ravi Brent were 70% and 80% respectively; the ratio of plant material to extraction solution was both 1∶20; and the extraction time was both 20 m. (2) The main anthocyanin component of the two varieties was both Delphinidin 3-O-glucoside. (3) H. macrophylla anthocyanins were more stable when stored below 70 ℃ and in the dark. (4) Both Cu2+ and Al3+ change the color of the anthocyanin solution, and Cu2+ specifically improved the stability of the anthocyanin of ‘Tijana. 10-90 mmol·L-1 Ca2+, Al3+ and 90 mmol·L-1 Mg2+ had significant effects on the stability of anthocyanin of both varieties. Glucose, maltose, sucrose, galactose and 8%-10% concentration of rhamnose increased the stability of the non-adjustable color ‘Tijana Hydrangea macrophlla anthocyanins. While 4%-10% concentration of rhamnose promoted the stability of adjustable color ‘Ravi Brent Hydrangea macrophylla anthocyanins. The non-adjustable color ‘Tijana of H. macrophylla anthocyanins were more stable to light, sugars and most metal ions, compared with the adjustable color ‘Ravi Brent. Only the anthocyanins of the adjustable color ‘Ravi Brent of H. macrophylla turned from pink to blue, and its stability increased after adding low medium concentration (10-30 mmol·L-1) of Al3+. However, the non-adjustable color ‘Tijana of H. macrophylla did not have this kind of color change, indicating that the difference in color adjustability of H. flowers is related to its physical-chemical stability. These results provide the theoretical reference for the extraction and observation of H. macrophlla anthocyanins, flower color improvement and dry flower color protection.
Key words: Hydrangea macrophylla, anthocyanins, ultrasonic extraction, identification, physical-chemical stability
八仙花(Hydrangea macrophylla)别名绣球,为虎耳草科(Saxifragaceae)八仙花属(Hydrangea)落叶灌木,品种繁多且花色丰富,是切花、盆花及园林景观中的重要观赏植物。目前,对于八仙花花色的研究多集中于单个品种的花色苷提取(刘晓东等,2011)、稳定性分析(贾洪菊,2011)或某些品种间的花色苷组分鉴定(龚仲幸等,2017;Li et al., 2019; Yoshida et al., 2021)等。八仙花花色丰富且在人工栽培条件下具有一定的可调性。蓝色八仙花多由粉色品种转变而成,此类八仙花称为花色可调(刁春武等,2017;杨娟等,2019);另一部分粉色八仙花的花色始终为粉色,即花色不可调(邓衍明等,2018)。Oyama等(2015)和 Kodama等(2016)均发现,在pH 4.0条件下,Al3+、1, 5-O-咖啡酰奎宁酸、2, 5-O-香豆酰奎宁酸与飞燕草素-3-O-葡萄糖苷(Delphinidin-3-O-glucoside)形成蓝色复合物;Li等(2019)发现在含铝的酸性土壤中,这种蓝色复合物的产生使得八仙花由红色变为蓝色; Yoshida等(2021)研究发现,不同花色的八仙花具有相同的花色苷组分,花色的差异源自液泡内pH 和金属离子等因素的差异。
目前,已有研究初步揭示了八仙花存在花色可调的现象,而对其不同品种间花色可调性差异的机制还缺乏较为系统深入的研究。因此,本文选择花色不可调的‘蒂亚娜(Tijana)八仙花和花色可调的‘拉维布兰(Ravi Brent)八仙花作为研究材料,通过L9(33)正交试验设计确定超声波法提取花色苷的最优条件,利用液质联用(UPLC-Q-TOF-MS)法进行花色苷组分的鉴定,通过分光光度计测定吸光度探究离体条件下温度、光照、金属离子和糖类对八仙花花色苷理化稳定性的影响,拟探讨以下问题:(1)超声波法提取八仙花花色苷的最优条件是什么;(2)花色可调/不可调性的八仙花花色苷组分有何差异;(3)影响八仙花花色苷稳定性的因素在花色可调/不可调性之间有无差异。以期为八仙花花色改良、花色苷保存应用和干燥花护色提供理论依据。
1 材料与方法
1.1 材料采集与预处理
2020年1月于上海市闵行区某鲜花店购买花色不可调和可调为蓝色的粉色系八仙花品种‘蒂亚娜(图1:A)和‘拉维布兰(图1:B)切花作为研究材料。各选取5支花色相同、形态相似且完全盛开的花枝,随机选取不同花枝上性状相似的萼片,每份称取鲜重1.000 g。
1.2 方法
1.2.1 花色苷提取条件的优化 利用L9(33)正交试验设计乙醇浓度(%)、料液比(八仙花萼片样品鲜重与提取液体积的比,g·mL-1)、提取时间(超声时间+间隔时间,其中每超声10 s间隔10 s,min),在不高于55 ℃的提取温度下优化八仙花花色苷的最佳提取条件(表1)。
提取参照孙卫等(2010)和Park等(2014)的方法并略作修改。将八仙花样品在液氮中研磨成粉末后,按表1中的提取条件进行超声法提取,得到花色苷提取液。
采用pH示差法对八仙花花色苷提取液中花色苷含量进行测定,参照徐文秀和刘俊(2020)的方法并略作修改,利用Fuleki 公式(1968)计算花色苷含量。
A=( Ax-A700) pH 1.0-( Ax-A700 ) pH 4.5(1)
C = A/ε/L×M×DF×V/W(2)
式中: A为吸光度,Ax、A700分别为最大吸收波长和700 nm 处的吸光度;C为花色苷含量(mg·g-1 FW);ε为矢车菊素-3-O-葡萄糖苷的摩尔消光系数(26 900);L为光程(1 cm);M为花色苷分子质量(449.2);DF为稀释倍数;V为体积(mL);W为样品质量(g)。
1.2.2 花色苷组分分离鉴定 花色苷组分的分离鉴定参照郁晶晶等(2020)的方法并略作修改。采用超高效液相色谱-离子淌度-四极杆飞行时间质谱联用仪(ACQUITY I class UPLC / 2D H class & Vion IMS QTOF MS,上海沃特世科技有限公司)对八仙花花色苷组分进行鉴定分析。含有矢车菊素-3-O-葡萄糖苷(Cyanidin-3-O-glucoside)和飞燕草素-3-O-葡萄糖苷等13种花色苷的混合标准品(European Pharmacopoeia Reference Standard)购自法国 EDQM公司。
UPLC分析条件:柱温45 ℃,流速0.4 mL·min-1,进样体积3 μL;流动相A液:0.1%甲酸溶液(V甲酸∶V水=0.1∶99.9);流动相B液:含0.1% 甲酸乙腈(V甲酸∶V乙腈=0.1∶99.9)。梯度洗脱程序:0 min,95% A,5% B;3 min,80% A,20% B;10 min,0% A,100% B;12 min,0% A,100% B;15 min,5% A,95% B;19 min,5% A,95% B。
质谱分析条件:电喷雾电离,正离子检测模式,扫描范圍为 50 ~ 1 000 m·z-1,扫描速度为0.2 s;毛细管电压 2 000 V,锥孔电压 40 V,雾化气温度450 ℃,雾化气流量 900 L·h-1,锥孔反吹气 50 L·h-1,离子源温度115 ℃。
1.2.3 花色苷稳定性的影响因素分析 基于1.2.1的优化条件进行两个八仙花品种花色苷的提取;花色苷的理化稳定性分析参照贾洪菊(2011)和昝立峰等(2017)的方法并略作修改。为排除金属离子和糖类改变花色苷结构而影响最大吸收波长,先在500~600 nm波长范围内进行各处理组扫描,根据吸光度A确定最大吸收波长。
1.2.3.1 温度对花色苷稳定性的影响 利用紫外-可见分光光度计测定室温条件下花色苷提取液的吸光度A0;将花色苷提取液分别置于30~100 ℃水浴锅中加热1 h,测定最大吸收波长处的吸光度AT,计算保存率并绘制成图。
保存率(%)=( AT/A0)×100(3)
式中:AT为在温度T下处理1 h后的吸光度;A0为室温下的吸光度。
1.2.3.2 光照对花色苷稳定性的影响 将花色苷提取液置于室内自然光(光照强度为1 000 Lx)和黑暗(黑布包裹)环境下,于0、1、2、4、8、16 d后测定最大吸收波长处的吸光度,计算保存率并绘制成图。
保存率(%)=( At/A0)×100(4)
式中:At为在时间t时的吸光度;A0为在时间0时的吸光度。
1.2.3.3 金属离子对花色苷稳定性的影响 向花色苷提取液中加入等体积的4个浓度(0、10、30、90 mmol·L-1)MgCl2、CaCl2、AlCl3、CuCl2溶液,观察溶液颜色变化并测定最大吸收波长处的吸光度,计算保存率并绘制成图。
保存率(%)=( Ac/A0)×100(5)
式中:Ac为加入浓度为c的金属离子溶液后的吸光度;A0为等体积纯水后的吸光度。
1.2.3.4 糖类对花色苷稳定性的影响 向花色苷提取液中加入等体积的不同质量分数(0、2%、4%、6%、8%和10%)葡萄糖、麦芽糖、蔗糖、半乳糖和鼠李糖溶液,观察溶液颜色变化并测定最大吸收波长处的吸光度,计算保存率并绘制成图。
保存率(%)=( Ac/A0)×100(6)
式中:Ac为加入质量分数为c的糖类溶液后的吸光度;A0为加入等体积纯水后的吸光度。
1.3 数据分析
每个处理进行3次生物学重复。采用Microsoft Office Excel 2016软件进行数据整理、分析,采用IBM SPSS Statistics 25 软件进行正交试验极差分析、方差分析和估算边际平均值计算,采用GraphPad Prism 8软件绘图。
2 结果与分析
2.1 两个八仙花品种花色苷超声波法最佳提取条件的优化
表2-4结果表明,处理组合1(60%乙醇+1∶20料液比+20 min提取时间)为正交试验中的最佳提取条件,‘蒂亚娜和‘拉维布兰八仙花花色苷含量最高可达63.678 μg·g-1 FW和149.177 μg·g-1 FW;3个提取条件对花色苷提取量的影响顺序依次是料液比>提取时间>乙醇浓度。其中,料液比对花色苷含量的影响最大,达到极显著差异;提取时间的影响达到显著或极显著差异;乙醇浓度对‘蒂亚娜八仙花花色苷含量影响不显著。
由表2和表3可知,‘蒂亚娜八仙花花色苷的最优提取条件组合是A2B1C1,即乙醇浓度为70%,料液比为1∶20,提取时间为20 min;而‘拉维布兰八仙花花色苷提取的最优条件则是A3B1C1,即乙醇浓度为80%,料液比为1∶20,提取时间为20 min;与表2的差异在于乙醇浓度由60%提高至80%。依据图2估算的最优组合条件进行3次重复性验证并取平均值,測得‘蒂亚娜的花色苷含量为70.135 μg·g-1 FW,‘拉维布兰的花色苷含量高达153.630 μg·g-1 FW,均超过了表2中已知的最佳组合A1B1C1,验证了估算结果的正确性。
2.2 两个八仙花品种花色苷的组分鉴定
根据紫外-可见光谱吸收特征,在520 nm处检测得1种花色苷类物质;利用花色苷混合标准品和UPLC-Q-TOF-MS鉴定为飞燕草素-3-O-葡萄糖苷(图3)。说明这两种八仙花的花色苷组分无差异,均只含飞燕草素-3-O-葡萄糖苷。
2.3 离体条件下4种因素对两个八仙花品种花色苷理化稳定性的影响
基于2.1正交试验筛选出的最佳提取条件 (70% 和80%乙醇浓度,1∶20料液比,20 min提取时间),获得‘蒂亚娜和‘拉维布兰八仙花花色苷提取液;利用单因素随机区组实验设计研究4种因素(温度、光照和添加金属离子、糖分)对花色苷理化稳定性的影响。
2.3.1 温度 以室温下的八仙花提取液中的花色苷保存率为100% (对照),‘蒂亚娜和‘拉维布兰八仙花提取液中的花色苷在30~100 ℃保存率变化趋势基本相同,如图4所示。在≤40 ℃水浴中放置1 h时保持稳定,在40~70 ℃范围内略有下降,当温度≥ 80 ℃时则迅速下降至100 ℃差异不显著,表明两个品种八仙花的花色苷热稳定性相近,并随着温度的升高稳定性下降,其中以70 ℃以下保存最为适宜。
2.3.2 光照条件 如图5所示,不论是光照还是避光条件下,两个八仙花品种的花色苷保存率均随时间延长呈下降趋势,而‘蒂亚娜明显高于‘拉维布兰,表明花色不可调的‘蒂亚娜 的花色苷较花色可调的‘拉维布兰更稳定。两个八仙花品种的花色苷避光保存时的保存率显著高于自然光照,其中‘蒂亚娜花色苷避光保存16 d时的保存率比室内自然光照下高出16.92%,而‘拉维布兰则高出44.11%,表明花色可调的‘拉维布兰较花色不可调的‘蒂亚娜 花色苷对光照更敏感。
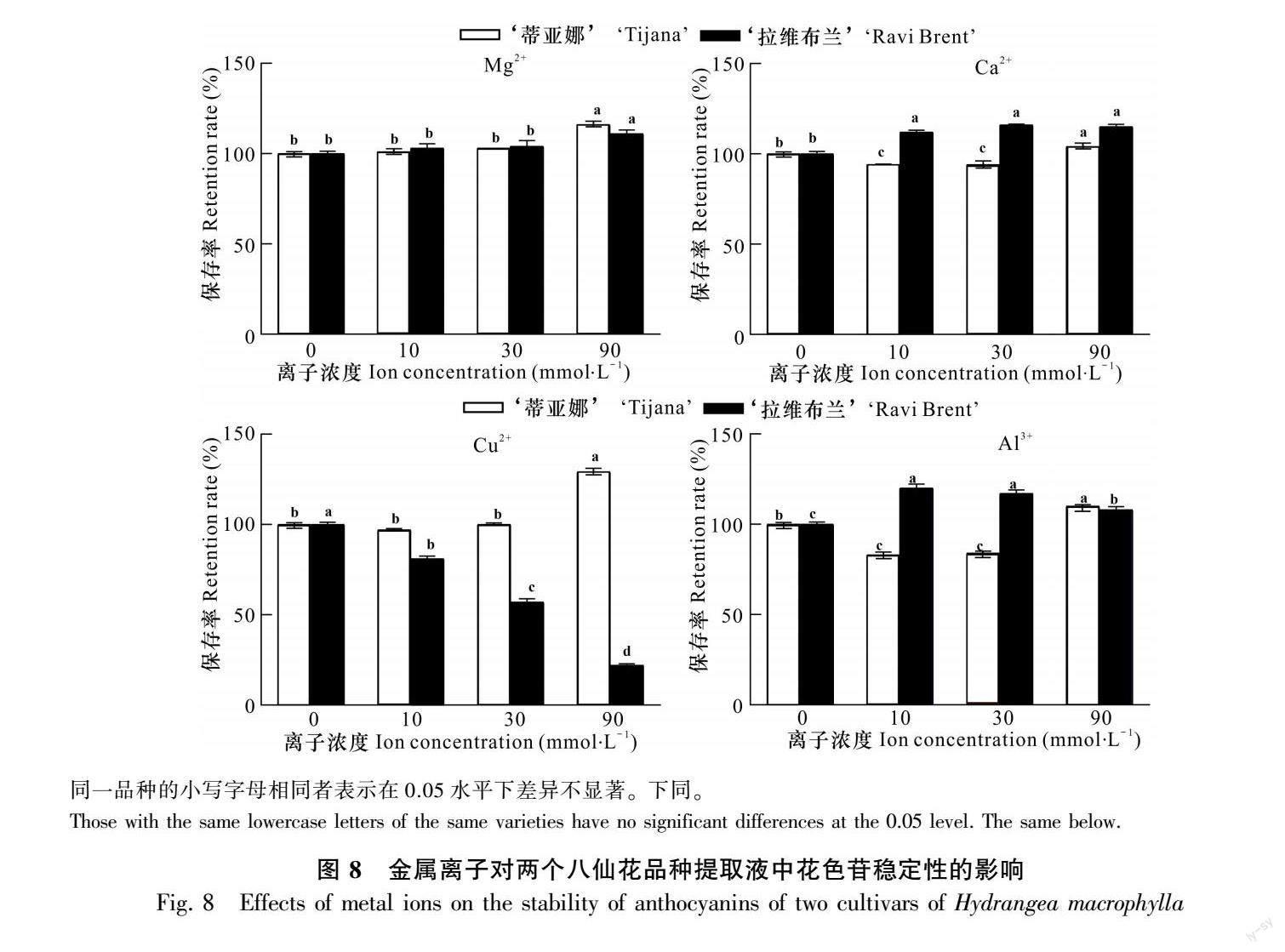
2.3.3 金属离子 向两个八仙花品种的花色苷提取液中加入等体积90 mmol·L-1 MgCl2、CaCl2、AlCl3和CuCl2溶液,观察金属离子对花色苷颜色的影响。只有加入Cu2+ 后才会由粉色变为绿色;加入Al3+ 会使‘蒂亚娜提取液由浅粉色变为黄色,‘拉维布兰提取液由深粉色变为蓝紫色(表5)。
由于花色苷类物质的最大吸收波长一般在500~600 nm范围内,因此在500~600 nm波长范围内对处理后的两种八仙花花色苷提取液进行全波长扫描,以确定最大吸收波长并测量吸光度,结果如图6所示,‘蒂亚娜(花色不可调)提取液加入Mg2+ 后最大吸收波长仍为560 nm;而加入Ca2+、Cu2+ 和Al3+ 后,最大吸收波长均为565 nm。
花色可调的‘拉维布兰八仙花提取液中的花色苷在加入Mg2+ 和Ca2+ 后最大吸收波长没有改变,仍为540 nm,但加入Cu2+ 后吸光度维持在一个较低的水平且无明显的吸收峰,表明花色苷与Cu2+螯合使其共轭体系发生了改变,吸收波长也发生了改变,从而使颜色发生改变;加入Al3+ 后长波方向的吸收范围增大导致提取液呈蓝色(图7),这一结果与表5的观察结果相一致。
由图8可知,4种金属离子对两种八仙花花色苷稳定性的影响具有差异性。高浓度(90 mmol·L-1)Mg2+ 和Ca2+ 均有助于提高两者的稳定性;
Al3+ 对‘蒂亚娜花色苷稳定性的影响呈现先降低、后升高的变化趋势,显著提升了‘拉维布兰八仙花花色苷的稳定性。Cu2+ 对两者的影响效果恰恰相反,其中高浓度时可显著提高‘蒂亚娜的花色苷稳定性,而使‘拉维布兰八仙花花色苷的稳定性降至最低,表明Cu2+ 可特异性地提升‘蒂亚娜花色苷的稳定性。
2.3.4 糖类 加入5种糖类后两个八仙花品种的花色苷溶液颜色均不变;对其进行500~600 nm波长范围内的全波长扫描发现,只有加入葡萄糖溶液才使‘蒂亚娜提取液的最大吸收波长变为565 nm;其他条件下的最大吸收波长仍保持在540 nm。添加5种糖类对‘蒂亚娜八仙花花色苷的稳定性整体优于‘拉维布兰八仙花;葡萄糖、麦芽糖、蔗糖、半乳糖和高浓度(8%~10%)鼠李糖均可以增加花色不可调的‘蒂亚娜八仙花花色苷的稳定性;除中高浓度(4%~10%)鼠李糖促进花色可调的‘拉维布兰八仙花花色苷的稳定性、高浓度(10%)半乳糖破坏其稳定性外,其他3种糖类对此均无影响(图9)。
3 讨论与结论
本研究首先利用正交试验设计优化了八仙花花色苷提取条件,确定了超声波法提取花色苷的最优条件是‘蒂亚娜为乙醇(pH 2.0)浓度70%,料液比1∶20,提取时间20 min;‘拉维布兰为乙醇(pH 2.0)浓度80%,料液比1∶20,提取时间20 min,这与刘晓东等(2011)同类研究相比耗时更短,效率更高。此外,提取温度、pH值和提取方法等均会影响花色苷含量,后续可以通过增加多因素、多水平正交试验设计进一步优化提取方法。
本研究利用液-质联用法从两个八仙花品种的花色苷提取液中只鉴定出飞燕草素-3-O-葡萄糖苷,而龚仲幸等(2017)以矢车菊-3,5-双葡萄糖苷为外标,通过液-质联用法在‘蓝色妈妈八仙花中检测到了芍药花素-3-葡萄糖苷、飞燕草素-3-葡萄糖苷、飞燕草素-3-戊糖-5-葡萄糖苷等12种花色苷, 推测这一结果差异除了受设备检测条件、添加花色苷混合标样的最低检出限影响以外,还可能与采集的八仙花品种、生境与发育阶段有关。
两个八仙花品种具有相同的花色苷主组分,由此判定花色可调性不仅与花色苷种类有关,更重要的是受其结构、稳定性及呈色条件影响。本研究中,两个八仙花品种的花色苷在70 ℃以下均具有较好的热稳定性,在温度≤ 70 ℃保存效果更好,这与贾洪菊(2011)的研究结论一致。这是因为高温会促进花色苷结构中糖苷的水解,使其失去对花色素的保护作用,从而加速花色素的降解(Laleh et al., 2006)。本研究中,八仙花花色苷在避光条件下保存率更高。在粗梗稠李(Padus napaulensis)(李晓娇等,2020)、白杜(Euonymus maackii)(宋鹏等,2019)等花色苷中也有类似的发现。这是由于光照下花色苷降解符合一级动力学反应,因此比避光条件下的降解显著加快(Ochoa et al., 2001)。但是,花色可调的‘拉维布兰八仙花花色苷较花色不可调的‘蒂亚娜对光照更敏感,可见花色可调的八仙花花色苷结构更不稳定。本研究中,葡萄糖、麦芽糖、蔗糖、半乳糖和高浓度(8%~10%)鼠李糖均可以增加花色不可调的‘蒂亚娜八仙花花色苷的稳定性,只有中高浓度(4%~10%)鼠李糖才促进花色可调的‘拉维布兰 八仙花花色苷的稳定性。这表明花色可调的八仙花花色苷较花色不可调者更不稳定。
当‘拉维布兰八仙花花色苷加入中低浓度(10~30 mmol·L-1)Al3+ 后,花色苷稳定性显著提高,颜色由粉色变为蓝色;而 ‘蒂亚娜无此顏色变化,这可能是导致两个八仙花品种花色可调性存在差异的根本原因。Kosaku等(1985,1990)早期研究发现,3-咖啡酰奎尼酸或3-对-香豆酰基奎宁酸能够与Al3+ 和飞燕草素-3-葡萄糖苷在体外形成蓝色络合物;Oyama等(2015)的研究也佐证了这一推测,飞燕草素-3-O-葡萄糖苷与Al3+ 形成了蓝色的复合物,使得部分八仙花萼片由粉色转变为蓝色。在花色不可调的‘蒂亚娜八仙花中,飞燕草素-3-O-葡萄糖苷可能更稳定且不易与Al3+ 结合,使花色始终保持粉色;而在花色可调的‘拉维布兰八仙花中,飞燕草素-3-O-葡萄糖苷可能更易与Al3+ 螯合形成更稳定的蓝色络合物,使花色由粉色转变为蓝色。
由于本研究仅局限于体外花色苷提取液的部分稳定性影响因素的单一实验,因此研究还有待于通过多因素正交试验设计验证各因素间的交互作用,以及在室外盆栽试验或园林景观绿化工程中开展环境条件与花色苷形成、稳定性及花色可调性机制的研究,才能为开发八仙花花色可调性提供更加坚实的科学依据。
参考文献:
DENG YM, HAN Y, QI XY, et al., 2018. Analysis on germplasm resources of species in Hydrangea Linn. and comparisons on their flower color variability and resistance to leaf-spot disease [J]. J Plant Resour Environ, 27(4): 90-100.[邓衍明, 韩勇, 齐香玉, 等, 2018. 绣球属植物种质资源分析及其花色可调性和叶斑病抗性比较 [J]. 植物资源与环境学报, 27(4): 90-100.]
DIAO CW, HU B, HAN Y, et al., 2017. Preliminary study on the effect of Al3+ on the color of sepals of different Hydrangea varieties [J]. Shanghai Veget, (4): 77-78.[刁春武, 胡波, 韩勇, 等, 2017. Al3+ 对不同八仙花品种萼片颜色的影响初探 [J]. 上海蔬菜, (4): 77-78. ]
FULEKI T, FRANCIS FJ, 1968. Quantitative methods for anthocyanins. 4. determination of individual anthocyanins in cranberry and cranberry products [J]. J Food Sci, 33(5): 471-478.
GONG ZX, HE Y, YANG J, et al., 2017. Mechanism of exogenous Al2(SO4)3 on regulating the anthocyanin concentration in Hydrangea macrophylla petal [J]. J Plant Nutr Fertil, 23(3): 821-826.[龚仲幸, 何勇, 杨静, 等, 2017. 外源硫酸铝调节八仙花花青苷组成和含量变化的分子生物学机制 [J]. 植物营养与肥料学报, 23(3): 821-826. ]
JIA HJ, 2011. A research on red Hydrangea macrophylla molecular structure and application in pressed flower protecting [D]. Harbin: Northeast Forestry University.[贾洪菊, 2011. 八仙花红色素分子结构分析及在压花上应用 [D]. 哈尔滨: 东北林业大学.]
KODAMA M, TANABE Y, NAKAYAMA M, 2016. Analyses of coloration-related components in Hydrangea sepals causing color variability according to soil conditions [J]. Hortic J,85(4): 372-379.
KOSAKU T, MIYUKI K, HIDEAKI I, 1985. Blueing of sepal color of Hydrangea macrophylla [J]. Phytochemistry, 24(10): 2251-2254.
KOSAKU T, TOMOKO Y, AKIHISA T, et al., 1990. Stable blue complexes of anthocyanin-aluminium-3-p-coumaroyl- or 3-caffeoyl-quinic acid involved in the blueing of Hydrangea flower [J]. Phytochemistry, 29(4): 1089-1091.
LALEH GH, FRYDOONFAR H, HEIDARY R, et al., 2006. The Effect of light, temperature, pH and species on stability of anthocyanin pigments in four berberis species [J]. Paki J Nutr, 5: 90-92.
LI X, SIDDIQUE F, SILVA G, et al., 2019. Quantum chemical evidence for the origin of the red/blue colors of Hydrangea macrophylla sepals [J]. N J Chem, 43: 7532-7540.
LI XJ, HE JM, HAN DX, et al., 2020. Study on the extraction, physical and chemical properties and stability of anthocyanins from Padus napaulensis [J]. Food Ferment Ind, 46(15): 208-215.[李曉娇, 何健民, 韩德仙, 等, 2020. 粗梗稠李中花色苷的提取及其理化性质和稳定性研究 [J]. 食品与发酵工业, 46(15): 208-215. ]
LIU XD, JIA HJ, LIU XH, 2011. Red pigment extracted from Hydrangea paniculate and its stability [J]. J NE For Univ, 39(5): 62-63.[刘晓东, 贾洪菊, 刘香环, 2011. 圆锥八仙花红色素提取及稳定性 [J]. 东北林业大学学报, 39(5): 62-63.]
OCHOA MR, KESSELER AG, DE MA, et al., 2001. Kinetics of colour change of raspberry, sweet (Prunus avium) and sour (Prunus cerasus) cherries preserves packed in glass containers: light and room temperature effects [J]. J Food Eng, 49(1): 55-62.
OYAMA K, YAMADA T, ITO D, et al., 2015. Metal complex pigment involved in the blue sepal color development of Hydrangea [J]. J Agric Food Chem, 63: 7630-7635.
SCHREIBER HD, JONES AH, LARIVIERE CM, et al., 2011. Role of aluminum in red-to-blue color changes in Hydrangea macrophylla sepals [J]. Biometals, 24(6): 1005-1015.
SONG P, DING YF, XU ZH, et al., 2019. Studies on extraction, stability and composition of anthocyanins from leaves of Euonymus maackii [J]. N Hortic, (24): 81-87.[宋鹏, 丁彦芬, 徐子涵, 等, 2019. 丝棉木叶片花色苷的提取、稳定性和成分研究 [J]. 北方园艺, (24): 81-87.]
PARK S, ARASU MV, NAN J, et al., 2014. Metabolite profiling of phenolics, anthocyanins and flavonols in cabbage (Brassica oleracea var. capitata)[J]. Ind Crops Products, 60: 8-14.
SUN W, LI CH, WANG LS, et al., 2010. Analysis of anthocyanins and flavones in different-colored flowers of chrysanthemum [J]. Chin Bull Bot, 45(3): 327-336.[孫卫, 李崇晖, 王亮生, 等, 2010. 菊花不同花色品种中花青素苷代谢分析 [J]. 植物学报, 45(3): 327-336.]
XU WX, LIU J, 2020. Optimization of Ultrasonic-assisted extraction process of pigment from flowers of Robinia pseudoacacia L.[J]. Sci Technol Food Ind, 41(10): 157-162.[徐文秀, 刘俊, 2020. 超声波辅助提取紫槐花色素工艺优化 [J]. 食品工业科技, 41(10): 157-162.]
YANG J, SHEN WH, ZHANG RJ, et al., 2019. Study on the regulation and control of Hydrangea flower color by aluminum sulfate [J]. Shanghai Agric Sci Technol, (3): 82-83.[杨娟, 沈卫红, 张睿婧, 等, 2019. 硫酸铝对八仙花花色的调控研究 [J]. 上海农业科技, (3): 82-83.]
YOSHIDA K, D I, MIKI N, et al., 2021. Single-cell analysis clarifies mosaic color development in purple Hydrangea sepal [J]. New Phytol, 229(6): 3549-3557.
YU JJ, TANG DQ, LI X, 2020. Anthocyanin compositions in petals of Freesia hybrida [J]. Guihaia, 40(5): 687-695.[郁晶晶, 唐东芹, 李欣, 2020. 香雪兰花瓣的花色苷组成 [J]. 广西植物, 40(5): 687-695.]
ZAN LF, WANG GX, YE J, et al., 2017. Optimization of extraction process and stability of yellow thorn rose anthocyanin [J]. Jiangsu Agric Sci, 45(22): 221-224.[昝立峰, 王更先, 叶嘉, 等, 2017. 黄刺玫花色素的提取工艺优化及其稳定性 [J]. 江苏农业科学, 45(22): 221-224.]
ZUO Y, TIAN F, 2014. The direction of research and development of the stability of anthocyanins [J]. Cereals Oils, 27(7): 1-5.[左玉, 田芳, 2014. 花青素稳定性研究进展 [J]. 粮食与油脂, 27(7): 1-5.]
(责任编辑 李 莉)
