细叶鼠曲草总黄酮提取工艺研究
2017-03-28杨雪鸥杨露茜袁涛余正文张林
杨雪鸥 杨露茜 袁涛 余正文 张林


摘要:提取细叶鼠曲草(Gnaphalium japonicum Thunb)总黄酮,比较传统水溶性提取与超声提取总黄酮的工艺差异,并通过单因素和正交试验优化细叶鼠曲草總黄酮提取工艺。结果表明,超声醇提效果较好,条件为超声时间30 min、乙醇体积分数80%、提取温度60 ℃、料液比1∶30(g/mL),提取总黄酮含量为2 mg/g。
关键词:细叶鼠曲草(Gnaphalium japonicum Thunb);总黄酮;超声提取;正交试验
中图分类号:TQ461 文献标识码:A 文章编号:0439-8114(2017)04-0712-04
细叶鼠曲草(Gnaphalium japonicum Thunb)为菊科鼠曲草属植物,鼠曲草属植物全世界共有200多种,分布广泛,资源蕴藏量大。中国鼠曲草属植物有20余种[1],在民间有相当长的使用史,俗称“面蒿”、“清明菜”,是具有浓郁民族资源特色的食品[2];同时也是丰富的药用资源,广泛用于痛风、炎症、痈疮肿毒、肠炎痢疾、活血止血等病症[3-6],细叶鼠曲草就是其中的一种。细叶鼠曲草主要分布在中国长江以南的地区,贵州省江口、贵阳、平塘、荔波、雷山均有分布,生长在海拔780~1 200 m的山坡阳处草地,全草入药,性甘平,清热利湿,解毒清肿,主治结膜炎、咽喉肿痛、尿道炎[7];畲族同胞常用于治疗肝炎疾病,疗效显著[8]。前人的研究表明,鼠曲草属植物的主要化学成分为黄酮和二萜类[9-11]。尚未见细叶鼠曲草提取纯化相关化学成分方面的研究报道。本研究首次通过筛选细叶鼠曲草总黄酮提取工艺,获得提取优化工艺条件,为今后进一步分离纯化细叶鼠曲草总黄酮获得有效成分提供参考,也为该资源的深入开发利用创造条件。
1 材料与方法
1.1 试验仪器与材料
721型紫外分光光度计(天津冠泽科技有限公司);HB-10250型数控超声仪(江苏汉邦科技有限公司);BS210S型电子天平(北京赛多利斯天平股份公司);EYELA N-1100型旋转蒸发仪(倍捷科技有限公司)。
细叶鼠曲草采集于贵州省江口县,经贵州省农业植物鉴定专家孟祥顺鉴定为菊科植物细叶鼠曲草;芦丁由中国药品生物制品检定所提供;其他试剂均为分析纯。
1.2 试验方法
1)细叶鼠曲草的提前处理。取细叶鼠曲草样品于60 ℃烘箱中干燥3 h,粉碎后移入干燥器中保存待用。
2)细叶鼠曲草总黄酮提取方法考察。细叶鼠曲草粉末→60%乙醇浸泡0.5 h→回流3次,合并滤液,回收乙醇→定容→供试液A。细叶鼠曲草粉末→60%乙醇浸泡0.5 h→超声3次,合并滤液,回收乙醇→定容→供试液B。细叶鼠曲草粉末→蒸馏水浸泡0.5 h→回流3次,合并滤液→定容→供试液C。细叶鼠曲草粉末→蒸馏水浸泡0.5 h→超声3次,合并滤液→定容→供试液D。
3)测定波长的选择。精密量取供试品溶液和对照品溶液适量,按标准品的方法进行显色,在波长为200~800 nm处对供试样品溶液和对照品溶液扫描。供试品和对照品均在510 nm处有最大吸收峰,故确定510 nm为测定波长。
4)标准曲线的绘制。精密移取芦丁1 mg/mL对照品溶液0.2、0.3、0.4、0.5、0.6 mL置于5个10 mL的量瓶中,加入5%亚硝酸钠溶液1 mL,摇匀并放置6 min,加入10%硝酸铝溶液1 mL,摇匀并放置6 min,加入4%氢氧化钠溶液4 mL,加入60%乙醇至刻度,摇匀并放置15 min,以60%乙醇溶剂为空白对照,于510 nm处测定吸光度。以芦丁含量为横坐标,吸光度为纵坐标作图,计算线性回归方程为y=0.147x+0.086,R2=0.992(n=5),结果显示芦丁浓度在20~60 μg/mL时具有良好线性关系。
5)细叶鼠曲草总黄酮含量的检测。取供试液用60%乙醇定容至100 mL,取1 mL按标准品方法显色,测定吸光度,并根据标准曲线计算样品中总黄酮含量,即总黄酮含量=提取物总黄酮质量/细叶鼠曲草质量。
6)单因素试验。选择适宜的溶剂和提取方法,对影响细叶鼠曲草总黄酮提取的可能因素,包括超声时间、乙醇体积分数、提取温度和料液比4个因素进行考察。在此过程中,以所得提取液的总黄酮含量作为考察指标,考察单因素对细叶鼠曲草总黄酮提取工艺的影响。
7)正交试验。为全面考察影响因素,优化黔细叶鼠曲草中总黄酮的工艺提取条件,在单因素试验的基础上,选定超声时间(A)、乙醇体积分数(B)、提取温度(C)、料液比(D)为考察因子,每个因素各取3个水平,按L9(34)正交表进行正交试验(表1),以细叶鼠曲草总黄酮含量为考察指标,确定最佳工艺条件。
8)验证试验。为进一步验证最佳工艺的可靠性,以优化工艺进行细叶鼠曲草总黄酮提取试验,重复3次,测定获取细叶鼠曲草总黄酮的含量。
2 结果与分析
2.1 提取工艺优选
分别称取药材2 g,加50倍量60%乙醇,浸泡0.5 h,进行回流提取和超声提取各3次,合并回收乙醇至无醇味,用60%乙醇定容于100 mL量瓶中,得供试液A和B。分别称取药材2 g,加50倍量蒸馏水,浸泡0.5 h,进行回流提取和超声提取各3次,合并回收乙醇至无醇味,用60%乙醇定容于100 mL量瓶中,得供试液C和D。结果显示乙醇超声提取优于其他方法,故选择乙醇超声提取作为总黄酮提取的方法(表2)。
2.2 单因素水平的确定
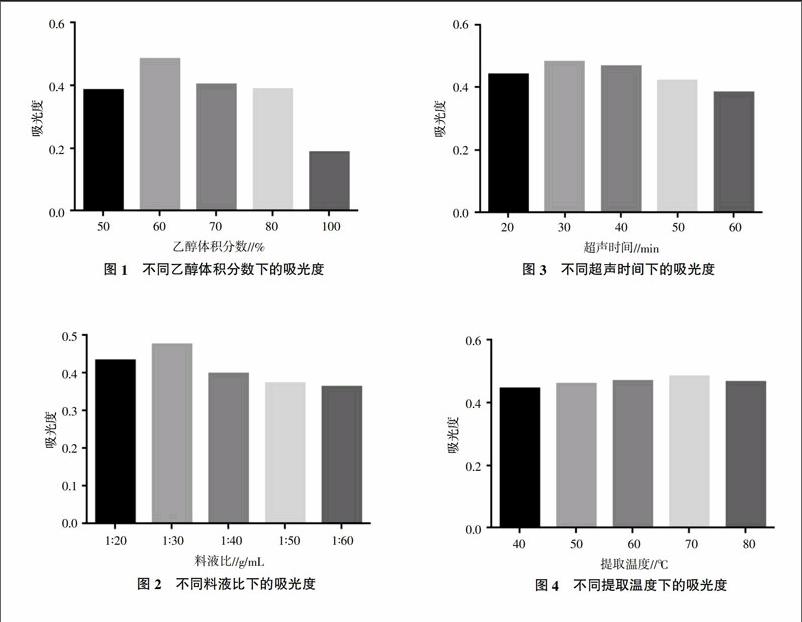
2.2.1 乙醇体积分数 分别准确称取2 g干燥的黔细叶鼠曲草粉末5份,分别加入50%、60%、70%、80%、100%的乙醇溶液各60 mL,在温度70 ℃、100 W超声波功率的条件下超声30 min,抽滤,定溶到100 mL,每次取1 mL,按标准品的方法进行显色测其吸光度(图1)。由图1可知,乙醇体积分数增加有利于提取含量的增高,但不是越高越好。随着乙醇体积分数的提高,细叶鼠曲草总黄酮含量得以提高。当乙醇体积分数达到60%时,提取总黄酮含量达最大值,继续增加乙醇体积分数,提取总黄酮含量增加不显著。当乙醇体积分数大于80%时提取总黄酮含量迅速降低,其原因可能是乙醇体积分数大于80%时,提取液杂质增加,溶液颜色变深,干扰紫外检测因素增加。因此,筛选乙醇体积分数60%~80%的范围作为进一步优化范围。
2.2.2 料液比 分别准确称取2 g干燥的黔细叶鼠曲草粉5份,按1∶20、1∶30、1∶40、1∶50、1∶60(g/mL,下同)的料液比加入乙醇溶液,在70 ℃、100 W超声功率的条件下超声30 min,抽滤,定容到100 mL,每次取1 mL,按标准品方法显色,测定吸光度(图2)。由图2可知,适当增加溶剂有利于细叶鼠曲草总黄酮的溶出,当料液比达到1∶30时,提取细叶鼠曲草总黄酮效果最好;然而继续增加溶剂用量,提取总黄酮含量有所下降,究其原因可能与杂质含量随溶剂量增加而增大有关,并且溶剂量的增大势必增大工艺提取成本,造成浪费。因此综合考虑各方面因素,选择料液比1∶20~1∶40作为进一步优化的范围。
2.2.3 超声时间 准确称取2 g干燥的鼠曲草粉5份,分别加入60 mL 60%乙醇,在70 ℃、100 W超声波功率的条件下分别提取20、30、40、50、60 min,抽滤,定容,按标准品显色方法测定吸光度(图3)。由图3可知,超声时间控制在30 min左右,所提细叶鼠曲草总黄酮含量达到最大,当超声时间超过30 min,提取总黄酮含量有所下降。因此筛选超声时间20~40 min作为进一步优化的范围。
2.2.4 提取溫度 分别准确称取2 g干燥的鼠曲草粉5份,分别加入60 mL 60%乙醇,在70 ℃、100 W的超声条件下分别于30、40、50、60、70 ℃超声30 min,抽滤,定容到100 mL,每次取1 mL,按标准品显色方法测定吸光度(图4)。由图4可知,适当提高提取细叶鼠曲草的温度,有利于总黄酮的溶出。温度的增加,有利于溶剂分子的热运动,增加渗透扩散溶出的速度,提高了总黄酮的浓度,且温度控制在70 ℃时提取效果最好,当温度进一步提升,将增加细叶鼠曲草其他杂质的溶出,降低总黄酮含量。因此,选择提取温度60~80 ℃作为进一步优化的范围。
2.3 正交试验设计及分析
为综合考察细叶鼠曲草总黄酮提取工艺影响因素的交叉效果,根据上述单因素试验结果及参考相关资料,确定以超声时间(A)、乙醇体积分数(B)、提取温度(C)和料液比(D)4个考察因素考察药材总黄酮含量,采用L9(34)正交表进行设计。由表3、表4可知,各因素对细叶鼠曲草总黄酮提取影响的顺序为C>A>B>D,即提取温度>超声时间>乙醇体积分数>料液比。并且提取温度对提取细叶鼠曲草总黄酮有显著影响,其他3个因素对结果的影响不显著。因此,通过比较试验结果,筛选出的最优试验条件为超声时间30 min、乙醇体积分数80%、提取温度60 ℃、料液比1∶30。
2.4 验证试验
精密称取细叶鼠曲草2 g,共3份,按最佳工艺提取,药液过滤,浓缩,定容于100 mL量瓶中。精密量取提取液1 mL定容于10 mL量瓶中,按照标准品显色方法测定吸光度,按照结果显示最佳工艺提取3组药液,所得细叶鼠曲草总黄酮吸光度为0.542、0.481、0.530,平均含量2 mg/g,试验结果高于正交试验其他组合,所得试验结果稳定可行。
3 小结与讨论
细叶鼠曲草作为一种贵州省民间药食两用的植物流传甚广,主要成分为黄酮和二萜类,然而目前深入研究开发的报道不多,仅局限于生药学、理化性质鉴定等方面[7]。本试验开创性地对细叶鼠曲草总黄酮提取工艺进行了研究,取得了一定的成果。通过正交试验,得到细叶鼠曲草在提取时间30 min、乙醇体积分数80%、提取温度60 ℃、料液比1∶30时提取效果最好,所得总黄酮含量为2 mg/g。另外,继续筛选其他方法提取细叶鼠曲草总黄酮,不失为提高提取条件的优良策略。比如微波提取法、碱性(酸性)稀醇提取法、酶法提取、热压流体萃取、超临界流体萃取等。
参考文献:
[1] 祁承经,喻勋林.湖南种子植物总览[M].长沙:湖南科学技术出版社,2002.
[2] 张慧颖,孙 赟,饶高雄.鼠曲草属药用植物化学成分及药理作用研究进展[J].中国民族民间医药,2012,8(15):60-63.
[3] LIN W Q,XIE J X,WU X M. Inhibition of xanthine oxidase activity by Gnaphalium affine extract[J].Chinese Medical Science,2014,29(4):225-230.
[4] HUANG D D,CHEN Y H,CHEN W S,et al. Anti-inflammatory effects of the extract of Gnaphalium affine D. Don in vivo and in vitro[J].Ethnopharmacology,2015,176:356-364.
[5] XI Z X,CHEN W S,WU Z J,et al.Anti-complementary activity of flavonoids from Gnaphalium affine D. Don[J].Food Chemistry,2012,130(1):165-170.
[6] 中国医学科学院药物研究所.中药志(第四册)[M].北京:人民卫生出版社,1988.
[7] 陈艺林,石 铸.贵州植物志(第九卷)[M].成都:四川民族出版社,1989.
[8] 胡 恩,陈坤全,陈清容.治平畲族乡畲族同胞常用于治疗肝炎的中草药简介[J].中国民族民间医药杂志,2006(3):159-160.
[9] 江苏省植物研究所.新华本草纲要(第三册)[M].上海:上海科学技术出版社,1990.
[10] TAMARA L,MERAGELMAN,GLORIA L,et al. Ent-pimarane type diterpenes from Gnaphalium gaudichaudianum[J].Phytochemistry,2003,62:569-572.
[11] RUBEN T,JULIO P,JORGE R,et al.Diterpenes from Gnaphalium pellitum and Gnaphalium graveolens[J].Phytochemistry,1992,7(31):2415-2418.
