超低温保存处理对水曲柳胚胎生理生化特征的影响
2023-05-21徐添添沈海龙
任 悦 魏 骋 徐添添 沈海龙 杨 玲
(林木遗传育种国家重点实验室 东北林业大学林学院,哈尔滨 150040)
水曲柳(Fraxinus mandshurica)为木樨科(Oleaceae)落叶乔木,是我国东北重要的用材树种之一。水曲柳用合子胚作为外植体诱导获得愈伤组织的悬浮体系已初步建立,但愈伤组织随着继代次数增加,逐渐褐变并死亡[1]。目前研究中存在胚性愈伤组织可能会因长期继代而造成体细胞变异等问题,因此筛选有效的低温保存方法至关重要。
超低温保存是种质资源得以长期保存的重要技术保障,其在植物遗传材料保存中的应用非常广泛。植物胚胎是植物遗传资源延续的良好载体。经过快冻法低温保存的辐射松(Pinus radiate)合子胚子叶在组织培养中作为外植体的不定芽诱导效果与保存前无差别[2]。建立植物胚胎高效稳定的超低温保存体系可以避免在长期组织培养中出现的变异现象,维持胚胎的增殖能力和萌发能力,实现优良种质资源的长期保存[3-4]。为了全面提高胚性愈伤组织保存时间,梁雪等[5]初步建立了水曲柳胚性愈伤组织超低温保存体系,Yu 等[6]用玻璃化法使愈伤组织细胞存活率高达61.94%,用慢冻法使愈伤组织细胞存活率高达80.82%。对水曲柳优良胚性细胞系的保存迫在眉睫,而相关的超低温保存技术还需进一步优化。
参考前人对水曲柳胚性愈伤组织的研究结果,本研究使用3种冷冻方式对水曲柳合子胚进行超低温处理,以得到最适宜合子胚的冷冻方式与脱水时间。通过对比水曲柳合子胚胎和体胚的超低温保存率,进一步以合子胚为材料测定了超低温保存前后的水曲柳合子胚细胞内重要抗性生理生化指标(脱氢酶、丙二醛、脯氨酸、可溶性蛋白、抗氧化酶)的变化,分析冷冻方式和脱水时间对合子胚的内在生理影响,为找到水曲柳合子胚和体胚的适宜的超低温保存方式提供了生理数据支撑,为水曲柳胚胎冷冻生理机制的探究和水曲柳资源长期稳定的保存奠定了理论基础。
1 材料与方法
1.1 试验材料
以2018年8月中旬在东北林业大学(45°43′16″N,126°37′55″E)校园内采集的水曲柳成年母树上未成熟且未经脱水的种子为材料。
切开未成熟种子取完整的合子胚备用。以未成熟合子胚子叶做为外植体,参照丛建民等[7]方法诱导获得体胚。
1.2 试验方法
1.2.1 胚胎脱水处理
将水曲柳未成熟合子胚分别于室温下干燥脱水0 min(未经脱水处理直接在液氮中冷冻)、40 min(脱水处理40 min 后置于液氮中)、80 min(脱水处理80 min后置于液氮中)、120 min(脱水处理120 min后置于液氮中)。
1.2.2 胚胎冷冻方法
参照Jekkel 等[8]的超低温保存方法处理水曲柳合子胚。在培养皿中垫一层干燥滤纸,将胚胎放置在培养皿中的滤纸上,每个培养皿放40 个胚(直径9 mm)。分别通过快冻法、慢冻法和玻璃化法处理装置在2 mL 冷冻管中的不同含水量的胚胎。在液氮中保存24 h[6]后取出冷冻管直接置于40 ℃水浴化冻,然后对比分析保存前后各生理指标的变化。3种冷冻方法的步骤如下。
快冻法:在0 ℃下,将不同含水量的合子胚分别装入冷冻管中,预冷1 h后立刻用液氮冷藏。
慢冻法:在0 ℃下,将不同含水量的合子胚分别装入冷冻管中,预冷1 h后,再于冷藏柜中-20 ℃冷藏2 h,之后转移到以-1 ℃/min速度降至-80 ℃的程序降温盒中保存4 h,再立刻将其投入液氮中保存。
玻璃化法:玻璃化保护剂是高浓度的复合冰冻保护剂,简称PVS。本研究使用30%甘油、15%聚乙二醇、15%二甲亚砜、0.4 mol·L-1蔗糖配制成保护剂,简称为PVS2;按照MS 液体培养基(蔗糖浓度为0.15 mol·L-1)和PVS2 溶液的体积比按2∶3配成60%PVS2。先在室温下用60%PVS2 处理不同含水量合子胚,时间为20 min,再在冰水混合物中用100% PVS2处理不同含水量合子胚0.5~3.0 h,将冷冻管装入纱布袋中,并迅速投入液氮(-196 ℃),保存24 h以上。
1.2.3 生理生化指标测定
将经过不同冷冻方法脱水不同时间的胚胎作为测试材料,以未经过脱水处理的胚胎作为对照,分别进行下列指标的测定:脱氢酶活性的测定采用分光光度法[9]。丙二醛(MDA)含量采用MDA检测试剂盒(TBA 荧光法)测定。脯氨酸含量利用脯氨酸快速测定法在520 nm 波长下比色,用回归方程计算脯氨酸含量[10]。可溶性蛋白含量利用考马斯亮蓝G-250 染色法测定[11]。超氧化物歧化酶(SOD)活性通过氮蓝四唑光化还原法测定,以U·g-1表示[12]。过氧化物酶(POD)活性利用愈创木酚法测定,以U·g-1·min-1表示[13]。过氧化氢酶(CAT)活性采用分光光度法测定,以U·g-1·min-1表示[14]。
1.3 数据统计与分析
数据统计采用Microsoft Excel 2007,使用SPSS软件中的双因素方差分析(two-way ANOVA)、邓肯多重极差检验法(Duncan,α=0.05)分别对生理生化指标数据进行处理,用Sigmaplot软件作图。
2 结果与分析
水曲柳未成熟合子胚和体胚经脱水处理120 min后快冻法保存24 h 后再经40 ℃水浴化冻,相对存活率分别为62.26%和51.68%。本文进一步以水曲柳合子胚作为材料进行的超低温保存对胚胎生理生化特征影响的分析结果如下。
2.1 脱水处理和冷冻方式对水曲柳合子胚脱氢酶(ADH)活性的影响
脱水时间、冷冻方式和二者的交互作用均影响水曲柳合子胚脱氢酶活性,且差异显著(P<0.05)。如图1 所示,未经脱水处理的合子胚(对照)脱氢酶活性随脱水时间延长而降低,在脱水120 min 时达到最低值。水曲柳合子胚经快冻法和慢冻法处理后,脱氢酶活性均随脱水时间的延长而增强,在脱水处理120 min 时达到峰值。但经玻璃化法处理的合子胚脱氢酶活性则在脱水处理80 min 时达到峰值。水曲柳合子胚经不同脱水时间低温保存后,脱氢酶活性按从低到高顺序是玻璃化法、慢冻法、快冻法。

图1 脱水时间和冷冻方式对超低温保存后水曲柳合子胚脱氢酶活性的影响不同小写字母表示同一时间、不同冷冻法之间差异显著(P<0.05);下同Fig.1 Effect of dehydration time and freezing method on ADH activity of F.mandshurica zygotic embryo after cryopreservationDifferent lowercase letters indicate significant differences among different freezing methods at the same time(P<0.05);the same as below
2.2 脱水处理和冷冻方式对水曲柳合子胚丙二醛(MDA)含量的影响
脱水时间、冷冻方式和二者的交互作用对水曲柳合子胚MDA含量影响显著(P<0.05)。未经脱水处理的合子胚(对照),MDA 含量随脱水时间延长而升高,在脱水120 min 时达到峰值。在经3 种冷冻方式处理后,水曲柳合子胚中MDA 含量均随脱水时间延长,呈先下降后升高趋势。除脱水120 min 处理外,快冻法保存的合子胚在其他3 个脱水时间处理下的MDA 质量摩尔浓度均为最低,且在脱水80 min时最低,为26.78 µmol·g-1(见图2)。

图2 脱水时间和冷冻方式对超低温保存后水曲柳合子胚丙二醛含量的影响Fig.2 Effect of dehydration time and freezing method on MDA content of F.mandshurica zygotic embryo after cryopreservation
2.3 脱水处理和冷冻方式对水曲柳合子胚脯氨酸含量的影响
水曲柳合子胚细胞内脯氨酸含量受脱水时间、冷冻方式和二者的交互作用影响,差异均达到显著水平(P<0.05)。对照的脯氨酸含量在前3 个时间梯度表现为递增,在脱水120 min 时出现下降。3 种冷冻方式保存的合子胚脯氨酸含量随脱水时间的延长均呈上升趋势,在脱水120 min 时达到峰值。对比3种冷冻方式,使用快冻法保存的合子胚在脱水120 min时脯氨酸质量分数达到最大值(394.99 µg·g-1),使用玻璃化法保存的合子胚在脱水0 min时脯氨酸质量分数最低,为47.39 µg·g-1(见图3)。
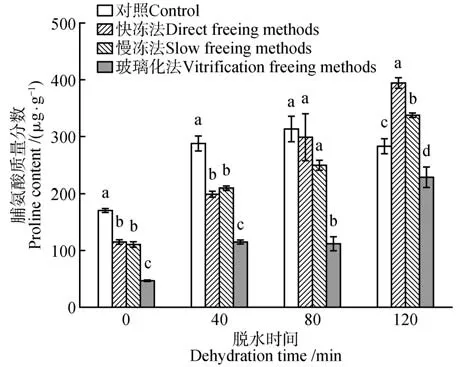
图3 脱水时间和冷冻方式对超低温保存后水曲柳合子胚脯氨酸含量的影响Fig.3 Effect of dehydration time and freezing method on proline content of F.mandshurica zygotic embryo after cryopreservation
2.4 脱水处理和冷冻方式对水曲柳合子胚可溶性蛋白含量的影响
超低温保存前和保存后,水曲柳合子胚细胞内可溶性蛋白含量受脱水时间、冷冻方式和二者的交互作用影响,差异均达到显著水平(P<0.05)。如图4 所示,与对照组相比,在不同脱水时间处理下,经快冻法冷冻保存后的合子胚细胞内可溶性蛋白含量均有所增加。经过脱水0、40、80 min 后,用不同冷冻方式保存的合子胚可溶性蛋白含量差异显著(P<0.05)。脱水80 min结合慢冻法保存时合子胚的可溶性蛋白质量分数最高,为20.12 mg·g-1,显著高于其他处理(P<0.05)。脱水处理为0 min、玻璃化法保存的合子胚的可溶性蛋白质量分数最低(16.21 mg·g-1)。

图4 脱水时间和冷冻方式对超低温保存后水曲柳合子胚可溶性蛋白含量的影响Fig.4 Effect of different dehydration time and freezing method on soluble protein content of F.mandshurica zygotic embryo after cryopreservation
2.5 脱水处理和冷冻方式对水曲柳合子胚超氧化物歧化酶(SOD)活性的影响
水曲柳合子胚SOD 活性受脱水时间的影响差异显著(P<0.05)。对照和慢冻法处理的合子胚SOD 活性随脱水时间延长而增强,在120 min 时达到峰值。快冻法和玻璃化法处理的合子胚SOD 活性随脱水时间延长呈先升高后降低趋势。脱水时间为120 min、经慢冻法保存后,水曲柳合子胚SOD 活性达到最大,为361.97 U·g-1,显著高于其他处理(P<0.05)(图5)。
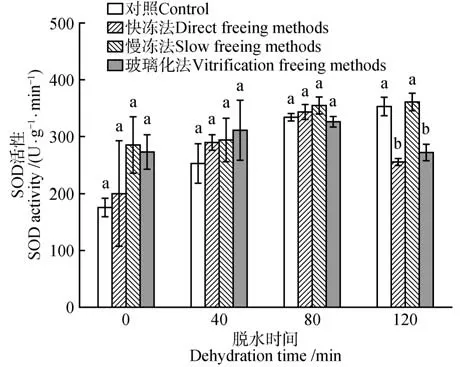
图5 脱水时间和冷冻方式对超低温保存后水曲柳合子胚SOD活性的影响Fig.5 Effect of dehydration time and freezing method on SOD activity of of F.mandshurica zygotic embryo after cryopreservation
2.6 脱水处理和冷冻方式对水曲柳合子胚过氧化物酶(POD)活性的影响
脱水时间、冷冻方式对水曲柳合子胚POD 活性影响的差异显著(P<0.05)。但脱水时间和冷冻方式的交互作用的影响不显著。不同冷冻方式保存下的合子胚的POD 活性均随脱水时间的延长呈增加趋势,在脱水处理120 min 时均达到峰值。其中脱水120 min、经快冻法保存后,合子胚的POD活性最大,为338.33 U·g-1·min-1,显著高于其他处理(P<0.05)(图6)。
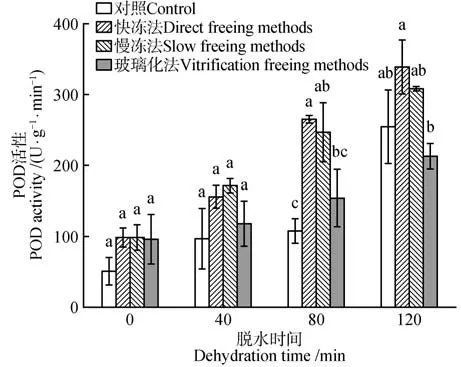
图6 脱水时间和冷冻方式对超低温保存后水曲柳合子胚POD活性的影响Fig.6 Effect of dehydration time and freezing method on POD activity of F.mandshurica zygotic embryo after cryopreservation
2.7 脱水处理和冷冻方式对水曲柳合子胚过氧化氢酶(CAT)活性的影响
超低温保存前后的水曲柳合子胚CAT 活性受脱水时间的影响差异显著(P<0.05),但CAT 活性受冷冻方式、脱水时间和冷冻方式二者的交互作用的影响差异不显著。除玻璃化法处理外,其他3种处理下水曲柳合子胚CAT活性均随脱水时间延长而增加。干燥脱水120 min、经快冻法保存后,水曲柳合子胚的CAT 活性最高,为1 168.85 U·g-1·min-1。脱水80 min后,对照的合子胚的CAT 活性最高,为1 030.66 U·g-1·min-1(见图7)。
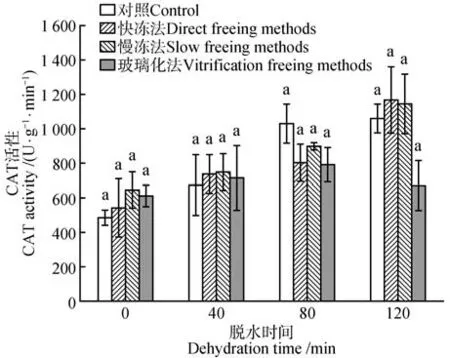
图7 脱水时间和冷冻方式对超低温保存后水曲柳合子胚CAT活性的影响Fig.7 Effect of dehydration time and freezing method on CAT activity of F.mandshurica zygotic embryo after cryopreservation
3 讨论
3.1 合子胚和体胚的超低温保存效果
水曲柳合子胚和体胚经过超低温保存后复苏的存活率可达62.26%和51.68%。Jekkel 等[8]将七叶树(Aesculus chinensis)体胚脱水处理4 h 至含水量为13%时,经快冻法保存复苏后,其存活率可达到45.9%。任淑娟等[15]利用缓速冷冻法对含水量为57.3%的七叶树离体胚进行超低温保存,复苏后其存活率为93.0%。本研究发现,水曲柳体胚经脱水处理120 min 后快冻法保存24 h 后复苏后的存活率(51.68%)与Jekkel 等[8]研究的存活率接近(45.90%)。因此认为,快冻法可用于水曲柳合子胚和体胚的超低温保存,以实现超低温长期保存植物资源的目的,但保存后材料的复苏存活率待进一步提高。
3.2 超低温保存对脱氢酶活性的影响
脱氢酶活性高低是反应胚胎活力的重要指标之一,主要受超低温保存前预处理和冷冻方式等的影响,并与胚胎的活力呈正相关。肉桂(Cinnamomum cassia)种子含水量为30%~40%时,抗冻能力较强;但当含水量低于15%时,过度脱水使细胞膜损伤,超低温保存的外植体存活率反而降低[16]。在桃叶卫矛(Euonymus maackii)种子低温处理中发现,种子含水量在8.0%时,经快速冷冻法处理和未经冷冻处理的种子,其脱氢酶活性接近,但超低温处理的种子活力较高[17]。本研究发现,在超低温保存的条件下,水曲柳合子胚脱氢酶活性与脱水时间显著相关,且受冷冻方式的影响。随着脱水时间的增加,未经超低温保存处理的合子胚的含水量越来越低,脱氢酶活性也随之降低,这说明脱氢酶活性与含水量显著相关,即胚胎活力受含水量影响,与Michalak 等[16]结论一致。同时,本研究中,在不同脱水时间处理下,经过超低温保存后的合子胚脱氢酶活性始终低于未经超低温处理的对照组(图1),与Antony 等[17]结论不一致,可能是因为研究材料不同。
3.3 超低温保存对丙二醛含量的影响
超低温保存过程中,氧化剂和抗氧化剂之间的平衡被低温胁迫打破,丙二醛随着膜脂过氧化反应的程度而不断积累。拟南芥(Arabidopsis thaliana)3 d 的幼苗在渗透保护和脱水过程中时,MDA 含量基本增加2 倍,细胞膜损伤严重[18]。在桃叶卫矛种子低温处理中发现,MDA 含量主要受材料含水量和冷冻方式影响。8%和12%的含水量的材料,MDA 含量几乎不受冷冻方式和是否冷冻影响[17]。由本研究可知,MDA 含量与脱水时间在水曲柳合子胚未经超低温保存时,呈正相关,与李佳琦等[18]一致。而经超低温处理的合子胚中,不同脱水时间、冷冻方式下MDA 含量差异较显著,而且在脱水80 min 结合快冻法保存的条件下最低(图2),跟Antony 等[17]结论不一致,可能是当含水量低于某个阈值时就不再受冷冻处理影响。
3.4 超低温保存对脯氨酸含量的影响
脯氨酸能降低凝固点和防止细胞脱水,外植体对超低温的耐受性可通过脯氨酸含量反应。对玉蝉花(Iris ensata)种子低温处理发现,脯氨酸含量在含水量为3.6%,液氮速冻、自来水化冻条件下,显著高于其他处理[19]。Burritt[20]在对红爵士海棠(Begoniax erythrophylla)茎尖低温保存时发现,超低温保存前添加外源脯氨酸预培养,其存活率增加,认为可能是脯氨酸稳固了组织代谢过程。本研究发现,在脱水120 min 结合快冻法保存的条件下,水曲柳合子胚脯氨酸含量达到最高,显著高于对照(图3)。所以,脯氨酸作为保护剂在预培养时的适量添加,可改良超低温保存方法,提高外植体的存活率。
3.5 超低温保存对可溶性蛋白含量的影响
经超低温保存后,水曲柳合子胚的存活率基本与可溶性蛋白含量呈正相关。通过材料脱水后再进行超低温保存,水曲柳合子胚可溶性蛋白含量增加,可以增加材料的存活率。经山梨醇预培养后的花烛(Anthurium scherzerianum)胚性悬浮细胞,含水量和预培养时间呈负相关,其可溶性蛋白含量和存活率明显高于对照组,认为材料的存活率主要受预培养的影响[21]。在关于玉蝉花种子研究中发现,可溶性蛋白含量主要受含水量的影响[22]。本研究中,干燥脱水80 min 后结合慢冻法保存的水曲柳合子胚中的可溶性蛋白含量达到最高(图4),由此认为,材料中的可溶性蛋白含量与冷冻方式密切相关。
3.6 超低温保存对抗氧化酶活性的影响
在超低温保存后,水曲柳合子胚抗氧化酶活性受脱水时间和冷冻方式显著影响(图5~7)。在超低温保存牡丹(Paeonia suffruticosa)花粉过程中,发现超低温处理后的花粉活性氧(ROS)水平显著提高,但萌发率比对照低;添加外源过氧化氢酶和苹果酸脱氢酶,可促进复苏后花粉的萌发率[23]。本研究中,水曲柳合子胚的过氧化物酶活性、过氧化氢酶活性、脱氢酶活性均在干燥脱水120 min 结合快冻法保存后达到最高(图1,6~7)。超氧化物歧化酶活性在经慢冻法保存后达到最高(图5)。由本研究可知,ROS诱导的氧化应激反应影响着超低温保存的材料的存活率,其存活率可通过脱水处理和冷冻方式以及添加外源抗氧化剂等方法提高。
综上所述,快冻法可用于水曲柳合子胚和体胚的超低温保存,复苏后合子胚和体胚的存活率均超过了50%。超低温保存方法中的脱水时间、冷冻方式以及二者的交互作用显著影响水曲柳合子胚的存活率和生理生化指标。在不同冷冻方式条件下,除了水曲柳合子胚的丙二醛含量随脱水时间的增加而下降以外,其脱氢酶活性、抗氧化酶活性、脯氨酸含量、可溶性蛋白含量均随脱水时间的延长而增加。在脱水120 min 结合快冻法处理的条件下,水曲柳合子胚细胞内脱氢酶活性最高,同时过氧化氢酶活性、过氧化物酶活性、脯氨酸含量均达到最大值,因此认为其细胞抗冻性高于其他冷冻法、超低温保存效果最好。
