低深度全基因组测序技术联合细胞学检测在高龄产妇产前诊断中的应用
2023-05-21曾美万晓盼王晨辉
曾美 万晓盼 王晨辉
高龄产妇是指35 周岁以上的妊娠妇女,近年来,我国实行“二胎政策”后,高龄产妇对生育的需求有所增长。有文献报道,高龄是胚胎染色体异常的独立危险因素,高龄产妇卵巢功能减退、卵子逐渐老化,加之环境因素等原因的积累,导致减数分裂期间的生殖细胞或受精卵发生染色体不分离的风险增加[1]。据报道,我国出生缺陷的发生率为5.6%,而染色体异常是出生缺陷的常见原因之一[2]。出生缺陷是导致流产、死胎、婴幼儿死亡、婴幼儿先天残疾的重要因素,不但对胎儿构成威胁,而且对家庭、社会造成沉重的经济负担[3]。我国《母婴保健法》规定,孕产妇需进行产前检测,防止严重遗传性疾病患儿出生。细胞学检测为传统产前检测方法,其中染色体核型分析是细胞学检测中的一种,也是产前诊断的“金标准”,但该方法检测周期长,分辨率较低[4]。随着分子检测技术的发展,越来越多的产前诊断中心把细胞学检测联合低深度全基因组测序技术(low-depth whole-genome sequencing,CNV-seq)作为产前诊断的有效方法,二者联合检测,可以提高检测的灵敏度。本研究将探讨低深度全基因组测序技术联合细胞学检测在高龄产妇产前诊断中的应用。现报道如下。
1 资料与方法
1.1 一般资料
选取2020 年1 月至2021 年12 月濮阳妇幼保健院进行检查的196 例高龄产妇作为研究对象。纳入标准:①单胎妊娠;②年龄>35 岁;③孕周17~26 周;④具有明确产前诊断指征[5];⑤无创DNA 筛查提示染色体异常;⑥胎儿结构超声结果显示异常;⑦夫妻任意一方存在染色体疾病家族史;⑧产妇曾生育具有染色体疾病的患儿;⑨孕妇有多次不明原因流产史,或曾有死胎生育史;⑩患者及家属均知情同意本次研究并签署知情同意书。排除标准:①既往有不良孕史;②体温>37.5℃;③有盆腔感染或宫腔感染征兆;④凝血功能异常或伴有血液系统疾病;⑤孕期接触过有害因素者。患者平均年龄(37.25±0.78)岁,身体质量指数(BMI)为20~23 kg/m2,平均BMI(21.51±0.69)kg/m2。
1.2 方法
1.2.1 样本采集
在做完相关的检查和排除羊膜穿刺的禁忌后,在无菌状态下进行羊膜穿刺,采集25 mL 羊水,其中15 mL 羊水经细胞培养,用于染色体核型分析,5 mL 用于CNV-seq 测定,5 mL 保存。为消除母源污染对测序的影响,采集2 mL 的外周血备存。
羊膜腔穿刺术流程:嘱咐孕妇排空膀胱,取仰卧位,观察胎儿心率、胎盘位置和羊水量,判断穿刺位置。腹部常规消毒后,再铺无菌洞巾;在超声的指引下,尽量避开胎儿和胎盘往羊水最深处,羊水穿刺针垂直刺入腹腔,刺入羊膜腔后取出针芯,羊水溢出。取出羊水后,将针芯插入穿刺针中取出,无菌辅料覆盖;术后再测胎心率,并观察胎盘有无渗血。
1.2.2 细胞学检测
染色体核型分析:将抽取的羊水离心,收集细胞悬液,接种至无菌培养瓶内,加入4 mL 羊水培养基,混合均匀后37℃CO2培养箱内培养6~7 d,当细胞生长状态良好,出现许多小岛时换培养基,换取新鲜培养基2 mL 鸡血培养24~48 h;当细菌生长旺盛,出现细胞克隆≥5 个,并出现圆形细胞时,加入60 μL 秋水仙素,30 min 后行细胞学处理;倒出瓶中细胞上清液,加入4 mL EDTA-胰酶消化3~5 min;加入37℃0.075 mol/L 氯化钾溶液6~8 mL,置于37℃水浴箱内20 min;再加入新鲜配置的固定液6 mL,混匀后静置15 min,弃上清液(重复三次固定),刮下贴壁细胞,收集至15 mL 试管中吹打混匀后离心,弃上清;后滴片、烤片、染色处理后将标本玻片放入全自动染色体扫描平台分别从两个培养体系中采集,计算核型。每个样本计数20~30 个细胞,分析5~7 个细胞,按照人类细胞遗传学国际命名体制进行核型描述和记录,发现染色体嵌合时加倍计数和分析细胞数。
1.2.3 CNV-seq 检测
提取羊水样本中的DNA,并对提取到的DNA进行纯化,采用染色体拷贝数变异检测试剂盒及高通量测序文库构建DNA 纯化试剂盒对分离纯化的DNA 进行文库构建,再采用高通量测序试剂盒DNA 文库进行高通量测序,获取测序数据,测试数据分析系统进行序列比对及数据分析,获得目标染色体的Z 值和全部>100 kb 的染色体拷贝数变异。
染色体拷贝数变异评价标准:根据美国医学遗传学与基因组学会(ACMG)指南标准[6]:将检测样本中发现的染色体拷贝数变异(copy number variation,CNVs)分为以下5 个方面:致病性拷贝数变异(pathogenic copy number variations,pCNVs);可能致病CNVs;临床意义未明的CNVs(variants of uncertain significance,VUS);良性CNVs;可能良性CNVs。
1.3 孕妇妊娠结局随访
对受试者进行电话随访或门诊随访,统计孕妇妊娠结局及新生儿结局。
1.4 统计学方法
采用SPSS 21.0 统计学软件进行数据分析,计数资料以n(%)表示,采用χ2检验;计资料采用()表示,行t检验。以P<0.05 为差异有统计学意义。
2 结果
2.1 细胞学检测结果
196 例羊水标本中,染色体核型分析染色体异常40 例,染色体异常检出率20.40%。见表1。
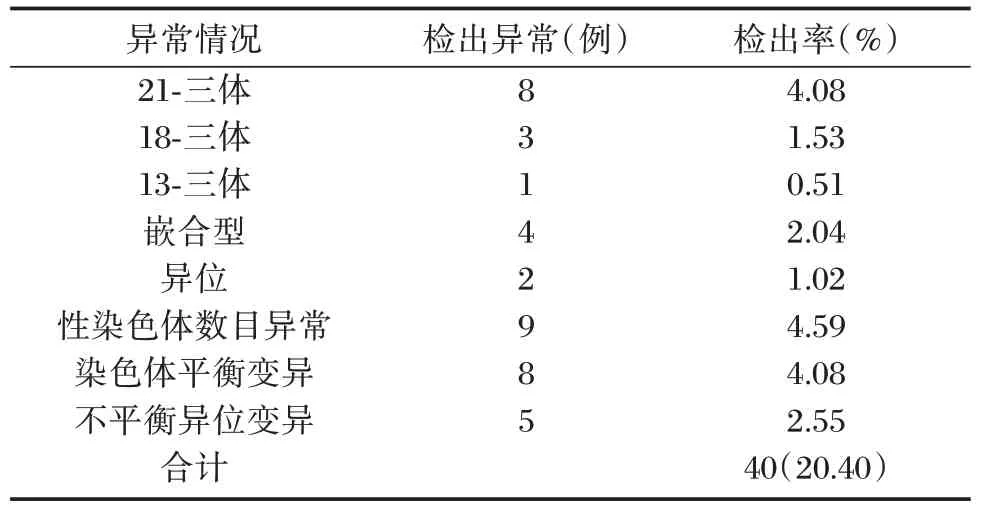
表1 细胞学检测结果Table 1 cytological results
2.2 CNV-seq 检测结果
196 例羊水标本中,CNV-seq 技术检出结果异常率52 例,异常检出率26.53%。见表2。
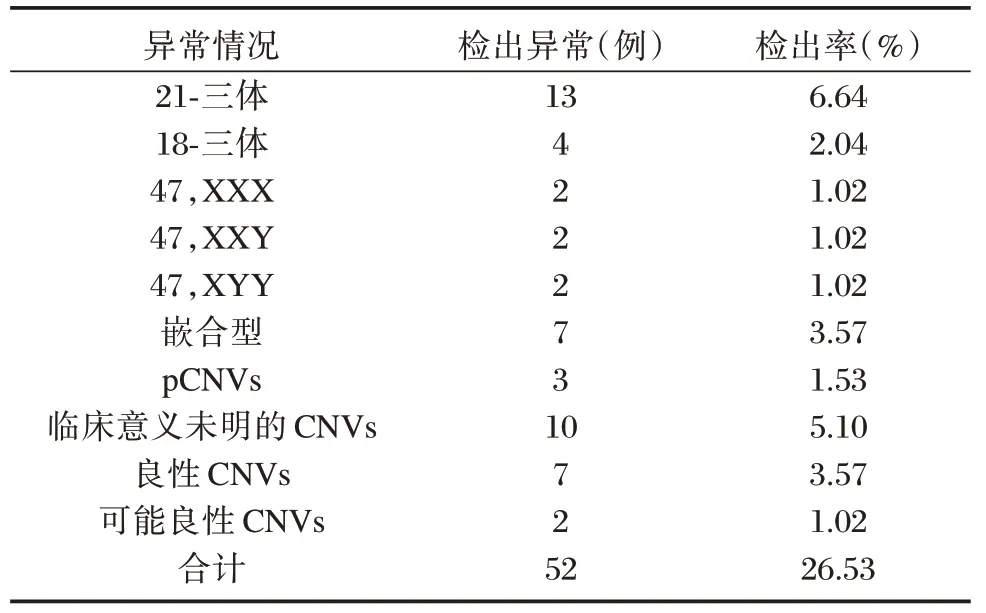
表2 CNV-seq 检测结果Table 2 CNV-seq test results
2.3 CNV-seq 联合细胞学检测染色体异常情况
196 例羊水标本中,CNV-seq 联合细胞学检测染色体异常65 例,检出率33.16%,其中包括致病性染色体异常62 例,临床意义未明的CNVs 3 例。检出胎儿染色体嵌合型7 例,检出率为3.57%,其中细胞学检测检出5 例,检出率为2.55%,CNV-seq检出3 例,检出率为1.53%。
2.4 CNV-seq、细胞学检测二者单独检测与CNVseq 联合细胞学检测染色体异常率比较
CNV-seq、细胞学检测二者单独检测染色体异常率比较,差异无统计学意义(P>0.05);单独CNV-seq 检测与CNV-seq 联合细胞学检测染色体异常率比较,差异无统计学意义(P>0.05);单独细胞学检测与CNV-seq 联合细胞学检测染色体异常率比较,差异有统计学意义(P<0.05);CNVseq、细胞学检测二者单独检测与CNV-seq 联合细胞学检测染色体异常率比较,差异有统计学意义(P<0.05)。见表3。
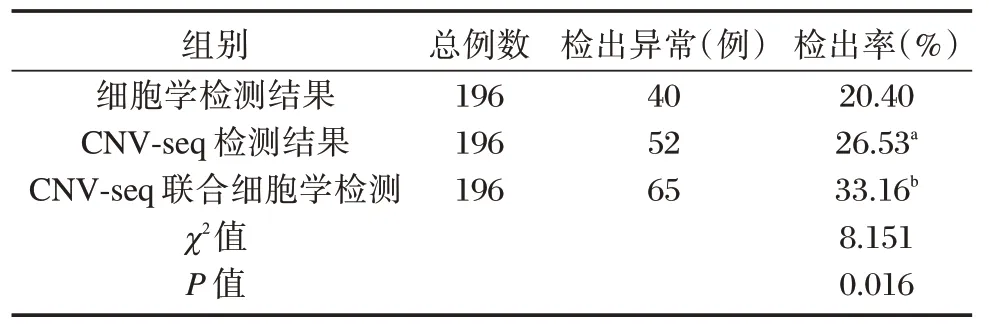
表3 CNV-seq、细胞学检测二者单独检测与CNV-seq联合细胞学检测染色体异常率比较Table 3 Comparison of chromosome abnormality rates between CNV-seq and cytology alone and CNV-seq combined cytology
2.5 随访结局
随访至最终妊娠结局的产妇196 例,随访率为100%。65 例检出致病性染色体异常的孕妇中,62例孕妇选择引产,3 例在已经告知染色体异常情况下选择正常分娩,其中1 例为47,XXY,足月剖宫产,新生儿目前发育正常;2 例47,XYY,足月剖宫产,新生儿目前发育正常。
3 讨论
随着现代医学技术的发展,婴幼儿营养不良、感染等疾病的检出率明显下降,而先天结构畸形、染色体异常、功能代谢障碍等则明显增加,导致围产儿死亡风险增加,影响分娩结局。相关文献报道,我国每年有20~30 万的新生儿具有肉见可见的先天畸形,新生儿先天性出生缺陷总数达到100万,是新生儿先天性出生缺陷的高发国家[7]。新生儿先天性出生缺陷中染色体异常最为常见,而高龄产妇因卵细胞质量下降,更容易出现染色体变异和基因变异,一学者对高龄产妇进行了回顾性研究,结果显示:高龄产妇的染色体异常发生率高达9.15%[8]。产前诊断主要是指在胎儿出生之前,检查胎儿的发育和染色体的异常,在产前对存在先天性缺陷高危因素的产妇进行产前检测,以防止染色体异常的胎儿出生,是确保新生儿出生质量的关键。
早在20 世纪60 年代,细胞染色体核型分析就被认为是染色体异常诊断的“金标准”。但羊水染色体核型分析技术受到多种因素的制约,对低比例嵌合体的诊断和真伪嵌合体的诊断有很大的缺陷[9]。目前已有研究表明,当羊水染色体核型分析结果为嵌合体,需要进一步进行细胞分裂间期的FISH 检测,如嵌合体20%以上,则可以使用拷贝数变异法进行鉴别[9]。CNV-seq 技术是近几年在基因诊断及产前诊断方面的一个新进展,《中华医学遗传学杂志》于2019 年刊载CNV-seq 产前诊断专家共识,对其特征进行了详尽阐述,并对其临床应用进行规范[10]。CNV-seq 技术具有较高的分辨率、检测周期短、检测范围广等优点,可以很好的弥补细胞染色体核型分析的缺陷,对羊水染色体嵌合体的诊断具有较高的准确性,且能提高检测的敏感性和精确度。
本研究结果显示,细胞学染色体核型分析检测检出异常率20.40%;CNV-seq 技术检出异常率26.53%;可见CNV-seq 技术的检出率更高,发现的拷贝数变异更多,但两者单独检出异常率比较无明显差异。细胞学检测+CNV-seq 检测检出异常率33.16%,高于刘淑敏等[11]的13.82%,可能与本研究不同产前诊断指征所占比例不同有关。CNV-seq、细胞学检测二者单独检测与CNV-seq联合细胞学检测染色体异常率比较差异显著,二者联合检测能相互验证检出异常核型,还能补充不同种类的异常核型。在嵌合体检测方面,细胞学染色体核型分析检出4 例,CNV-seq 检出7 例,有研究发现,CNV-seq 技术可精确检测低至5%的嵌合体[4]。而在染色体平衡性结构异常方面,细胞学染色体核型分析检测检出异位、染色体平衡变异、不平衡异位变异,由于染色体平衡性结构异常不涉及遗传物质增多或减少,因此未能被CNV-seq 检出。研究显示,染色体结构异常不引起临床表现,但可能会出现流产、胎停育等情况[12]。就二种检测方法而言,CNV-seq 技术可以弥补染色体核型分析技术的缺陷,可以提高胎儿的染色体异常检出率,但是无法检测到平衡易位、倒位、环状和多倍体,因此不能单独用于产前诊断[13]。细胞染色体核型分析则是通过对染色体的条状和相对稳定的形态进行鉴别,只在染色体数量异常或较大的结构(5 MB)异常的情况下才能被检出,其操作复杂,细胞培养时间长,且无法明确诊断是否存在微小片段的缺失或重复[14-15]。因此,为了避免漏检,可联合CNV-seq 技术对高龄产妇进行产前诊断,以提高胎儿的染色体异常检出率。
综上所述,低深度全基因组测序技术联合细胞学检测在高龄产妇产前诊断中有良好的应用价值,且具有较高的检出率,降低出生缺陷。
