血清NGAL、β2-MG与IgA肾病病理分级及预后的相关性
2023-05-21张兆怡王驰常青虞亚菲董腾腾聂飒飒李绵洋
张兆怡 王驰 常青 虞亚菲 董腾腾 聂飒飒 李绵洋★
IgA 肾病(IgA nephropathy,IgAN)是免疫球蛋白及补体沉积在肾小球系膜区的原发性肾小球疾病,在我国发病率占原发性肾小球疾病总数40%以上。在确诊后的10~20 年内,约有20%~40%的患者会发展为终末期肾病[1-3]。目前IgAN 确诊的金标准是肾穿刺活检术,但由于肾穿属于有创性操作且易导致出血等并发症[4],因而无创性标志物的探索对于IgAN 的辅助诊断或不良预后评估具有重要意义。中性粒细胞明胶酶相关载脂蛋白(neutrophil gelatinase-associated lipocalin,NGAL)是Lipocalin家族蛋白,在中性粒细胞中发现,也广泛表达于肾小管上皮、平滑肌等细胞。NGAL 通过多种机制参与肾脏疾病的病理过程,是一种敏感的肾脏损伤标志物[5-6]。β2-微球蛋白(β2-microglobulin,β2-MG)是从淋巴细胞,多核白细胞等生成的小分子球蛋白,作为主要组织相容性抗原的成分[7]。β2-MG 是评价肾小球和肾小管功能的生物标志物之一,在人体发生肾功能受损时可显著增高。既往研究表明,随着肾小管间质病变的加重,血、尿β2-MG 水平明显升高,可以预测IgAN 的预后[8]。本研究将同时探讨血清NGAL、β2-MG 水平与肾功能指标及IgA肾病Lee 氏分级、牛津分型的相关性及临床意义,以期为临床诊治提供参考。
1 资料与方法
1.1 一般资料
选取2020 年9 月至2022 年7 月在解放军总医院经肾活检确诊为IgAN 患者190 例,平均年龄(40.83±10.81)岁,随访时长为(13±6)个月,进入肾脏终点事件患者18 例(9.47%)。纳入标准:①肾活检确诊为IgAN 的患者。②临床资料完整;③肾活检病理阅片时,肾组织切片肾小球总数≥8 个;④自愿参与本研究并签署知情同意书,接受随访。排除标准:①其余继发性肾脏疾病;②既往接受过免疫抑制剂或激素等治疗;③合并严重心脑血管疾病等疾病患者;④其他原因引起的急性肾损伤患者。本研究已通过院医学伦理委员会批准,审批号:S2020-531-02 号
1.2 研究方法
1.2.1 临床资料
收集患者的临床资料及实验室指标,包括血肌酐(serum creatinine,Scr)、24 h 尿蛋白定量、血尿素氮(Blood urea nitrogen,BUN)、血尿酸(uric acid,UA)、免疫球蛋白A(Immunoglobulin A,IgA)、低密度脂蛋白(low-density lipoprotein,LDL)等指标。并估算肾小球滤过率(estimated glomerular filtration rate,eGFR)。
1.2.2 病理资料
对患者肾穿标本进行光镜、免疫荧光及电镜检查。将病理资料按牛津分型进行评估,分为肾小球系膜细胞增殖(M),(M:<4 个=0,4~5 个=1,6~7 个=2,系膜细胞增殖积分取所有肾小球平均值:M0≤0.5;M1>0.5);毛细血管内增殖性病变(E),(E0=无,E1=有);肾小球节段硬化/球囊黏连(S),(S0=无,S1=有);肾小管萎缩/间质纤维化(T):纤维化累及区域:(T0:0%~25%;T1:26%~50%;T2:>50%);细胞性/细胞纤维性新月体(C),(C0=无,C1=有)[9-10]。Lee 氏分级根据活检时肾小球系膜细胞增生程度、肾小球硬化程度、肾小管间质病变程度分为Ⅰ~Ⅴ级[11],记录病理分级结果。
1.2.3 指标检测
患者抽取空腹静脉血,3 000 r/min 离心10 min,离心半径为10 cm。分离血清后于-80℃冰箱中保存待检。血清NGAL Elisa 试剂盒为江苏酶免实业有限公司,根据所测结果在450 nm 的OD 值,绘制标准曲线计算样本浓度。
1.3 终点事件
血肌酐翻倍或死亡或肾脏终点事件(End Stage Renal Disease,ESRD)或开始肾脏替代治疗(透析、肾移植),肾脏终点事件定义为eGFR<15 mL/(min·1.73 m2)。随访时 间截止 至2022 年10 月。
1.4 统计学方法
采用SPSS 26.0 统计学软件进行数据分析。计量资料以()或M(P25,P75)表示,两组间比较行独立样本t检验,多组间比较采用非参数检验。计数资料以n(%)表示。Pearson 或Speraman 行相关性分析;COX 回归分析IgAN 不良预后的独立危险因素。绘制受试者工作特征曲线(ROC)评估IgAN 病理诊断效能。以P<0.05 为差异有统计学意义。
2 结果
2.1 血清NGAL、β2-MG 与肾功能指标的相关性分析
血清NGAL、β2-MG 与SCr、BUN、24 h 尿蛋白均呈正 相关性(r=0.749、0.621、0.563;r=0.849、0.740、0.426);而与eGFR 呈负相关性(r=-0.681、-0.697)。
2.2 血清NGAL、β2-MG 与病理特征相关性分析
血清NGAL、β2-MG 与牛津分型T、M 存在正相关性(P<0.05),T2 组血清NGAL、β2-MG 水平高于T0、T1 组;M1 组高于M0 组,差异有统计学意义(P<0.05)。见表1。血清NGAL 及β2-MG 水平在不同Lee 氏分型组间存在正相关性(P<0.05);Lee 氏Ⅳ~Ⅴ级组血清NGAL、β2-MG 水平高于Lee氏Ⅰ~Ⅱ级及LeeⅢ级组,比较差异有统计学意义(P<0.05)。见表2。
表1 不同牛津病理分型的IgAN 患者NGAL、β2-MG 水平比较[(±s),M(P25,P75)]Table 1 Comparison of NGAL and β2-MG levels of IgAN patients with different Oxford pathological types[(±s),M(P25,P75)]
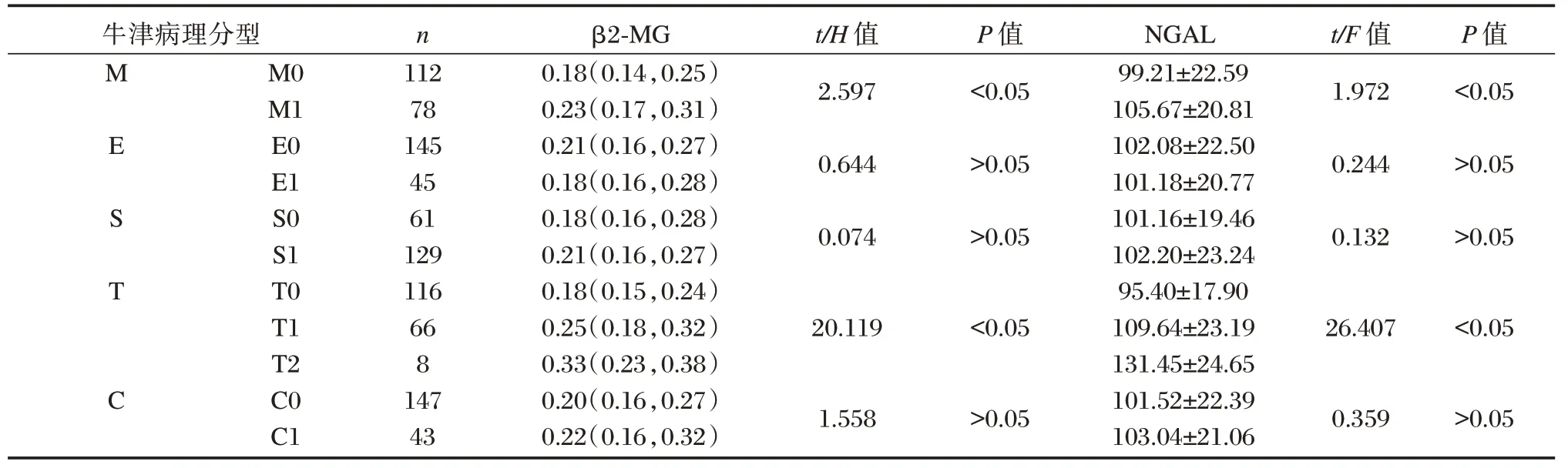
表1 不同牛津病理分型的IgAN 患者NGAL、β2-MG 水平比较[(±s),M(P25,P75)]Table 1 Comparison of NGAL and β2-MG levels of IgAN patients with different Oxford pathological types[(±s),M(P25,P75)]
表2 不同Lee 氏分型的IgAN 患者血清NGAL、β2-MG水平比较[(±s),M(P25,P75)]Table 2 Comparison of serum NGAL and β2-MG levels in IgAN patients with different Lee types[(±s),M(P25,P75)]
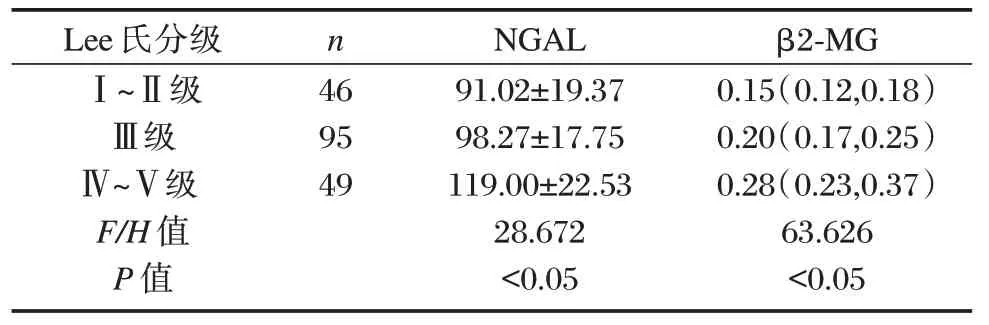
表2 不同Lee 氏分型的IgAN 患者血清NGAL、β2-MG水平比较[(±s),M(P25,P75)]Table 2 Comparison of serum NGAL and β2-MG levels in IgAN patients with different Lee types[(±s),M(P25,P75)]
2.3 ROC 曲线分析血清NGAL、β2-MG 诊断价值
以血NGAL、β2-MG 及血NGAL+β2-MG 水平评估有无T1-2时的曲线下面积。有无T1-2时血NGAL、β2-MG 及联合诊断的曲线下面积分别为0.705、0.710、0.738。见图1。
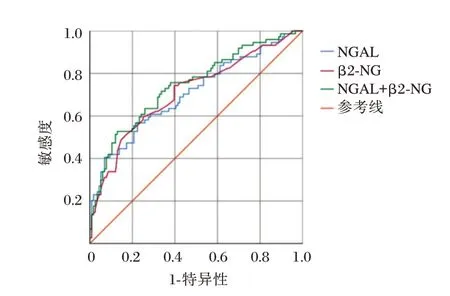
图1 有无T1-2 时血NGAL、β2-MG 的ROC 曲线Figure 1 ROC curves of blood NGAL and β2-MG with or without T1-2
2.4 IgAN 患者肾脏预后的影响因素
截止2022 年10 月,共18 例患者进入终点事件。β2-MG、NGAL、血红蛋白等指标为IgAN 患者预后不良的相关危险因素,将指标赋值(24 h 尿蛋白:0=<3.5 g,1=≥3.5 g;Hb:0=≥110 g/L,1=<110 g/L;牛津分型(T):0=T0,1=T1、T2)。多因素COX 分析显示牛津分型(T)、血红蛋白、24 h尿蛋白为IgAN 患者预后不良的独立危险因素。见表3。

表3 IgAN 预后影响因素的Cox 单因素及多因素分析结果Table 3 Cox univariate and multivariate analysis of factors influencing IgAN prognosis
2.5 Kaplan-Meier 生存曲线分析IgAN 患者预后
Kaplan-Meier 生存曲线分析结果提示,IgAN患者贫血、牛津分型T 病变较重时,其肾脏存活率低,肾脏预后较差。(χ2=18.079、14.501,P<0.001)。见图2。
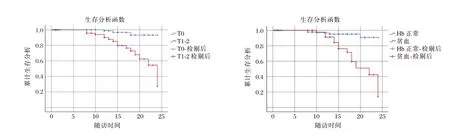
图2 贫血、牛津分型(T)与IgAN 肾脏预后的Kaplan-Meier 生存曲线Figure 2 Kaplan-Meier survival curves for anemia,Oxford typing(T)and IgAN renal prognosis
3 讨论
IgAN 为我国最常见的原发性肾小球疾病,是导致终末期肾病的主要原因之一[3]。患者通常早期起病隐匿,仅表现为无痛血尿/蛋白尿/血肌酐升高,因此探索血清学标志物对IgAN 辅助诊断及不良预后评估具有重要意义。NGAL 为25 kDa 小分子蛋白,当发生急性肾损伤后由肾小管上皮细胞释放,对肾小管间质损伤更为敏感,可作为早期诊断及预测肾脏损伤的临床标志物[12-13]。β2-MG是表达MHC1 类抗原细胞生成的小分子蛋白,血β2-MG 水平增高,反映肾小球滤过功能减弱或滤过负荷加重[14-15]。近期研究发现,血、尿NGAL、β2-MG 水平在糖尿病肾病等疾病中增高,并随着eGFR 进行性下降[15]。现今仍以病理分级诊断来判断IgAN 患者肾脏病变的严重程度。Lee 氏分级侧重于肾小球病变,而牛津病理分型则对肾小球及肾小管病变均有描述。本研究显示随着肾小管病变的加重,血清NGAL、β2 -MG 水平呈上升趋势,这表明其对肾小管间质病变有一定的预测价值。因此后期有望通过定期复查这些指标,为患者病情是否加重提供参考。
早期诊断IgAN 患者不良预后较为困难,但对IgAN 患者行早期干预治疗仍至关重要。近年来,许多研究评估了IgAN 患者的预后指标,蛋白尿水平、基础肾功能损害已被大家广泛接受[16]。血清IgG、氯化物可以作为影响IgAN 患者预后不良的独立因素[17]。在本研究中,牛津分型(T)、血红蛋白、24 h 尿蛋白为IgAN 患者进展至ESRD 的独立危险因素。关于牛津病理分型对预后的影响,研究结论不一。研究差异可能由于样本量或地区差异、疾病严重程度及对治疗的反应不同等导致。在IgAN 中,除了临床危险因素外,诊断时肾脏损害的严重程度决定了肾衰竭进展的风险,因此早期评估患者肾脏病理改变,及早对患者行药物治疗并改善患者预后在临床上至关重要。
综上所述,本研究发现血清NGAL、β2-MG 和IgAN 肾功能指标、病理分级具有相关性。血清NGAL 和β2-MG 能反应肾小管间质损伤和IgAN病理发展情况,可作为评价肾小管萎缩或者间质纤维化早期的无创性指标及预后观察指标。多种因素影响IgAN 预后,而牛津分型(T)为IgAN 患者进展至ESRD 的独立危险因素,所以,NGAL、β2-MG对IgAN 的预后评估具有一定的临床应用价值。
