籼稻材料570011抗褐飞虱基因的遗传分析及鉴定
2023-05-18程玲黄福钢邱一埔王心怡舒宛邱永福李发活
程玲 黄福钢 邱一埔 王心怡 舒宛 邱永福 李发活,*
籼稻材料570011抗褐飞虱基因的遗传分析及鉴定
程玲1, 2黄福钢3邱一埔3王心怡3舒宛2邱永福3李发活3,*
(1粮食作物种质创新与遗传改良湖北省重点实验室, 武汉 430064;2长江大学 农学院, 湖北 荆州 434025;3广西大学 农学院/亚热带农业生物资源保护与利用国家重点实验室, 南宁 530004;*通信联系人, email: 316801153@qq.com)
【目的】发掘籼稻570011中抗褐飞虱主效基因,为培育抗虫水稻新品种提供基因资源。【方法】采用苗期集团法对抗性亲本570011和感虫亲本9311杂交后代F3群体进行表型鉴定,结合F2群体基因型,使用作图软件构建染色体的局部遗传连锁图,对目标区段抗性位点进行检测和遗传效应评估。采用实时荧光定量PCR (qRT-PCR)分析定位区间内最可能的候选基因,并对其基因组序列进行测序,比较对应CDS和氨基酸序列并进行系统进化树分析。【结果】籼稻570011在苗期对褐飞虱表现高抗,且对褐飞虱有明显的抗生性和趋避性。统计发现F3群体抗虫株系数(抗性值<7)∶感虫株系数(抗性值≥7)为89∶35,卡方检验表明符合一对显性基因的分离规律。基因定位发现在第4染色体标记4M18.675和4M24.64之间的39 cM区域内检测到一个褐飞虱抗性位点,可能是已克隆基因的等位基因。qRT-PCR分析表明570011中(等位基因)在褐飞虱取食后表达量显著高于感虫材料9311。570011中基因与的CDS和氨基酸序列同源性分别达到99.08%和97.96%,系统进化树分析发现两者的亲缘关系最近,表明该抗性基因是的等位基因。【结论】籼稻材料570011是一份高抗褐飞虱种质,其抗性表型受一个主效基因控制。该基因的发掘丰富了的等位型和抗源来源,为抗虫水稻育种提供新抗源。
水稻;褐飞虱;;等位基因;生理抗性机制
褐飞虱()是亚洲稻区主要暴发性、毁灭性的害虫,其若虫和成虫栖息在水稻基部茎丛处,通过刺吸稻茎韧皮部细胞汁液致使植株萎蔫、茎丛腐烂,并会传播水稻病害加速水稻死亡,导致水稻减产甚至绝收[1]。近年来,随着我国南方水稻种植结构、种植水平和耕作制度的改变,褐飞虱对水稻的危害日趋严重[2]。褐飞虱属于典型的-对策型害虫,具有极高的内禀增长率,人类越是精耕细作,其生殖和扩散能力就越强,而且具有长距离迁飞习性,易造成水稻大面积受灾。长期以来,化学防治一直是控制褐飞虱的重要途径,然而选育和推广抗褐飞虱水稻品种是防治褐飞虱大面积暴发和减药栽培的最佳途径。因此,持续发掘新抗源和新抗性基因,通过多基因聚合培育持久型抗褐飞虱品种,避免褐飞虱致害性变异引起的单一抗性基因失效带来的损失是防治褐飞虱的重要工作。
20世纪60年代起,研究人员利用不同水稻材料已定位了38个抗褐飞虱主效基因,其中源于野生稻的褐飞虱抗性基因有20个,源于栽培稻有18个[3]。但因供体亲本和标记方法的不同存在命名混乱的现象,如同一基因两种命名或不同基因雷同命名[4]。在水稻12条染色体中,第4染色体携带15个抗褐飞虱主效基因,是目前报道的定位基因数量最多的染色体。自通过图位克隆法获得第一个抗褐飞虱基因以来,目前已报道克隆的抗BPH基因有12个,大致可以分为四类。第一类基因为编码水稻第一层免疫系统的质膜蛋白模式识别受体(Pattern recognition receptors,PRRs),通过被激活并响应保守的食草动物相关分子模式(herbivore associated molecular pattern,HAMP)[5],包括[6]和[7]。第二类基因为编码细胞内核苷酸结合域和富含亮氨酸重复(Nucleotide-binding domain and Leucine-rich Repeat,NLR)的蛋白,通过感知褐飞虱传递给水稻细胞的效应因子并触发相应的防御反应[5]。此类基因又可以分为四个小类:一是编码仅含CC-NB结构域类型的蛋白,如第6染色体上的[8];二是编码包含CC-NB-LRR结构域类型的蛋白,如第3染色体上的[9]、第4染色体上的[10];三是编码包含CC-NB-NB-LRR结构域类型的蛋白,如第12染色体上的[11],[12]和[13];四是编码仅含LRR结构域类型的蛋白,包括第4染色体上的和[14];第三类为编码一个包含B3 DNA结合结构域的蛋白,例如[15];第四类为编码包含简短共有重复序列(short consensus repeat,SCR)结构域蛋白,如第6染色体上的[16]。褐飞虱与水稻长期协调进化过程中,由于其致害性的变异,部分抗性基因已失效,最典型的就是和[17, 18],所以需要不断发掘新的抗褐飞虱基因并将其应用于聚合育种,提高其对褐飞虱抗性的持久性与广谱性。
水稻对褐飞虱的抗性水平可以通过苗期集团法、成株期鉴定等方法和褐飞虱的宿主选择、虫体增重、蜜露分泌量等指标来衡量。其中,宿主选择性是根据抗虫水稻植株具有驱赶或抑制褐飞虱取食的能力,使褐飞虱群体迁飞到更适宜生存的地点或植株上继续生长。虫体增重法、蜜露分泌量测定则是根据褐飞虱在水稻植株上的反应表现值(如蜜露分泌量、虫体增重量),来评价水稻植株的抗性水平。籼稻材料570011对褐飞虱表现高抗,其抗性基因尚不清楚。为此将之与感虫材料9311杂交构建遗传定位群体,利用苗期集团法测定抗虫表型及分子标记确定基因型,对褐飞虱抗性基因扫描定位,以期发掘新的抗褐飞虱基因;同时,利用qRT-PCR和测序方法对候选基因进行分析,确定候选基因,为水稻抗褐飞虱育种中分子标记辅助选择、品种的聚合培育提供新抗源。
1 材料与方法
1.1 试验材料
籼稻材料570011来源于广西农业科学院植物保护研究所,作为抗虫亲本;籼稻品系9311作为感虫亲本。水稻种子在37℃下催芽,然后转移到塑料盆或塑料桶生长,自然光照,平均温度26℃~32℃,相对湿度75%。
以感虫材料9311为母本,抗虫材料570011为父本,杂交得F1代,再种植124个单株的F2分离群体,单株自交收种得到对应的F3株系。
1.2 实验用虫及苗期抗虫鉴定
采集广西南宁市水稻大田的褐飞虱自然种群,于温室种植的感虫品系9311上繁殖。
参照Qiu等的方法[19],利用苗期集团法进行群体抗性测定,具体方法如下:塑料托盘(58 cm×38 cm×9 cm)盛5 cm厚稻田土,纵向均分两份,每份平均分成15个小区。每小区内等株距播种已发芽种子20粒,每个株系随机排列,其中抗感亲本各随机播种1个小区,每个株系播种3个重复,共36个小区。待植株长到2叶期(约7 d)搬出室外炼苗;3叶期(约12 d)时剔除弱、病、死苗,每区留苗16株,每株幼苗接2~3龄褐飞虱若虫8头,使用纱网罩罩住防止褐飞虱逃出。当感虫亲本9311死亡率达90%以上时,参照苗期集团法评分标准对每株进行评级。该标准共分为6个抗性级别,0级为植株生长健康无叶片受害;1级为存在1片黄叶;3级为1~2片黄叶,或1片叶枯萎;5级2~3片黄叶,或2片叶枯萎;7级为3~4片黄叶,或2片叶枯萎;9级为整株死亡,每个株系的抗性级别为各重复株系测定级别的加权平均值。
1.3 褐飞虱宿主选择、存活、蜜露分泌量、虫体增重量试验
宿主选择试验:将长至12~14 d的两个亲本植株移栽于同一塑料桶(= 29 cm,= 20 cm)中,每桶移栽4株(抗、感各2株)。其中,相同亲本的植株对角线移栽。用可透光的纱网罩将移栽幼苗的塑料桶封闭好,确保接褐飞虱后不会逃出。植株长至30 d,将60头褐飞虱投入每个纱网罩中,并在接虫后3 h、6 h、9 h、24 h、36 h、48 h、72 h、96 h、120 h统计植株上着虫数,试验设置5个重复。
褐飞虱存活试验:将长至12~14 d的两个亲本分别移栽一株于塑料杯(= 10 cm,= 16 cm)中,罩上底部打圆孔的透明塑料杯。植株长至30 d时,从打孔处按每株接入10头2~3龄的褐飞虱若虫,再用脱脂棉封住圆孔以防褐飞虱逃出,每天记录植株上褐飞虱的数目,连续统计10 d。每个亲本设置8个重复。
虫体蜜露分泌量和虫体增重量测定:亲本植株的种植方法与宿主选择试验相同。具体操作是将Parafilm封口膜裁剪成3.5 cm × 3 cm长方形蜡袋,其一角边留1 cm长度的口径,用于接入一头已称量的3龄褐飞虱并将封口膜绑在苗龄40 d的植株茎部。褐飞虱在植株上取食48 h后,移出褐飞虱并称量,虫体前后质量相减即为接虫48 h后体质量的增量[20]。接虫48 h后移出褐飞虱并称量蜡袋,用脱脂棉擦拭蜡袋中蜜露后再称量,两者相减即为虫体蜜露量。每个亲本设置12个重复。
1.4 遗传图谱构建和抗性位点分析
采用集团分离分析法(Bulked Segregation Analysis,BSA)筛选与抗性相关的分子标记,具体方法如下:从124个F3株系中挑选10个极端抗虫和10个极端感虫株系对应的F2单株分别提取基因组DNA[21],分别测量各样品DNA的浓度,然后将等量的单个基因组DNA进行混合构建抗感池。基于本实验室1559对SSR和InDel引物进行PCR扩增、聚丙烯酰胺凝胶电泳以及银染显色检测,筛选得到在亲本间具有多态性的引物,再利用亲本间多态性引物对抗感DNA池进行验证,获得与目标性状紧密连锁的引物,进而将其对124个F2单株的基因型进行检测,获得对应单株的基因型。利用JoinMap 3.0软件构建F2群体的局部遗传连锁图谱。利用MapQTL 5软件对获得的F2群体表型和基因型数据进行抗性位点检测,以阈值LOD值≥3.0来判断群体是否存在抗性位点。
1.5 RNA提取、反转录与qRT-PCR分析
分别将发芽的亲本种子播种在塑料杯(= 17 cm,= 15 cm)并保留8株,长至3叶期时,每杯接入64头2~3龄褐飞虱若虫。接虫处理0 h、12 h、24 h、48 h时快速采集植株的叶鞘部分,于液氮中保存并存放于–80℃冰箱中用于RNA的提取,每个处理的时间点设置3个重复。
采用TaKaRa公司TransZol Up Plus RNA Kit提取RNA,接着用PrimeScript™ First-Strand cDNA Synthesis SuperMix试剂盒将提取的RNA反转录为cDNA。qRT-PCR引物参考日本晴基因组序列信息(http://rice.plantbiology.msu.edu),并用Primer 5.0软件设计。PCR在ABI PRISM 7300 real-time PCR 系统(Applied Biosystems)上进行。参照Prime Script TM RT试剂盒(TaKaRa)说明书,qRT-PCR体系为正反向引物、Passive Reference Dye(50×)各0.4 µL,模板 cDNA 1 µL,2× TransStart Top 10 µL,dd H2O加至20 µL;反应程序为94℃下预热30 s,接着进行40个循环的程序:94℃下5s,56℃下15 s,72℃下10 s。每个样品设置3次重复。运用MS-Excel绘制标准曲线以及计算斜率和2。以水稻基因(上游引物5’-CAGCACATTCCAGCAG AT-3’,下游引物5’- GGCTTAGCATTCTTGG GT-3’)作为参照,运用2−方法分析样品间基因表达水平。根据3次生物学重复的定量表达结果,比较目标基因在褐飞虱处理的各个时间点的表达变化情况。
1.6 数据统计分析
采用MS-Excel分析数据。所有数据均采用单因素方差分析,并在5%或1%的显著性水平上用最小显著性差异法进行比较。
2 结果与分析
2.1 籼稻570011对褐飞虱的生理抗性特征
苗期抗虫结果鉴定表明,籼稻570011对来自南宁田间的褐飞虱自然群体具有高抗性,平均抗性值为2.9。褐飞虱侵害9 d后,9311表现出整株叶片枯萎,呈现死亡症状;而570011植株表现为正常绿色,表明褐飞虱未对其生长发育造成明显危害(图1)。
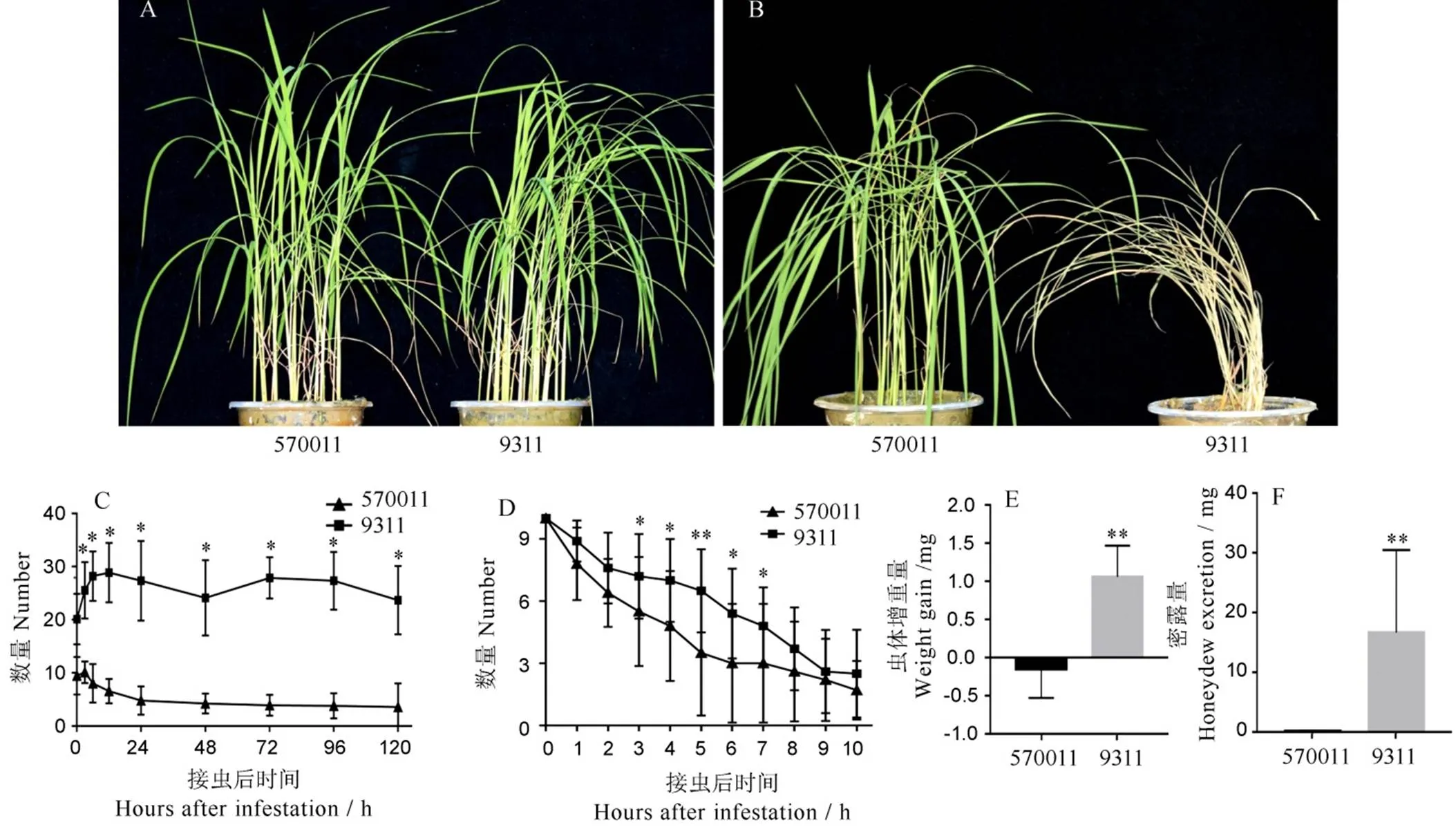
A―接虫前;B―接虫9 d;C―宿主选择试验;D―虫体存活试验;E―单头褐飞虱48 h的虫体增重量;F―单头褐飞虱48 h的虫体蜜露量;*和**分别表示在5%和1%水平差异显著或极显著。
Fig. 1. Physiological resistance characterization ofrice 570011 against BPH.
为探讨籼稻570011对褐飞虱的抗生性和趋避性特征,我们采用虫体宿主选择、存活、蜜露分泌量和虫体增重量试验来衡量。宿主选择试验结果表明,接褐飞虱3 h、6 h、9 h、24 h、36 h、48 h、72 h、96 h、120 h后,感虫材料9311植株上褐飞虱数目为20~30头,始终高于抗性材料570011植株上褐飞虱数目(3~8头),表明抗源对褐飞虱具有显著的趋避性(图2)。褐飞虱的存活试验表明,接虫10 d内,抗性植株上的褐飞虱存活数均低于9311(图3)。此外,抗性植株上单头虫体的体质量平均增量(–0.32 mg)和蜜露分泌量(2.32 mg)都低于感虫植株,体质量平均增量和蜜露分泌量分别为1.25 mg和11.99 mg,表明该抗虫材料明显抑制了褐飞虱的生长和发育。上述试验结果表明籼稻570011对褐飞虱有明显的趋避性和抗生性。
2.2 群体抗虫鉴定及基因定位
苗期抗虫鉴定结果表明,籼稻570011和9311对褐飞虱群体分别表现为极抗和极感。定位群体中124个F3株系的抗感分离情况如图2所示,抗性值范围为2.8~9.0,按照0~6.9和7.0~9.0水平划分为抗(RR和Rr)与感(rr)两种类型,株系数量比为89∶35,卡方检验(χ2=0.69<χ20.01,1=3.84)表明该性状的分离比符合1对基因的分离规律。为了确定抗性基因所在染色体的位置,利用BSA法筛选抗感DNA池,结果发现第4染色体相邻的5个引物4M18.675、4M24.64、4M24.7、4M27.553和4RM11491在抗感亲本和抗感DNA池间的扩增产物同时呈现类似的多态性,而其他染色体区域未发现(表1)。因此,初步确定该抗源中的褐飞虱抗性基因可能位于该区域。利用JoinMap 3.0构建覆盖第4染色体47 cM的局部连锁遗传图谱,该遗传图谱中标记的顺序与日本晴和9311基因组中的参考顺序一致。为进一步明确抗虫基因的位置,利用MapQTL 5检测定位群体在目标连锁群的基因型和表型值,结果在标记4M18.675和4M24.64之间检测到一个抗性位点,最大LOD值为16.23,按照命名规则将其命名为()(图3),该位点解释了F2群体抗褐飞虱抗性变异的33%。
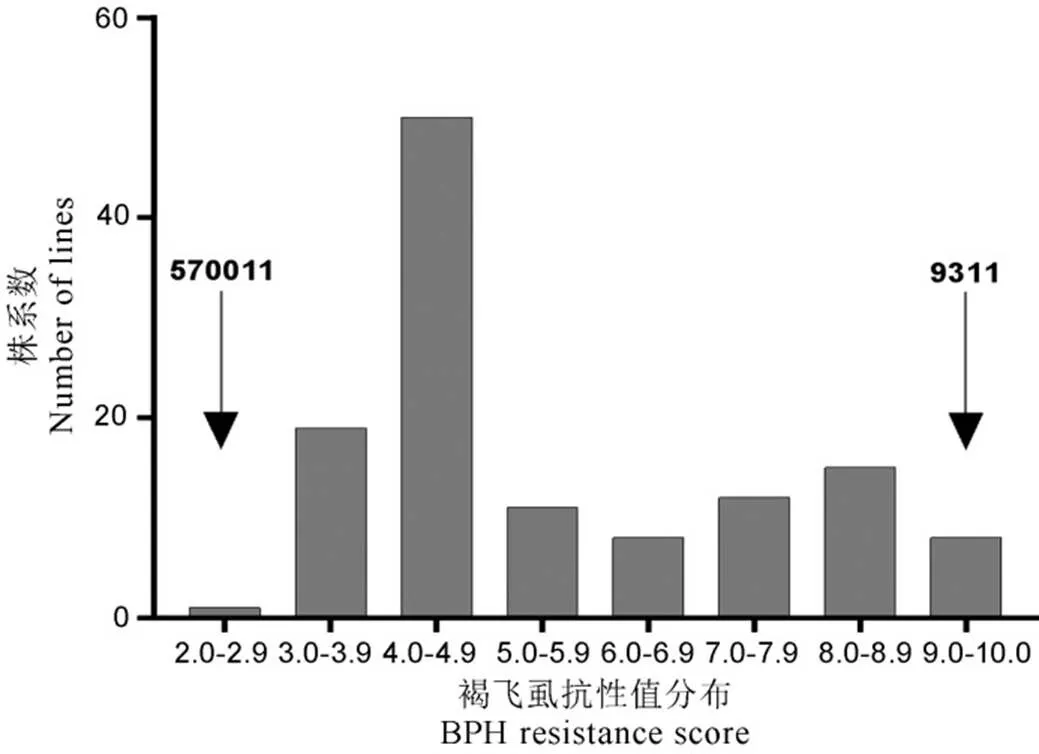
图2 定位群体(9311/570011)的褐飞虱抗性值分布
Fig. 2. Distribution of BPH resistance scores of F3mapping population derived from 9311 / 570011.
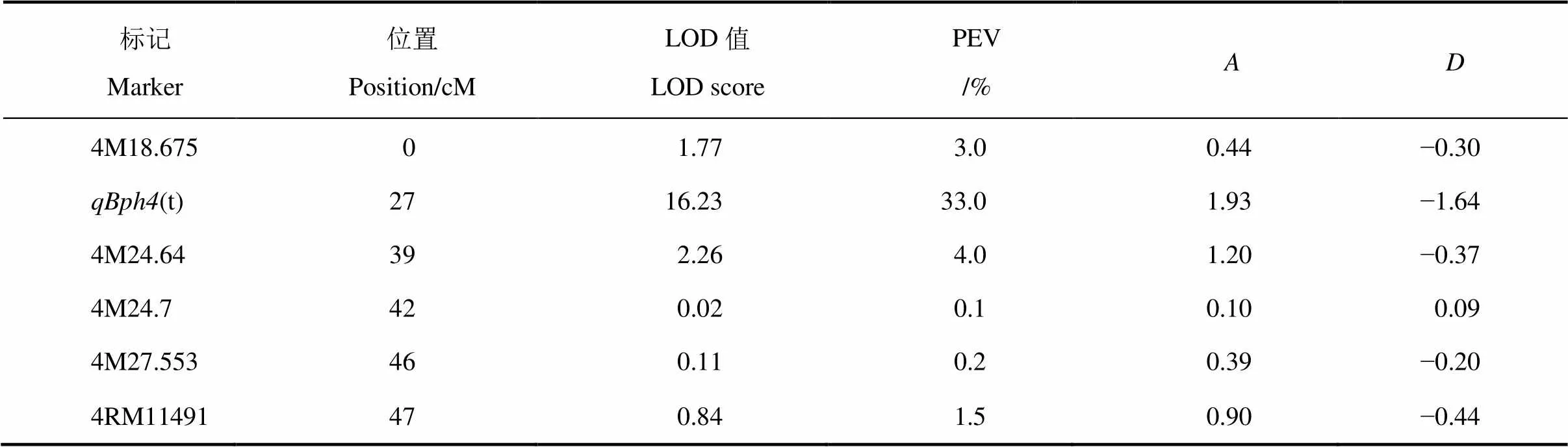
表1 定位群体(9311/570011)的抗性基因定位结果
PEV−该位点可解释的总表型方差百分比;−570011对关联标记的加性效应;−570011对关联标记的显性效应。
PEV, Percentage of total phenotypic variance (PEV) was explained by the locus., Additive effect of the associated marker indicated from 570011;, Dominant effect of the associated marker indicated from 570011.
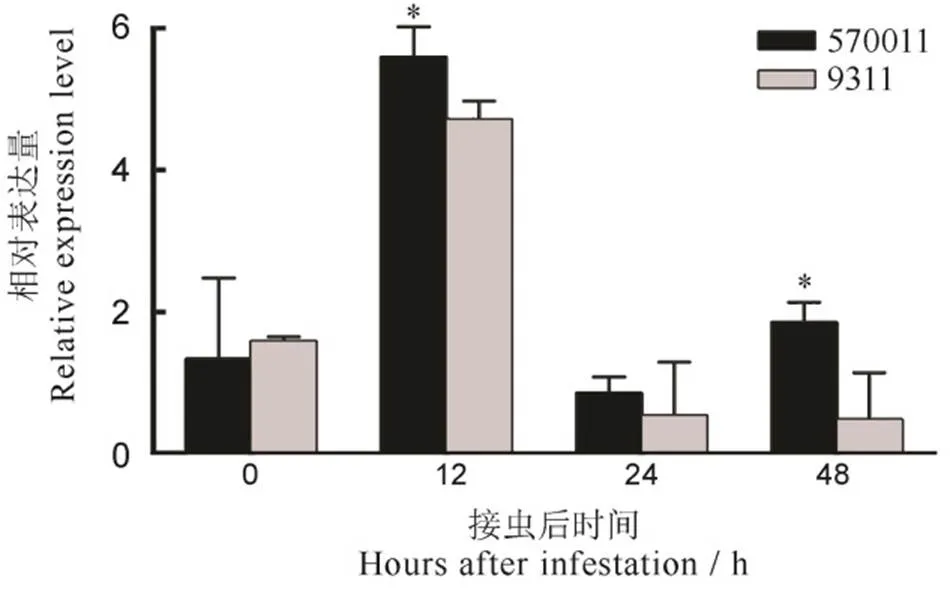
*表示两个实验材料间的基因相对表达量差异达5%显著水平。
Fig. 3. qRT-PCR analysis ofallelic genes derived fromrice 570011 and 9311.
2.3 候选基因分析与确定
综合分析定位区段分子标记锚定的物理位置以及日本晴和9311基因组序列信息,()与已经克隆的重合,我们认为籼稻570011中的抗性基因很可能是的等位基因。于是我们对570011和9311中对应的进行了表达量分析。在接虫0 h、12 h、24 h、48 h后,570011中等位基因的表达量上升并在接虫12 h达到高峰,接着下降并在接虫24 h达到最低,进而再上升;9311中等位基因的表达量趋势也类似,但570011中等位基因在12 h和48 h的表达量均明显高于9311。可见,与感虫材料相比,抗性材料中等位基因对褐飞虱取食有显著的影响。
为了进一步确定是否为的等位基因,我们测定了籼稻570011中的基因组序列,并在EMBL-EBI网站在线比对两者CDS序列。结果表明,570011中基因的CDS序列与公布的CDS序列的同源性达到99.08%,仅存在22处碱基的差异,其中单碱基突变有20处;多碱基突变有2处,其中1处多碱基变异为4个碱基连续突变。氨基酸序列比较发现,两者同源性达到97.96%,共存在20处氨基酸的差异(图4)。基于籼稻570011中基因推定的氨基酸序列在NCBI进行同源性序列比对,将比对获得同源性最高的100个不同氨基酸序列进行进化树分析,发现570011中与同源性最高,亲缘关系最近。以上分析表明籼稻570011中的抗性基因应该是的等位基因。
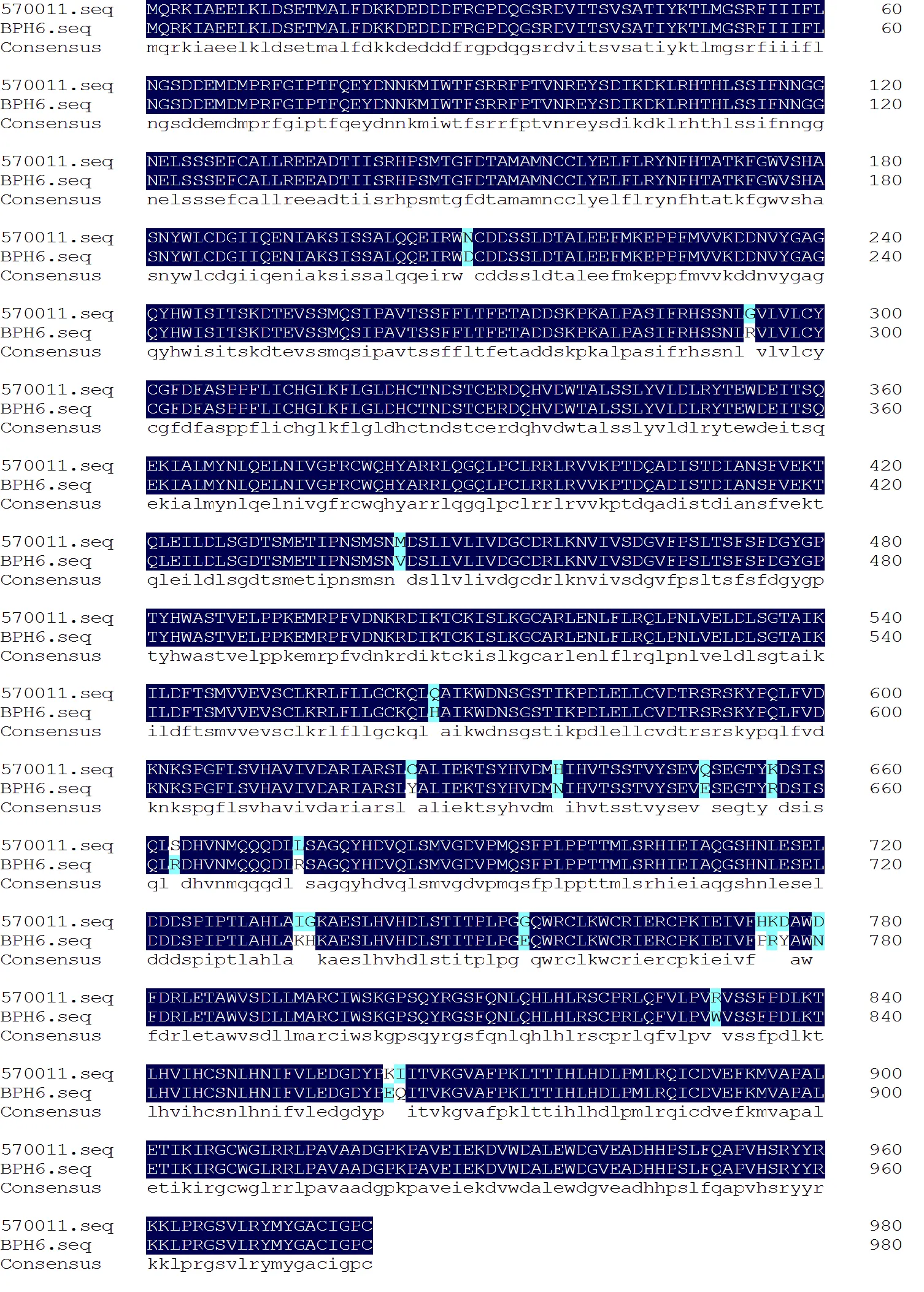
图4 籼稻570011中Os04g35210与已克隆基因BPH6氨基酸序列比对
Fig. 4. Amino acid sequence comparison ofderived fromrice 570011 and cloned gene.
3 讨论
发掘褐飞虱抗性种质和定位抗性基因来持续培育新的抗性品种,是防治日趋严峻的褐飞虱危害的最经济、最有效的途径。目前,抗褐飞虱水稻品种主要通过常规有性杂交育种获得,存在着育种耗时长,选种工作量大的特点,短时间内难以获得优良的抗性品种;而随着农药防治的大规模推广和环境形势的恶化,褐飞虱出现新“生物型”的变异现象,一些原本抗性水稻品种逐渐失去抗性,如携带的IR26、携带的IR36和IR42[22]。通过分子标记辅助选择(molecular marker-assisted selection, MAS)技术或者基因工程育种同样存在着部分褐飞虱抗性基因的抗谱窄、连锁累赘等困难,使得基因的转育效率低。因此,不断发掘广谱抗性、持久抗性和累赘连锁效应小的抗性基因,通过多基因聚合育种选育新品种已经成为防治褐飞虱危害的重要工作。
水稻抗褐飞虱基因在染色体上成簇排列现象明显,比如第4染色体共鉴定15个褐飞虱抗性基因,即、()、、、、()、()、()、()、()、()、、()-、和[4]。本研究通过构建作图群体和基因定位发现,来源于抗性材料 570011的抗褐飞虱基因也位于该区段的分子标记4M18.675和4M24.64间(图2)。该区段内来源于籼稻品种Swarnalata的已经被克隆。该基因介导水稻对褐飞虱具有趋避性、抗生性和耐虫性,其对不同的褐飞虱生物型和白背飞虱具有广谱抗性同时农艺性状没有负效应[10, 20]。本研究中抗源570011对褐飞虱也表现高抗,具有显著的趋避性和抗生性(图1)。此外,褐飞虱的取食均能显著诱导抗性材料中等位基因的表达,与Swarnalata中定量表达规律较一致。基因编码一个包含981个氨基酸的新类型抗性蛋白,是一类等位型非常丰富的基因,郭建平等[10]测定了来源于不同水稻材料的等位基因,将不同类型的SNP差异划分为80种等位型。本研究表明来源于抗源570011的等位基因与的氨基酸同源程度非常高(97.96%),也属于的等位基因,进一步的转基因验证可以最终确定。
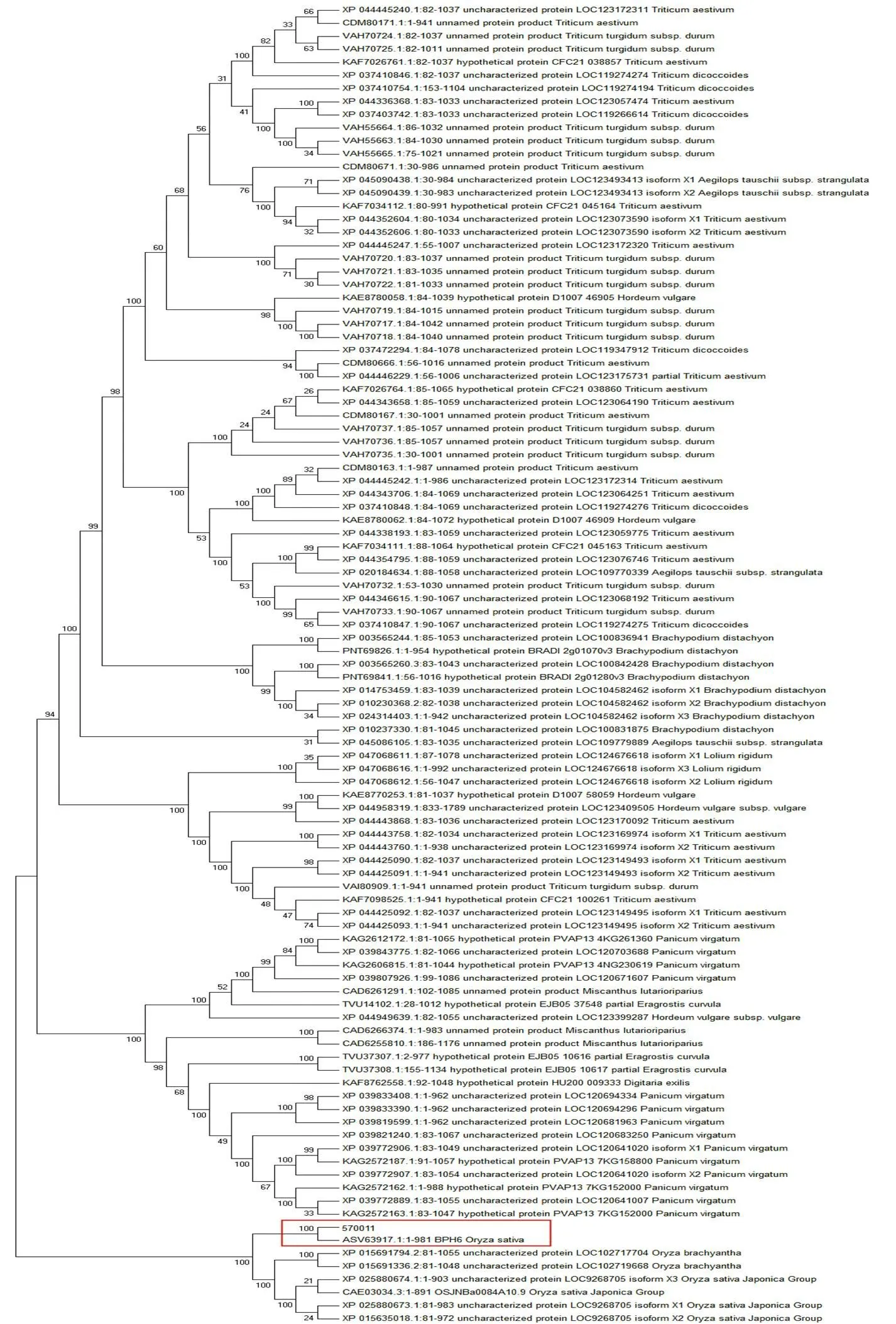
方框内为已克隆BPH6及抗源570011中等位基因对应的氨基酸序列。
Fig. 5. Phylogenetic tree developed with amino acid sequence ofand its homologous sequences.
本研究利用抗源570011与9311杂交构建的定位群体,在第4染色体上的标记4M18.675和4M24.64之间的39 cM区域内检测到一个褐飞虱抗性位点。鉴于该区段有已经定位克隆的基因,我们通过qRT-PCR分析和序列比较,发现抗源570011中基因与已克隆的表达规律相似,序列同源性极高,且两者的亲缘关系也最近,表明本研究鉴定的抗性基因为的一个等位基因。该基因的发掘进一步丰富了的等位型并提供新的抗源,为抗褐飞虱水稻新品种选育提供可利用的抗源。
[1] 程遐年, 吴进才, 马飞. 褐飞虱研究与防治[M]. 北京: 中国农业出版社, 2003: 27-58.
Cheng X N, Wu J C, Ma F. Research and control of brown planthopper[M]. Beijing: China Agricultural Press, 2003: 27-58. (in Chinese)
[2] 黄得润, 陈洁, 赖凤香, 刘光杰, 庄杰云. 东乡野生稻抗褐飞虱QTL分析[J]. 作物学报, 2012, 38(2): 210-214.
Huang D R, Chen J, Lai F X, Liu G J, Zhuang J Y. QTL analysis of resistance to brown planthopper in Dongxiang wild rice[J]., 2012, 38(2): 210-214. (in Chinese with English abstract)
[3] Li Z H, Xue Y X, Zhou H L, Li Y, Usman B, Jiao X Z, Wang X Y, Liu F, Qin B X, Li R B, Qiu Y F. High-resolution mapping and breeding application of a novel brown planthopper resistance gene derived from wild rice (Griff)[J]., 2019, 12(1): 41.
[4] 顾凡, 陈玲, 陈越, 赵昶灵, 肖素勤, 程在全. 水稻抗褐飞虱基因在物理图谱上的锚定[J]. 江西农业学报, 2020, 32(2): 16-23.
Gu F, Chen L, Chen Y, Zhao C L, Xiao S Q, Cheng Z Q. Anchoring of rice brown planthopper resistance gene on physical map[J]., 2020, 32(2): 16-23.
[5] Kaloshian I, Walling L L. Hemipteran and dipteran pests: Effectors and plant host immune regulators[J]., 2016, 58(4): 350-361.
[6] Liu Y, Wu H, Chen H, Liu Y, He J, Kang H, Sun Z, Pan G, Wang Q, Hu J, Zhou F, Zhou K, Zheng X, Ren Y, Chen L, Wang Y, Zhao Z, Lin Q, Wu F, Zhang X, Guo X, Cheng X, Jiang L, Wu C, Wang H, Wan J. A gene cluster encoding lectin receptor kinases confers broad-spectrum and durable insect resistance in rice[J]., 2015, 33(3): 301-305.
[7] Lv W T, Du B, Shangguan X X, Yan Zhao Y, Pan Y F, Zhu L L, He Y Q, He G C. BAC and RNA sequencing reveal the brown planthopper resistance genein a recombination cold spot that mediates an unique defense mechanism[J]., 2014, 11: 15.
[8] Zhou C, Zhang Q, Chen Y, Huang J, Guo Q, Li Y, Wang WS, Qiu Y F, Guan W, Zhang J, Guo J P, Wu D, Zheng X H, Nie LY, Tan J Y, Huang C M, Ma Y H, Yang F, Fu X Q, Du B, Zhu L L, Chen R Z, Li Z K, Yuan L P, He G C. Balancing selection and wild gene pool contribute to resistance in global rice germplasm against planthopper[J]., 2021, 63(10): 1695-1711.
[9] Du B, Zhang W L, Liu B F, Hu J, Wei Z, Shi Z Y, He R F, Zhu L L, Chen R Z, Han B, Zhang Q F, He G C. Identification and characterization of, a gene conferring resistance to brown planthopper in rice[J]., 2009, 106(52): 22163-22168.
[10] Guo J P, Xu CX, Wu D, Zhao Y, Wang X X, Qiu Y F, Ouyang Y D, Cai B D, Liu X, Jing S L, Shangguan X X, Wang H Y, Ma Y H, Hu L, Wu Y, Shi S J, Wang W L, Zhu L L, Xu X, Chen R Z, Feng Y Q, Du B, He G C.encodes an exocyst-localized protein and confers broad resistance to planthoppers in rice[J]., 2018, 50(2): 297-306.
[11] Ji H, Kim SR, Kim Y H, Suh J P, Park H M, Sreenivasulu N, Misra G, Kim S M, Hechanova S L, Kim H, Lee G S, Yoon U H, Kim T H, Lim H, Suh S C, Yang J, An G, Jena K K. Map-based cloning and characterization of thegene from wild rice conferring resistance to brown planthopper (BPH) insect pest[J]., 2016, 6(1): 34376.
[12] Tamura Y, Hattori M, Yoshioka H, Yoshioka M, Takahashi A, Wu J Z, Sentoku N, Yasui H. Map-based cloning and characterization of a brown planthopper resistance genefromL. ssp.cultivar ADR52[J]., 2015, 4: 5872.
[13] Zhao Y, Huang J, Wang Z Z, Jing S L, Wang Y, Ouyang Y D, Cai B D, Xin X F, Liu X, Zhang C X, Pan Y F, Ma R, Li Q F, Jiang W H, Zeng Y, Shangguan X X, Wang H Y, Du B, Zhu L L, Xu X, Feng Y Q, He S Y, Chen R Z, Zhang Q F. Allelic diversity in an NLR geneenables rice to combat planthopper variation[J]., 2016, 113: 12850-12858.
[14] Shi S J, Wang H Y, Nie L Y, Tan D, Zhou C, Zhang Q, Li Y, Du B, Guo J P, Huang J, Wu D, Zheng X H, Guan W, Shan J H, Zhu L L, Chen R Z, Xue L J, Walling L L, He G C.confers resistance to brown planthopper by fortifying sclerenchyma in rice leaf sheath[J]., 2021, 14(10): 1714-1732.
[15] Wang Y, Cao L, Zhang Y, Cao C, Liu F, Huang F, Qiu Y, Li R, Luo X. Map-based cloning and characterization of, a B3 domain-containing recessive gene conferring brown planthopper resistance in rice[J]., 2015, 66(19): 6035-6045.
[16] Ren J, Gao F, Wu X, Lu X, Zeng L, Lü J, Sun X, Luo H, Ren G., a novel gene encoding an unknown SCR domain-containing protein, confers resistance against the brown planthopper in rice[J]., 2016, 6: 37645.
[17] Cohen M B, Alam S N, Medina E B, Bernal C C. Brown planthopper,, resistance in rice cultivar IR64: Mechanism and role in successfulmanagement in Central Luzon, Philippines[J]., 1997, 85: 221-229.
[18] Alam S N, Cohen M B. Durability of brown planthopper,, resistance in rice variety IR64 in greenhouse selection studies[J]., 1998, 89: 71-78.
[19] Qiu Y F, Guo J P, Jing S L, Zhu L L, He G C. High-resolution mapping of the brown planthopper resistance genein rice and characterizing its resistance in the 9311 and Nipponbare near isogenic backgrounds[J]., 2010, 121: 1601-1611.
[20] Lin J B, Wang X Y, Li Y, Bi F G, Cheng L, Huang F K, Li R B, Qiu Y F. Fine mapping, candidate genes analysis, and characterization of a brown planthopper (Stål) resistance gene in the rice variety ARC5984[J]., 2020, 216:13.
[21] Murray M G, Thompson W F. Rapid isolation of high molecular weight plant DNA[J]., 1980, 8(19): 4321-4325.
[22] 陶蓉, 潘根, 江玲, 程遐年, 刘裕强, 万建民. 籼稻品种‘BP360e’抗褐飞虱遗传分析及基因定位[J]. 南京农业大学学报, 2019(1): 14-20.
Tao R, Pan G, Jiang L, Cheng D N, Liu Y Q, Wan J M. Genetic analysis and gene mapping of brown planthopper resistance in indica rice variety 'BP360e' [J]., 2019(1): 14-20. (in Chinese with English abstract)
Genetic Analysis and Identification of Brown Planthopper Resistance Gene inRice Accession 570011
CHENG Ling1, 2, HUANG Fugang3, QIU Yipu3, WANG Xinyi3, SHU Wan2, QIU Yongfu3, LI Fahuo3,*
(1Hubei Key Laboratory of Food Crop Germplasm and Genetic Improvement, Wuhan 430064, China;2College of Agriculture, Yangtze University, Jingzhou 434025, China;3College of Agriculture, Guangxi University/State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Nanning 530004, China;*Corresponding author, email: 316801153@qq.com)
【Objective】The aim is to identify brown planthopper (BPH) resistance gene in resistantrice accession 570011, and provide new materials for insect-resistant rice breeding.【Method】A seedling bulk test was conducted to evaluate the BPH resistance of F3population, and a local genetic map was developed based on the genotype of the mapping population by JoinMap 3.0. The resistance locus was then detected and genetic effect was evaluated by MapQTL 5. The expression of one candidate resistance gene was analyzed with qRT-PCR, and the corresponding CDS and amino acid sequences of the candidate gene were compared.【Result】Accession 570011 showed high resistance to BPH at the seedling stage and significant antibiosis and antixenosis against BPH. The ratio of resistant lines (score < 7) to susceptible lines (score≥7) in F3population was 89:35, which accorded with the separation law of one dominant gene. One BPH resistance locus was detected in the 39 cM region flanked by markers 4M18675 and 4M24.64 on chromosome 4, which could be allelic to the cloned. qRT-PCR analysis indicated that the expression ofallele in accession 570011 was significantly higher than that in susceptible line 9311. Accession 570011 respectively shared the similarity of 99.08% and 97.96% in CDS and amino acid sequence comparing with the cloned gene. Moreover, they closely clustered in the phylogenetic tree. All the results suggested that the BPH resistance gene derived from accession 570011 was allelic to【Conclusion】Accession 570011 is highly resistant to BPH and carries one major resistance gene, which is an allele of. The identification of the resistance gene enriches the alleles ofand provides new materials for insect resistant rice breeding.
; brown planthopper;; allele; physiological resistance mechanism
10.16819/j.1001-7216.2023.220601
2022-06-01;
2022-07-12。
中央引导地方科技发展资金专项(桂科ZY21195040); 粮食作物种质创新与遗传改良湖北省重点实验室开放课题(2021lzjj09); 广西水稻遗传育种重点实验室开放课题(2022-36-Z01-KF04)。
