人β防御素3和γ干扰素在MAPK信号通路中的相互诱导及联合抗甲型流感病毒的机制*
2023-05-17唐源祝洁杨小余张乙进罗红江滟
唐源,祝洁,杨小余,张乙进,罗红,江滟,3***
(1.贵州医科大学 医学检验学院 临床微生物与免疫学教研室,贵州 贵阳 550004;2.贵州医科大学 实验动物中心,贵州 贵阳 550025;3.贵州医科大学附属医院 临床检验中心 微生物免疫科,贵州 贵阳 550004)
甲型流感病毒(influenza A virus,IAV)是常见的呼吸道病原体,具有高度传染性[1-3]。据报道,IAV 感染每年可导致29万~65万人死亡,严重威胁人类健康[4]。黏膜上皮细胞分泌的抗病毒蛋白可直接杀死流感病毒、激活吞噬细胞并诱导其他抗病毒蛋白的产生[5-6]。β防御素3(β defensin-3,BD-3)属于抗菌肽家族[7],处于抗病毒免疫的第一道防线,BD-3和γ干扰素(interferon-γ,IFN-γ)在IAV感染早期表达显著上调[8-9]。本课题组前期研究表明,BD-3可抑制IAV进入细胞,并增强小鼠对流感病毒的抵抗力[10];此外,还可诱导其他抗病毒蛋白的生成、抑制IAV复制[10]。例如,BD-3可诱导NK细胞分泌抗病毒蛋白IFN-γ[11],IFN-γ是Ⅱ型干扰素的唯一成员,其产生对于病毒的清除和适应性免疫反应的发生发展至关重要。尽管IFN-γ不能直接杀死IAV,但是它可诱导干扰素刺激基因 (interferon-stimulated genes,ISGs)来抑制IAV[12-14]。研究表明,在角质细胞和人脐静脉内皮细胞中,IFN-γ可诱导人β防御素3(human β defensin-3,HBD3)的表达[15- 16],并认为HBD3和IFN-γ的表达均与丝裂源活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路的激活相关[17-18],但其中的机制仍不清楚。本研究基于MAPK通路,探讨在人支气管上皮细胞(human bronchial epithelial cell line,HBEpiC)BEAS-2B中,HBD3和IFN-γ在抗IAV中的作用及机制。
1 材料与方法
1.1 实验材料
1.1.1细胞和病毒株 BEAS-2B细胞购自中国科学院昆明细胞库,IAVA/PR/8/34(H1N1)毒株由本实验室保存。
1.1.2主要试剂 BEAS-2B细胞及其专用无血清培养基KCB M006购自中国科学院昆明细胞库,DMEM高糖培养基购自美国Gibco公司,IFN-γ购自美国Proteintech公司,HBD3购自Novus公司,P38 MAPK通路抑制剂SB203580,EPK通路抑制剂U1026及JNK通路抑制剂SP600125购自上海碧云天公司,siHBD3、siNC由广州锐博公司设计合成;riboFECTTMCP 转染试剂购自广州锐博公司,IFN-γ中和抗体、对照抗体购自美国R&D公司,总RNA提取试剂盒购自北京天根生物有限公司,逆转录试剂盒购自大连Takara生物有限公司,酶联免疫吸附实验 (ELISA)试剂盒购自武汉Elabscience公司,p38 MAPK、p-p38 MAPK、ERK及p-ERK抗体购自美国CST公司,JNK、p-JNK抗体购自美国Abcam公司,H1N1核蛋白(NP)抗体购自北京博奥森生物技术有限公司,GAPDH抗体、羊抗兔IgG二抗购自武汉博士德生物工程有限公司。
1.2 研究方法及观察指标
1.2.1细胞培养 BEAS-2B细胞采用BEAS-2B细胞专用无血清培养基KCB M006,在37 ℃、5% CO2环境下培养。
1.2.2病毒增殖 H1N1接种于9 d龄鸡胚尿囊腔中进行增殖,37 ℃培养48 h后收集鸡胚尿囊液,过滤后于-80 ℃保存。
1.2.3IFN-γ与HBD3 将BEAS-2B细胞以每孔1×108个/L接种于6孔板,培养48 h后吸弃培养基,分为对照组、不同浓度HBD3或IFN-γ处理组、25.0 μg/L IFN-γ组或1.00 mg/L HBD3组。对照组加入新鲜无血清DMEM培养基分别培养4 h、12 h、24 h、48 h;不同浓度HBD3或IFN-γ处理组分别用不同浓度的HBD3(0.25、0.50、1.00、2.00 mg/L)或IFN-γ(12.5、25.0、50.0、100.0 μg/L)处理细胞12 h;25.0 μg/L IFN-γ组或1.00 mg/L HBD3组分别处理BEAS-2B细胞4 h、12 h、24 h、48 h。
1.2.4MAPK通路抑制剂 将BEAS-2B细胞以每孔1×108个/L接种于6孔板,培养48 h后吸弃培养基,对照组加入新鲜无血清DMEM培养基培养4 h,其余各组分别使用p38 MAPK通路抑制剂SB203580(20 μmol/L)、ERK通路抑制剂U1026(20 μmol/L)、JNK通路抑制剂SP600125(10 μmol/L)处理BEAS-2B细胞1 h,吸弃上清后,用25.00 μg/L IFN-γ或1.00 mg/L HBD3处理细胞4 h。
1.2.5病毒感染和干预 BEAS-2B细胞以再孔1×108个/L接种于6孔板,48 h后吸弃上清,分为对照组、HBD3和/或IFN-γ处理组、对照siRNA组(siNC)、HBD3 siRNA组(siHBD3)、对照抗体组(Control Ab组)、IFN-γ中和抗体组(IFN-γ Ab组)。对照组加入新鲜无血清培养基进行培养;HBD3和/或IFN-γ处理组分别用HBD3(1.00 mg/L)和/或IFN-γ(25.0 μg/L)处理细胞12 h后,5×TCID50H1N1感染BEAS-2B细胞1 h,吸弃上清,加入无血清DMEM处理12 h。siNC组、siHBD3组分别转染对照siRNA(siNC,N Control_05815)或30 nmol/L hBD3 siRNA(siHBD3:5′-UGUGGAAAUGCCUUCUUAA-3′) 24 h,之后加入HBD3(1.00 mg/L)和/或IFN-γ(25.0 μg/L)处理细胞12 h后,5 × TCID50H1N1感染BEAS-2B细胞1 h,吸弃上清,加入无血清DMEM处理12 h。Control Ab组、IFN-γ Ab组分别用Control Ab(0.5 mg/L)或IFN-γ Ab(0.5 mg/L)以及HBD3(1.00 mg/L)和/或IFN-γ(25.0 μg/L)共同处理细胞12 h后,5×TCID50H1N1感染BEAS-2B细胞1 h,吸弃上清,加入无血清DMEM处理12 h。
1.2.6实时荧光定量PCR(quantitative reverse transcription,qRT-PCR)检测目的分子基因水平 按照总RNA提取试剂盒步骤提取细胞总RNA,根据逆转录试剂盒操作说明将RNA逆转录为cDNA,将相应的引物序列(表1)、cDNA、Ultra-SYBR Mixture等试剂按照说明书上的比例加入PCR 8联管中、置于实时荧光定量PCR仪。反应结束后记录各组Ct值,所有样本均设置3个复孔,以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)作为内参,使用2-ΔΔCt法分析相对基因表达量。

表1 qRT-PCR引物序列Tab.1 The primer sequences used for qRT-PCR
1.2.7酶联免疫吸附试验 (enzyme-linked immunosorbent assay,ELISA)检测HBD3和IFN-γ的蛋白量 处理后的BEAS-2B细胞用1×PBS洗涤2次后超声破碎细胞,随后12 000 r/min离心10 min,收集上清液,按照试剂盒操作说明书测定HBD3和IFN-γ的蛋白量。
1.2.8Western blot检测蛋白表达量 蛋白样品(20 μg)经12% SDS-PAGE电泳分离蛋白,分离结束后湿转到PVDF膜上。3%牛血清白蛋白封闭2 h,加入相应一抗4 °C过夜。之后,用1× TBST洗膜3次,加入二抗室温摇床孵育1 h。使用电化学发光法对蛋白条带进行显影,并通过Image J软件对条带进行灰度值分析。
1.3 统计学分析
2 结果
2.1 IFN-γ与HBD3相互诱导表达
浓度为12.5、25.0、50.0、100.0 μg/L IFN-γ分别处理BEAS-2B细胞12 h后,HBD3 mRNA和蛋白表达与对照组相比明显增加(t=4.308、7.334、5.972、3.747,P<0.05或P<0.01;t=70.67、123.8、82.26、58.13,P<0.01),25.0 μg/L IFN-γ作用时HBD3蛋白表达达到峰值(t=50.21、36.31、51.7,P<0.01);0.25、0.50、1.00、2.00 mg/L HBD3分别处理细胞12 h后,IFN-γ的mRNA和蛋白表达与对照组相比明显增加 (t=3.914、4.920、5.544、3.809,P<0.05或P<0.01;t=5.748、3.600、10.550、6.305,P<0.05或P<0.01),在1.00 mg/L HBD3作用时IFN-γ蛋白表达达到峰值(t=4.52、9.96、4.82,P<0.05或P<0.01)。用25.0 μg/L IFN-γ或1.00 mg/L HBD3分别处理BEAS-2B细胞4、12、24及48 h的结果显示,25.0 μg/L IFN-γ处理不同时间,HBD3的mRNA和蛋白表达与对照组相比明显增加(t=5.354、7.334、4.027,P<0.05或P<0.01;t=109.70、123.80、53.06、28.94,P<0.05或P<0.01),在12 h达到峰值;1.00 mg/L HBD3处理不同时间后,IFN-γ的mRNA和蛋白表达增加(t=5.852、8.727、5.544,P<0.01;t=22.890、10.550、9.221,P<0.01),在12 h达到峰值。见图1、图2。结果表明,IFN-γ与HBD3在BEAS-2B细胞中可相互诱导表达,最佳诱导浓度分别为25.0 μg/L和1.00 mg/L,最佳诱导时间为12 h。

注:A、B为不同浓度IFN-γ对HBD3 mRNA及蛋白表达的影响,C、D为25.0 μg/L IFN-γ作用不同时间对HBD3 mRNA及蛋白表达的影响;与对照组(Con组)相比,(1)P<0.05,(2)P<0.01;与25.0 μg/L IFN-γ组相比,(3)P<0.01。图1 IFN-γ对BEAS-2B细胞HBD3 mRNA及蛋白表达的影响Fig.1 Effect of IFN-γ on HBD3 mRNA and protein expression in BEAS-2B cells
2.2 IFN-γ和HBD3通过MAPK通路相互诱导表达
用不同浓度的IFN-γ(100.0、50.0、25.0、12.5 μg/L)处理BEAS-2B细胞12 h,Western blot结果显示,与对照组相比,p-JNK、p-ERK、p-p38 MAPK表达均明显增加(t=10.720、10.450、8.436、8.038,P<0.01;t=10.47、33.22、12.52、70.06,P<0.01;t=13.250、13.720、8.366,P<0.01;图3)。不同浓度的HBD3(2.00、1.00、0.50、0.25 mg/L)处理BEAS-2B细胞12 h后,Western blot结果显示,与对照组相比,p-JNK在1.00 mg/L HBD3作用时表达显著增加(t=7.015,P<0.01),p-ERK、p-p38 MAPK表达均明显增加(t=10.720、11.570、17.160、6.066,P<0.01;t=20.27、18.25、17.18、18.24,P<0.01;图4)。采用p38 MAPK通路抑制剂SB203580(20 μmol/L)、ERK通路抑制剂U0126(20 μmol/L)或JNK通路抑制剂SP600125(10 μmol/L)预处理BEAS-2B细胞,结果显示,与25.0 μg/L IFN-γ组或1.00 mg/L HBD3组相比,SB203580、U0126及SP600125预处理可明显降低IFN-γ诱导HBD3 mRNA及蛋白水平的增加(t=7.640、5.571、8.053,P<0.01;t=52.23、58.04、67.28,P<0.01)及HBD3诱导IFN-γ mRNA及蛋白水平的增加(t=4.718、5.484、4.927,P<0.01;t=5.395、5.599、6.234,P<0.01;图5)。以上结果表明,IFN-γ和HBD3可通过MAPK通路相互诱导表达。

注:A、B为不同浓度HBD3对BEAS-2B细胞中IFN-γ mRNA及蛋白的表达的影响,C、D为1.00 mg/L HBD3作用不同时间对BEAS-2B细胞IFN-γ mRNA及蛋白表达的影响;与对照组(Con组)相比,(1)P<0.05,(2)P<0.01;与1.00 mg/L HBD3组相比,(3)P<0.05,(4)P<0.01。图2 HBD3对BEAS-2B细胞IFN-γ mRNA及蛋白表达的影响Fig.2 Effect of HBD3 on IFN-γ mRNA and protein expression in BEAS-2B cells
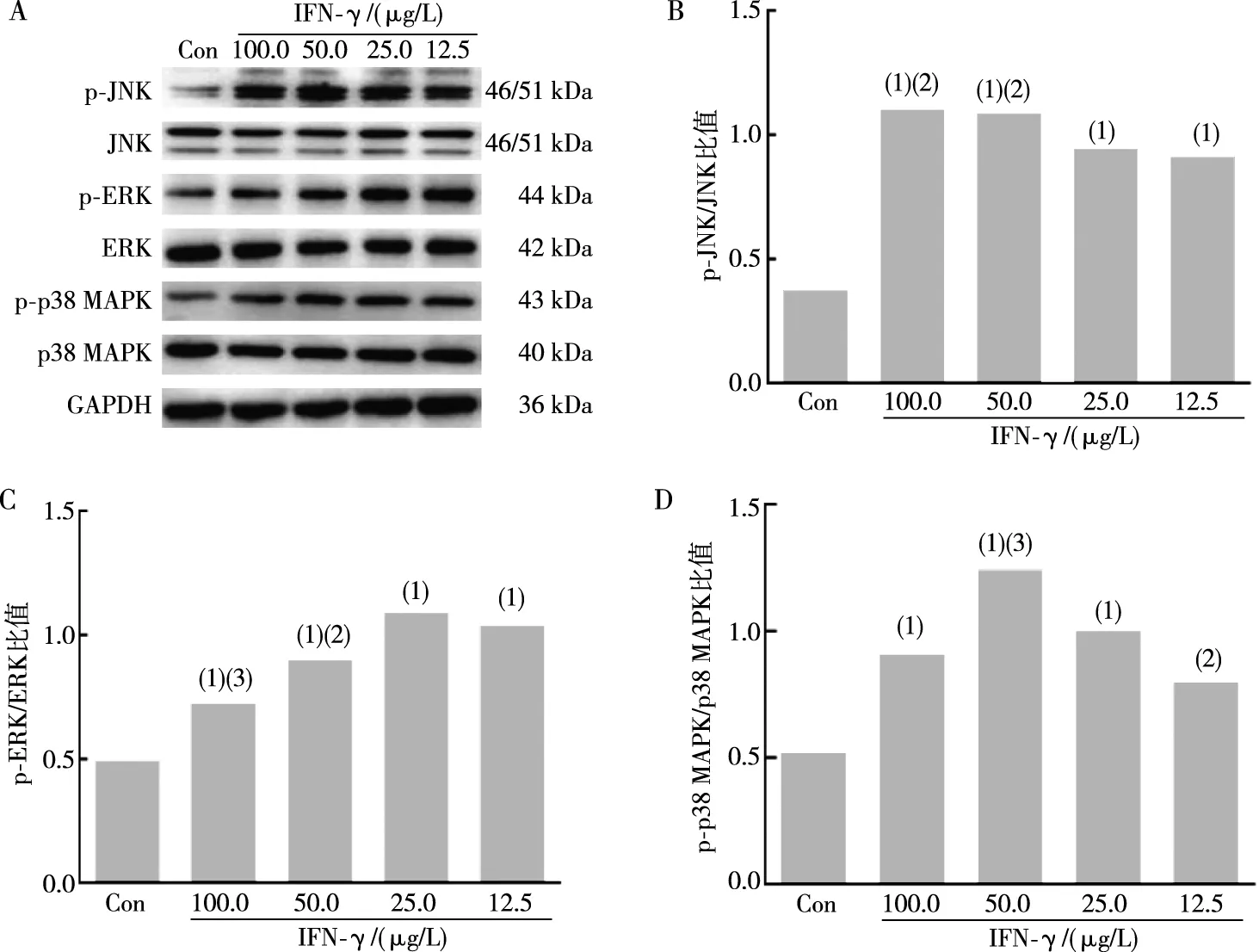
注:A为p-JNK、JNK、p-ERK、ERK、p-p38 MAPK、p38 MAPK蛋白条带结果,B、C、D为p-JNK/JNK、p-ERK/ERK、p-p38 MAPK/p38 MAPK比值;(1)与对照组(Con组)相比,P<0.01;与25.0 μg/L IFN-γ组相比,(2)P<0.05,(3)P<0.01。图3 IFN-γ作用后BEAS-2B细胞p-p38 MAPK、p-ERK、p-JNK 蛋白表达Fig.3 Expression of p-p38 MAPK,p-ERK,and p-JNK protein in BEAS-2B cells after IFN-γ treatment
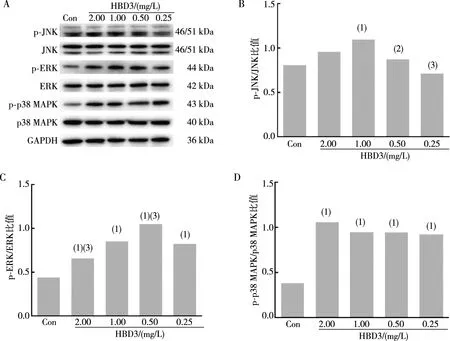
注:A为p-JNK、JNK、p-ERK、ERK、p-p38 MAPK、p38 MAPK蛋白条带结果,B、C、D为p-JNK/JNK、p-ERK/ERK、p-p38 MAPK/p38 MAPK定量结果;(1)与对照组(Con组)相比,P<0.01;与1.00 mg/L HBD3组相比,(2)P<0.05,(3)P<0.01。图4 HBD3作用后BEAS-2B细胞p-p38 MAPK、p-ERK、p-JNK 蛋白表达Fig.4 Expression of p-p38 MAPK,p-ERK,and p-JNK protein in BEAS-2B cells after HBD3 treatment

注:A、B分别为HBD3 mRNA相对表达水平及蛋白浓度,C、D分别为IFN-γ mRNA相对表达水平及蛋白浓度;(1)与单独IFN-γ(25.0 μg/L)+或HBD3(1.00 mg/L)+组相比,P<0.01;(2)与SB203580、U0126、SP600125、0.1%DMSO、IFN-γ全-组相比,P<0.01。图5 MAPK通路抑制剂对BEAS-2B细胞HBD3和IFN-γ表达水平的影响Fig.5 Effect of MAPK pathway inhibitors on the expression level of HBD3 and IFN-γ in BEAS-2B cells
2.3 IFN-γ和HBD3相互诱导增强抗IAV作用
用25.0 μg/L IFN-γ和/或1.00 mg/L HBD3处理BEAS-2B细胞12 h后,用5×TCID50H1N1感染细胞1 h。结果显示,HBD3和IFN-γ单独或联合作用均可有效抑制H1N1 NP mRNA及蛋白表达(t=7.986、4.645、12.090,P<0.01;t=20.22、13.20、25.37,P<0.01),且2者联合使用对H1N1 NP mRNA及蛋白表达的抑制效果更佳(t=4.105、7.445,P<0.05或P<0.01;t=5.150、12.170,P<0.05或P<0.01);转染siHBD3或IFN-γ中和抗体作用后,用5×TCID50H1N1感染细胞1 h,H1N1 NP的mRNA及蛋白水平的结果显示,siHBD3转染显著减弱了IFN-γ对H1N1 NP mRNA及蛋白的抑制作用(t=17.25,P<0.01;t=16.92,P<0.01);然而,IFN-γ中和抗体作用后HBD3对H1N1 NP mRNA及蛋白的抑制作用均无显著影响(t=2.00,P>0.05;t=0.44,P>0.05)。见图6、图7。
3 讨论
黏膜上皮细胞分泌的抗病毒蛋白在IAV感染过程中发挥着重要作用,病毒感染早期或期间诱导抗病毒蛋白的生成有助于提高宿主抵抗病毒的能力[19]。研究表明,在BEAS-2B细胞中,表没食子儿茶素没食子酸酯可诱导IFN-λ的分泌抑制IAV感染[20]。此外,流感病毒感染后呼吸道上皮细胞分泌的BD-3和IFN-γ在宿主恢复过程中也起着重要的作用[8-9]。BD-3属于β防御素家族,具有很强的抗病毒活性。BD-3可通过破坏IAV的包膜,阻止IAV进入细胞并诱导其他抗病毒蛋白的生成来抑制IAV[10]。IFN-γ由活化的T细胞、NK细胞及呼吸道上皮细胞生成[8,21-24]。IFN-γ的生成对病毒的清除及适应性免疫的发展至关重要,其可通过诱导ISGs的表达抑制IAV复制[13-14]。尽管之前的研究已表明BD-3及IFN-γ可抑制IAV,但2者的抗IAV机制仍不清楚,进一步探索BD-3及IFN-γ的抗IAV机制有助于更好地防治IAV感染。

注:A、B、C表示H1N1 NP mRNA表达水平;(1)与单H1N1+组相比,P<0.01;与H1N1、IFN-γ、HBD3全+组相比,(2)P<0.05,(3)P<0.01;(4)与H1N1、IFN-γ、siHBD3全+组相比,P<0.01。图6 BEAS-2B细胞H1N1、IFN-γ、HBD3、siHBD3、IFN-γ Ab单独或联合作用对H1N1 NP mRNA表达的影响Fig.6 Effects of H1N1,IFN-γ,HBD3,siHBD3,and IFN-γ Ab alone or their combination on H1N1 NP mRNA expression in BEAS-2B cells

注:A、C、E分别为NP蛋白条带结果,B、D、F为NP蛋白定量结果;(1)与单H1N1+组相比,P<0.01;与H1N1、IFN-γ、HBD3全+组相比,(2)P<0.05,(3)P<0.01;(4)与H1N1、IFN-γ、siHBD3全+组相比,P<0.01。图7 BEAS-2B细胞H1N1、IFN-γ、HBD3、siHBD3、IFN-γ Ab单独或联合作用对H1N1 NP蛋白表达的影响Fig.7 EffectS of H1N1,IFN-γ,HBD3,siHBD3,and IFN-γ Ab alone or their combination on H1N1 NP Protein expression level in BEAS-2B cells
抗病毒蛋白可通过诱导其他抗病毒细胞因子的表达增强其抗病毒功能。此前的研究表明,在不同细胞中BD-3和IFN-γ可相互诱导表达。例如,在角质细胞和人脐静脉内皮中,IFN-γ可诱导BD-3 mRNA的表达[15-16]且BD-3可诱导NK细胞中IFN-γ的分泌[11]。本研究发现IFN-γ作用后HBD3表达明显升高,同时,HBD3作用后IFN-γ表达也明显增加。结果表明,在BEAS-2B细胞中,HBD3与IFN-γ可相互诱导表达。然而,HBD3与IFN-γ的相互诱导并不是剂量依赖性的,这可能与HBD3和IFN-γ免疫调节的双重作用有关。研究表明,IFN-γ可抑制流感病毒感染后期的抗菌防御[25],而HBD3在抗菌活性及炎症反应方面有着双重作用[26]。
多项研究表明,HBD3和IFN-γ的生成与MAPK信号通路相关[17-18]。穿心莲内酯、冬凌草素及异甘草素可通过p38、ERK、JNK信号通路诱导肠上皮细胞中HBD3的表达,并且牙龈卟啉单胞菌感染后可通过p38、ERK信号通路诱导IFN-γ的生成[27-28]。本研究发现IFN-γ及HBD3可明显增加p-p38 MAPK、p-ERK及p-JNK蛋白表达,且抑制p38 MAPK、ERK及JNK信号通路后可明显减少IFN-γ与HBD3的相互诱导表达。以上结果表明,IFN-γ及HBD3可通过MAPK通路相互诱导表达。
HBD3和IFN-γ是重要的抗病毒蛋白[29-30]。本课题组前期研究发现,BD-3可通过抑制IAV吸附和进入过程抑制IAV的复制[10]。也有研究发现,重组鸭IFN-γ在体内外均可抑制流感病毒H5N1的复制[14]。本研究发现HBD3和IFN-γ可显著抑制H1N1 NP的表达,且HBD3和IFN-γ联合作用的抑制作用更显著。这与此前的研究发现IFN-γ可以促进IFNα/β的抗病毒作用相似[31-32]。Tewary等[33]的研究发现,HBD3可增加IFN表达,并增加机体免疫作用。这些结果表明,HBD3与IFN-γ的联合抗IAV作用可能与其相互诱导作用有关。进一步研究发现,沉默HBD3减弱了IFN-γ对H1N1 NP表达的抑制作用。然而,IFN-γ中和抗体作用后对HBD3抑制H1N1 NP表达的作用无显著影响。这可能是由于HBD3能够直接杀死IAV,而IFN-γ必须通过诱导ISGs或其他抗病毒蛋白的生成才能发挥其抗病毒活性。然而,本研究中HBD3诱导IFN-γ生成的量不足以诱导ISGs或其他抗病毒蛋白的生成。
综上所述,本研究结果表明,在BEAS-2B细胞中,HBD3和IFN-γ可通过MAPK信号通路相互诱导发挥抗IAV作用。这一结果也揭示了宿主免疫蛋白HBD3及IFN-γ抗IAV的新机制。但HBD3和IFN-γ的抗病毒作用不仅限于诱导相关的抗病毒蛋白,还包括免疫细胞的激活、适应性免疫及免疫平衡的调节[34-35]。为了全面了解HBD3和IFN-γ相互诱导抑制IAV的机制,在之后的研究中将使用动物模型研究HBD3和IFN-γ的相互诱导机制以及其在体内的抗IAV作用,为HBD3和IFN-γ的临床应用建立理论基础。
