巨细胞病毒IgM和IgG抗体在安图AutoLumoA2000Plus化学发光仪上的性能验证
2023-05-16唐贵文华益帆唐耀敏何国丹
唐贵文,华益帆,唐耀敏,何国丹
(1.贵阳市第二人民医院检验科,贵州 贵阳 550081 ;2.贵州医科大学,贵州 贵阳 550004)
巨细胞病毒(cytomegalovirus,CMV)广泛存在于不同的人群中。CMV 感染是一个被忽视的重大公共卫生问题,全球近80% 人存在CMV 感染。CMV感染的发生与地理位置、种族和经济状况有关。发达国家的CMV 感染率低于发展中国家,发展中国家的CMV 感染率较高。育龄期女性的CMV 血清特异性抗体阳性率高达80% ~100%,新生儿先天性CMV感染率为0.6% ~6.1%[1]。CMV 感染易导致孕产妇发生不良妊娠事件。目前,临床上对CMV 疫苗的需求十分迫切,虽然疫苗研究取得了一定进展,但至今尚无CMV 疫苗上市[2]。同时,目前也没有更有效的措施来避免CMV 感染,故早发现、早治疗尤为重要。为保证CMV 免疫球蛋白M(IgM)和免疫球蛋白G(IgG)抗体的检测结果准确、有效,进行该项目的验证工作显得极为迫切。本文基于ISO15189《医学实验室质量和能力的专用要求》,通过安图AutoLumo A2000Plus 化学发光仪,对CMV IgM 和IgG 抗体进行性能验证,现报道如下。
1 资料与方法
1.1 仪器与试剂
安图AutoLumoA2000Plus 化学发光仪;试剂:安图公司配套使用的CMV IgM 和IgG 抗体试剂(简称安图试剂)、标准品和标源质控品。
1.2 方法
1.2.1 精密度验证 按照EP15-A3 及WS/T492-2016文件指导进行评价,IgM 和IgG 抗体分别检测低值和高值2 个不同浓度的质控品,每个浓度每天测定5 次,连续测定5 d,获得25 个检测结果。根据EP15-A3规定的方法,计算各样本的重复精密度(分析内精密度)和批间精密度,再进行统计学分析,计算变异系数(CV)。验证要求:批内CV ≤1/4 允许总误差(TEa)% ;批间CV ≤1/3TEa%。
1.2.2 正确度验证 按照《CNAS-GL037 临床化学定量检验程序性能验证指南》的规定,IgM 和IgG 抗体分别使用标准品及2 个浓度进行验证。每个浓度每天重复测定2 次,连续测定5 d,计算实测均值,并计算偏差。偏差=(实测均值- 理论浓度值)/ 理论浓度值×100%,正确度(参考物质)验证要求:偏差不超过±15%。
1.2.3 线性验证 根据国家卫生行业标准《WS/T 420-2013 临床实验室对商品定量试剂盒分析性能的验证》的规定,分别将IgM 和IgG 抗体接近线性范围上限的高值样本(H),用低值样本(L)按照不同稀释比例制备出至少5 个梯度样本。每个浓度样本重复测定3次,计算均值。将理论值与实测均值使用EXCEL 软件进行一次方程y=ax+b 回归分析,统计方程因子斜率a、截距b 和相关性R,要求R2≥0.99。
1.2.4 可报告范围验证 分别选取已知浓度接近线性范围上限的高值样本3 份,编号:H1、H2、H3。根据《CNAS-GL037 临床化学定量检验程序性能验证指南》所述方法并参考EP34 进行可报告范围验证。将H1、H2、H3 原倍样本上机各重复测定3 次,每个高值样本用厂家推荐的稀释液,并在厂家推荐的稀释比例附近进行3 个比例的手工稀释,每份稀释样本重复测定3 次,计算原倍样本及各稀释后样本均值,并分别与理论值计算偏差。验证要求:3 份样本相同稀释比例的偏差均不大于厂家声明的最大偏差时,对应的允许稀释倍数应不小于厂家推荐的稀释倍数。
1.3 统计学方法
用SPSS 20.0 软件处理数据,计量资料用x±s表示,以t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 精密度验证
CMV IgM 和IgG 抗体两种浓度的质控品测得的批内精密度均小于1/4 允许总误差,批间精密度均小于1/3 允许总误差,验证通过。详见表1。
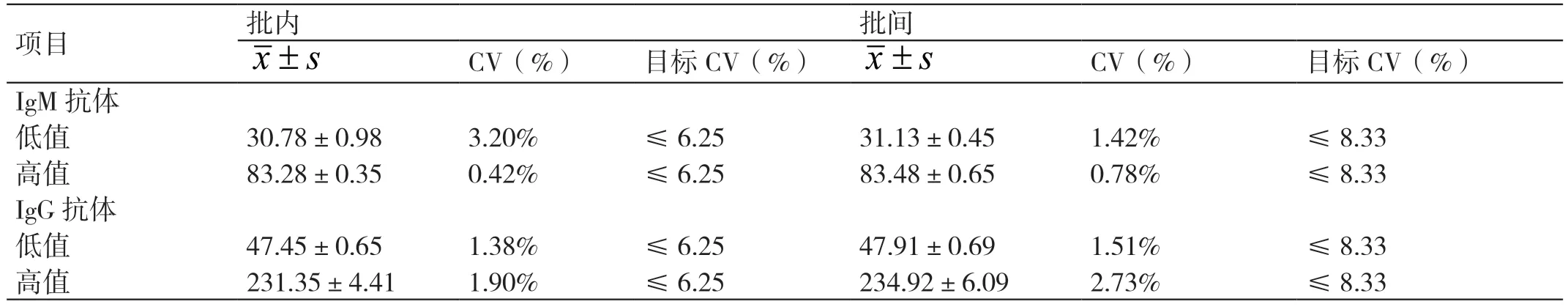
表1 CMV IgM 抗体精密度验证结果
2.2 正确度验证
CMV IgM 和IgG 抗体高低值的偏差均在标准品范围内,均不超过±15%,验证通过。详见表2。
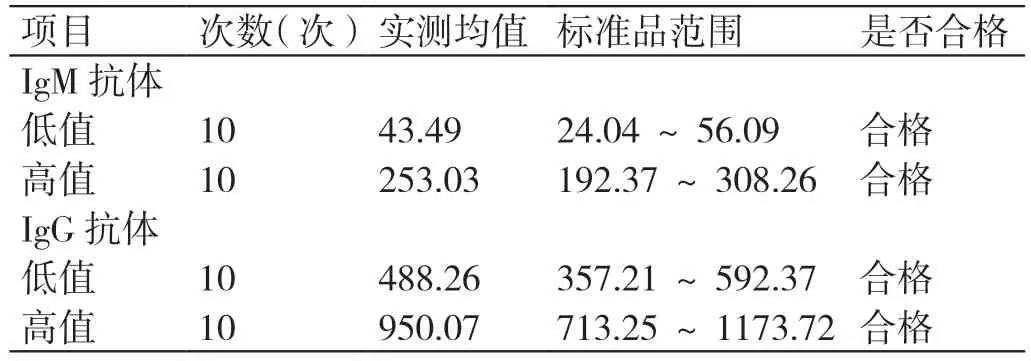
表2 CMV IgM 抗体正确度验证
2.3 线性验证
计 算 得 到y=1.0127x+0.4962,相 关 系 数R2>0.99,验证通过。详见表3 和表4。
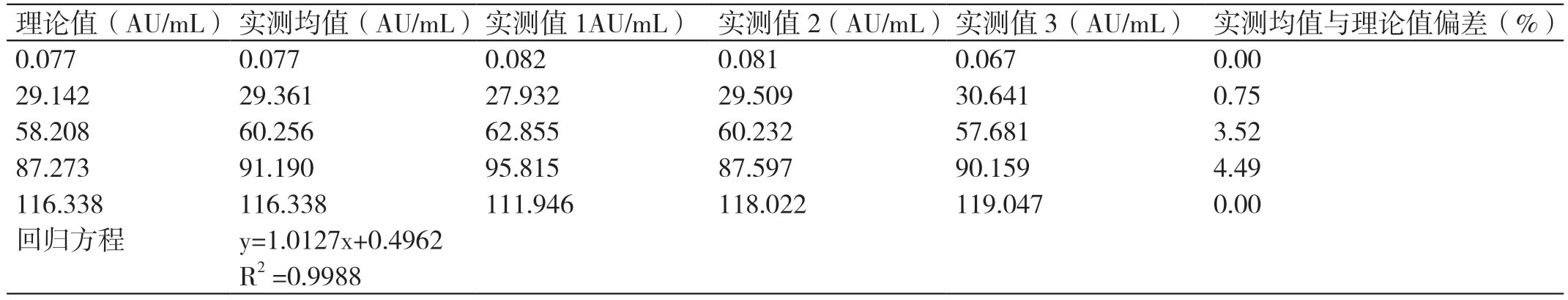
表3 CMV IgM 抗体线性验证数据
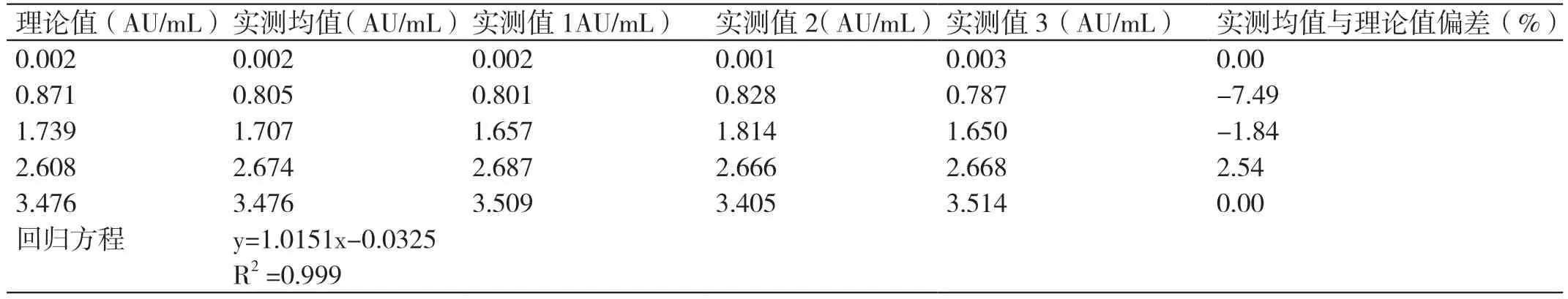
表4 CMV IgG 抗体线性验证数据
2.4 可报告范围验证
CMV IgM 抗体可报告范围在-8.52% ~12.16%之间,CMV IgG 抗体可报告范围在-7.57% ~2.73%之间,符合要求。详见表5 和表6。
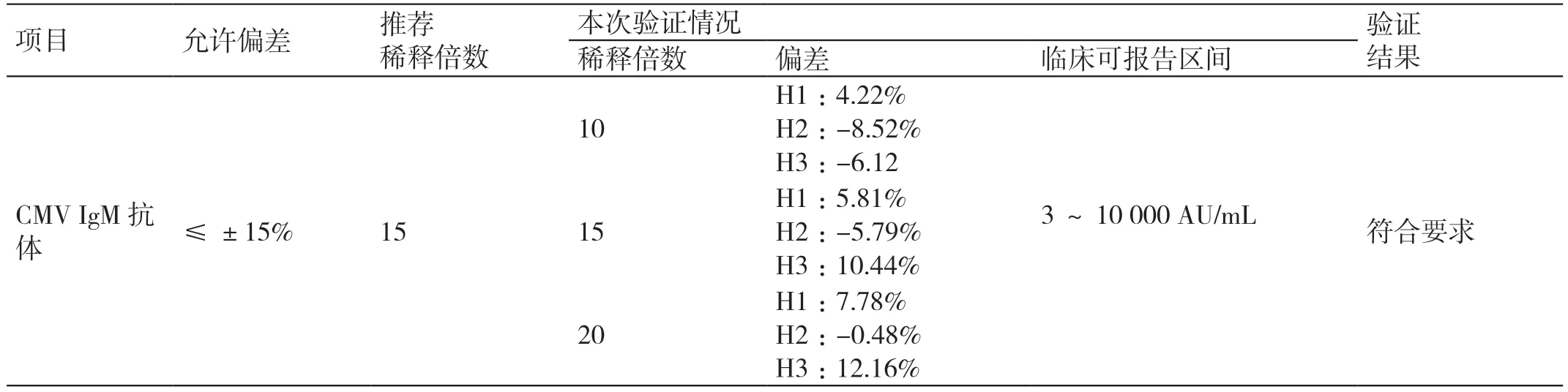
表5 CMV IgM 抗体项目可报告范围验证结果
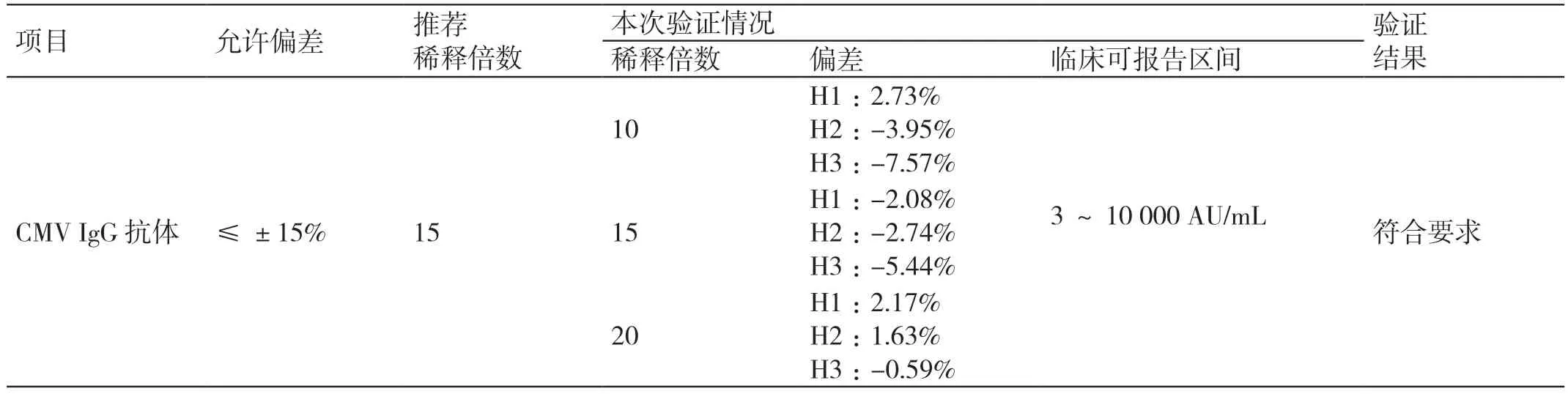
表6 CMV IgG 抗体项目可报告范围验证结果
3 讨论
我国是CMV 感染的高发国家。据统计,我国孕妇的CMV 血清特异性抗体阳性率为94% ~98%,新生儿先天性CMV 感染率约为0.7%[3-4]。CMV 抗体检测结果的准确可靠,可以给临床诊断提供数据支持及后续治疗的方向。实验室检测CMV 抗体的依据为美国《医疗机构临床实验室管理办法》和ISO15189 医学实验室认可的相关要求,以及《临床检验定量测定项目精密度与正确度性能验证》《临床生物化学检验常规项目分析质量要求》[5-7]等。在进行临床检测之前,需要对实验室的仪器设备、检验系统和方法等的主要分析性能进行验证,并明确要求验证结果能达到临床要求[8-12]。本研究结果显示,CMV IgM 抗体低水平和高水平质控品测得的批内精密度分别为3.20% 和0.42%,CMV IgG 抗体低水平和高水平质控品测得的批内精密度分别为1.38% 和1.90%,均小于1/4 允许总误差6.25% ;而测得的批间精密度,CMV IgM 抗体分别为1.42% 和0.78%,CMV IgG 抗体分别为1.51%和2.73%,均小于1/3 允许总误差8.33%,符合定量项目的要求。正确度方面,CMV IgM 抗体偏差P 分别为:0.66% 及-0.15%,CMV IgG 抗体偏差P 分别为:1.53% 及-0.57%,偏差P 均不大于±15%,符合要求。线性方面,R2≥0.99,b 值均在0.9 ~1.1范围内。可报告范围方面,CMV IgM 抗体允许偏差在-8.52% ~12.16% 之间,CMV IgG 抗体允许偏差在-7.57% ~2.73% 之间,均位于±15% 以内,符合要求。
综上所述,通过对CMV IgM 和IgG 抗体项目检测系统的精密度、正确度、线性、可报告范围各项性能参数的验证与分析,说明CMV IgM 和IgG 抗体项目的检测系统性能良好,项目的相关性能也符合相应要求,能够保证CMV IgM 和IgG 抗体检验结果的准确性和稳定性。目前,国内报道的性能验证研究大部分是基于美国临床实验室标准化协会的相关文件(EP15-A2、EP6-A2、EP7-A2、C28-A2 等)或美国临床实验室改进修正法规进行的方案设计[13],国家对优生定量项目的性能没有明确规定,但是实验室在实际工作中应进行相关方面的验证工作,以确保实验室检验结果的准确可靠,给临床以更多数据支持,更好地为患者服务。
