嵌合抗原受体T细胞治疗的现状与展望
2023-05-16史渊源
肖 萌 史渊源
(1)北京中医药大学深圳医院(龙岗),深圳 518172;2)深圳细胞谷生物医药有限公司,深圳 518118)
肿瘤严重威胁着人类的健康,给社会带来沉重的医疗负担,并对患者及其家属产生了巨大的心理压力。据美国癌症协会最新数据统计显示,2022年美国约有1 918 030 个癌症确诊病例,其中609 360 人死于癌症,平均每天约1 700 人死于癌症[1]。在中国,恶性肿瘤是居民死亡的第二大因素,2022 年,中国增加大约4 820 000 例新发癌症病例,约3 210 000 例癌症死亡病例,平均每天约8 795 人死于癌症,其中肺癌占据癌症死亡率之首[2-3]。当前癌症的治疗手段包括外科手术治疗、化学药物治疗、放射治疗和靶向药物治疗等。近年来,肿瘤免疫治疗,一种新兴的肿瘤治疗方式,因其具有特异性高、疗效显著并且能够调动机体免疫系统去抵御肿瘤,逐渐受到学者们与临床应用的广泛关注[4-6]。在2019 年,美国癌症研究协会(American Association for Cancer Research,AACR)发布的抗癌进展报告中,已经将肿瘤免疫疗法与外科手术、化疗、放疗、靶向药物疗法并列为癌症治疗的五大支柱[7]。免疫治疗的出现优化了肿瘤治疗标准和治疗理念,被2013 年《科学》(Science)杂志评为全球十大科技创新之首,2018年的诺贝尔生理学或医学奖也颁给了肿瘤免疫领域,使其成为继传统化学药物、靶向治疗后肿瘤治疗领域的又一次突破。肿瘤免疫治疗主要包括治疗性肿瘤疫苗、溶瘤病毒(oncolytic virus,OV)、细胞因子免疫疗法、免疫检查点抑制剂、细胞免疫疗法等[8-11]。其中,细胞免疫疗法脱颖而出,成为最有前途的癌症免疫疗法之一,在治疗血液系统恶性肿瘤方面取得了巨大成功[12]。嵌合抗原受体(chimeric antigen receptor,CAR)T 细胞免疫疗法是细胞免疫疗法中发展最快、应用最广泛的一个分支。这项最新技术迅速改变了血液系统恶性肿瘤的格局,并且占据目前正在开发或市场上细胞疗法的一半以上[13-14]。CAR-T,是指通过基因修饰技术,将带有特异性抗原识别结构域及T细胞激活信号的遗传物质转入T细胞,使T细胞直接与肿瘤表面的特异性抗原结合从而实现精准靶向治疗,是极具前景的肿瘤治疗手段[15]。
1 CAR结构
1.1 CAR的分子结构
CAR 结构包括单链抗体、铰链区及跨膜结构域与胞内信号肽区;与细胞表面表达的靶抗原结合后引起CAR-T 细胞活化,并独立于主要组织相容性复合体(major histocompatibility complex,MHC) 受 体[16]。单 链Fv (single chain fragment variable,scFv)是单克隆抗体的单链可变区,由轻链可变区(light chain variable,VL)和重链可变区(heavy chain variable,VH)组成,被Linker连接,主要作用是识别肿瘤相关抗原(tumorassociated antigen,TAA)。铰链区(hinge),位于scFv和跨膜结构域之间,由CD8 α、TCR β 等免疫球蛋白序列组成,其具有变形和伸缩的活性,使scFv的重链和轻链有足够的空间折叠,为细胞外抗原结合区接近抗原提供条件。跨膜结构域,由同源或异源的CD4、CD7、CD8、CD28和CD3ζ等二聚体膜蛋白组成,连接细胞内外的结构,保证了CAR 在T 细胞膜表面的定位与稳定表达。胞内信号肽区,通常由共刺激分子(costimulatory molecules,CM) 和免疫受体酪氨酸激活模体(immunoreceptor tyrosine-based activating motif,ITAM)组成,通常是TCR/CD3ζ 和FcεRIγ,当胞外区与其识别的抗原结合时,就会向胞内传导T细胞受体(T cell receptor,TCR)样活化信号[17-18]。
1.2 CAR结构的演变
一代CAR因为缺乏T细胞活化的共刺激分子,T 细胞的增殖效应小, 细胞因子释放少,导致CAR-T 细胞激活效率不足,临床应用未达到预期疗效。第二代CAR 在一代的基础上,在胞内添加了一个来自共刺激分子CD28或者CD137(4-1BB)的免疫受体酪氨酸激活基序(immuno receptor tyrosine-based activation motif,ITAM)区,抗原识别区与靶抗原结合后,使T细胞同时获得抗体刺激信号及共刺激信号。因此第二代CAR 的活化能力与杀伤活性远远强于一代,同时也在临床治疗中展现了较好的治疗效果,由于其稳定性高且技术工艺较为成熟,是目前的主流技术。三代CAR 则进一步在胞内添加了2 个或多个共刺激信号区,如CD28、CD137 或 者CD134 (OX40) 等。四 代CAR 通过基因修饰分泌细胞因子或表达共刺激配体,进一步增强了CAR-T 疗效,同时添加了自杀基因或者药物敏感基因,必要时可以降低细胞毒性[19-20](图1)。目前其都处于临床前研究阶段,未来随三代、四代CAR新结构在临床试验的推广,其疗效值得期待。
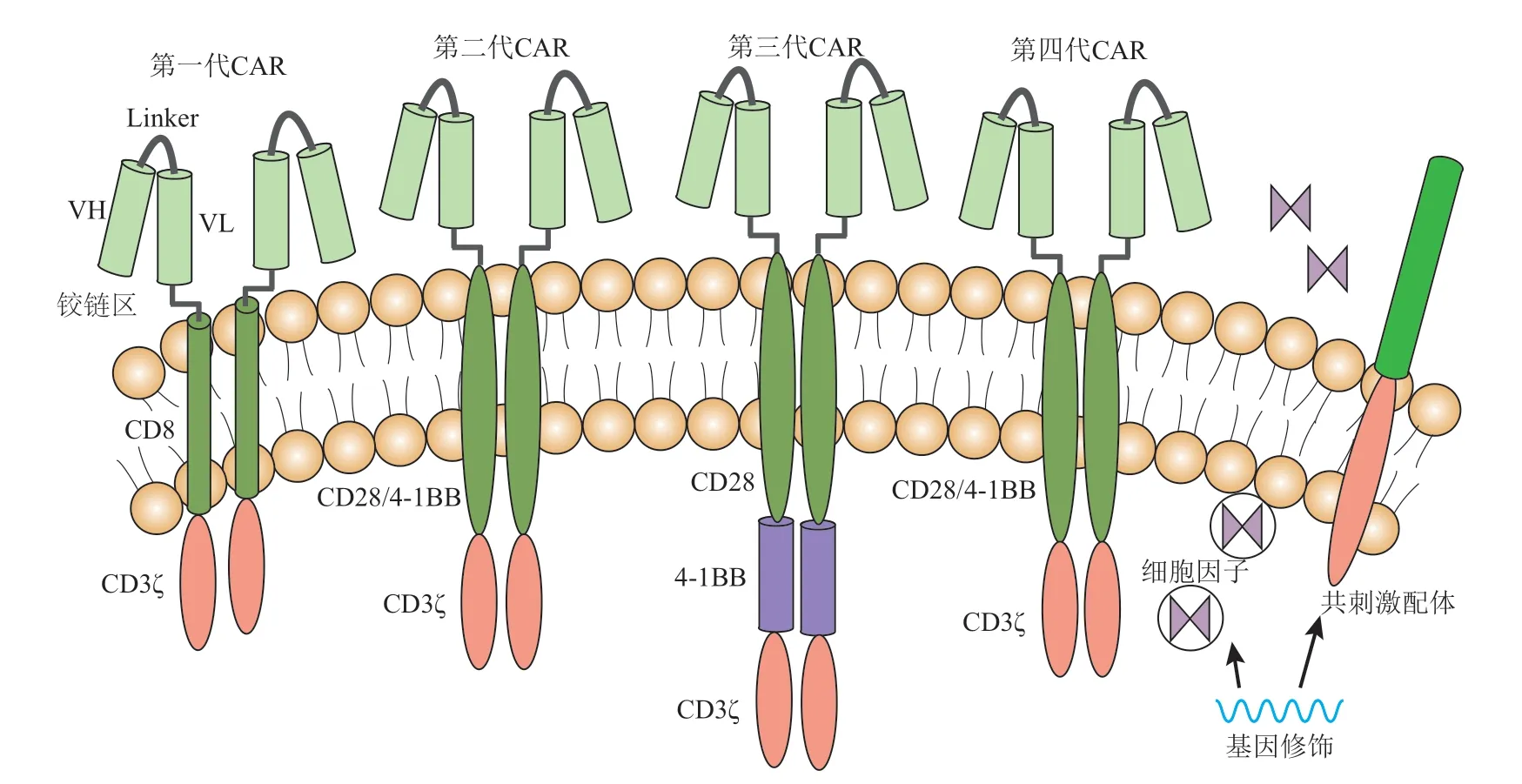
Fig. 1 Structural evolution of CAR图1 CAR的结构演变
2 病毒载体的选择
细胞基因治疗的关键是基因转导载体的设计。病毒具有传送其基因组进入受体细胞进行感染的功能,因此可作为递送载体将目的基因带入目标细胞。常见的病毒载体包括包括腺病毒(adenovirus,AdV)、腺相关病毒(adeno-associated virus,AAV)、慢病毒(lentivirus,LV)、仙台病毒、牛痘病毒、逆转录病毒和单纯性疱疹病毒等,其中以逆转录病毒载体、慢病毒载体的使用最为广泛[21-22]。
Carl H. June 博士,美国著名免疫学家、肿瘤学家和内科医师,是宾夕法尼亚大学Perelman 医学院教授。2012 年,罹患B 细胞急性淋巴性白血病并且两次复发后的年仅5 岁的Emily Whitehead加入了Carl H. June 主持研究的一个I 期临床项目(CTL019),成为了第一例接受CAR-T治疗并成功恢复的白血病患儿。至今,Emily已经无瘤生存超过了10 年。2017 年8 月,Carl H. June 研发的全球首款CAR-T 细胞治疗产品Kymriah 经FDA 批准上市,用于儿童和成年患者急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)[23]。Kymriah应用的是慢病毒载体,产品最终定价为47.5 万美元。目前全球共上市了8款CAR-T产品,其中5款应用的是慢病毒载体。
1986 年,美国癌症科学家、外科医生Steven Rosenberg 在一位晚期的黑色素瘤患者手术切下来的肿瘤组织里发现,除了大量的肿瘤细胞外,还有一小部分淋巴细胞,这部分细胞被命名为tumor infiltrating lymphocytes,简称TILs,是肿瘤间质中的异质性淋巴细胞,又称为肿瘤浸润的淋巴细胞,包括T 细胞及自然杀伤(natural killer,NK)细胞等。2006 年,Rosenberg 博士证明T 细胞受体可以转移到免疫细胞表面,通过移植这部分“改造过”的细胞,并与化疗以及高剂量的IL-2 联合使用,可用于治疗黑色素瘤患者。依据“过继免疫细胞移植”治疗黑色素瘤的方法,Rosenberg 博士开发了全球第二款获批上市的CAR-T 细胞治疗产品Yescarta,也是首款被获批用于非霍奇金淋巴瘤的CAR-T 细胞疗法,Yescarta 应用的是逆病毒载体,其售价与第一款CAR-T 产品相比降低近10 万美元,目前国际上市的8款CAR-T产品中有3款应用的是逆病毒载体[24]。
慢病毒载体是一种单链RNA 病毒,可以将外源片段随机插入宿主细胞的基因组,慢病毒载体具有转染效率高,能够感染分裂期和非分裂期细胞,可容纳较大的基因片段等优点。逆转录病毒是一种有包膜的球形病毒,也是以RNA 的形式携带其遗传物质,并随机整合到宿主细胞的基因组中,可以感染分裂期细胞,能够携带较大的基因片段。在工业化生产方面,慢病毒载体采用瞬时包装系统、质粒用量大、纯化过程复杂、病毒载体滴度较低(需要浓缩),而逆病毒载体工业化生产可制备稳定的产毒细胞系、质粒用量少、杂质含量低、病毒载体滴度高。由于上述优势,全球范围内,目前在细胞基因治疗领域使用逆病毒载体的研发管线数量已经大幅度超过使用慢病毒载体的研发管线数量。中国当前各类研发管线以运用慢病毒载体为主,预计未来逆病毒载体在中国也将被普遍运用[25-26]。
3 CAR-T细胞治疗面临的挑战
3.1 CAR-T在实体瘤治疗效果不佳
实体瘤微环境由细胞外基质、肿瘤脉管系统、肿瘤细胞、间质细胞(如内皮细胞和成纤维细胞)、免疫浸润细胞、趋化因子和细胞因子等多种分子以及缺氧等异常代谢环境组成。血液肿瘤细胞通常存在于循环系统中,因此较容易被CAR-T细胞捕获;不同于血液肿瘤所处的均质环境,实体瘤存在于体内深处,其致密的细胞外基质组成的物理屏障,阻碍了CAR-T 细胞的迁移与对肿瘤细胞的浸润与渗透。此外,微环境低氧、低pH、高渗透的特点,不利于CAR-T 细胞的存活,实体瘤微环境还招募了多种免疫抑制细胞(髓源性抑制细胞、肿瘤相关的巨噬细胞、调节性T细胞等)和免疫检查点(程序性细胞死亡受体1、细胞毒性T 淋巴细胞相关蛋白4 等),通过多种途径来抑制CAR-T 细胞发挥杀伤活性[27-28]。
除了复杂的微环境影响,缺乏良好的抗原靶点,也是CAR-T 细胞疗法在实体瘤的开发应用面临巨大障碍与挑战的因素之一。血液肿瘤通常表达单一、特异的肿瘤抗原,实体瘤中肿瘤特异性抗原很少,高表达的靶点抗原多为肿瘤相关抗原,因此在正常组织中也有表达,这就增加了脱靶风险。2010年,在靶向Her-2的CAR-T细胞治疗结肠癌的临床试验中,由于患者正常肺组织中也表达Her-2抗原,CAR-T 细胞发起了对患者正常肺组织的攻击,患者很快出现了呼吸窘迫,并在15 d 后死亡[29]。此外,实体瘤具有显著的抗原异质性,不仅表现在肿瘤内(肿瘤内异质性)和患者间(肿瘤间异质性),治疗前后、原始与复发病灶之间也可能不同。部分细胞更容易产生抗原逃逸,抗原阴性表达的肿瘤细胞逃逸免疫攻击并致其复发[30]。
3.2 CAR-T细胞治疗后的耐药复发
除了在实体瘤的治疗效果不佳外,耐药复发也是CAR-T细胞治疗面临的重大挑战。CD19广泛表达于B细胞的恶性肿瘤,因此是血液系统恶性肿瘤最常用的特异靶点,但是接受CD19靶向治疗后的12 个月内,高达 30%~50%的患者发生了耐药复发。这种复发并不局限于CD19 靶点,CD22、BCMA等靶点的相关研究证明了耐药复发在CAR-T细胞治疗中普遍存在[31-32]。
耐药复发可以根据抗原的表达情况分为阴性复发和阳性复发。阴性复发的主要原因是抗原丢失。有意思的是,即使抗原阳性表达,因为其表达量减少或密度降低导致肿瘤细胞免疫逃逸进而发生耐药复发。这提示维持CAR-T 细胞的活性可能需要达到其抗原表达量的最低阈值。CAR-T 细胞的衰竭是抗原阳性复发的又一重要原因,例如当使用糖皮质激素干预治疗CAR-T 细胞的毒副作用时,加剧了CAR-T 细胞的消耗,并缩短了其在体内的存活时间。此外,实体瘤复杂的微环境也抑制了CAR-T细胞的活性与功能,其高肿瘤负荷状态使CAR-T细胞长期接触高水平抗原导致自身功能的衰竭[28,33]。
3.3 CAR-T细胞治疗的毒副反应
临床中最常见的CAR-T 细胞的毒副作用为细胞因子释放综合征(cytokine release syndrome,CRS)、免疫效应细胞相关神经毒性综合征(immune effector associated neurotoxicity syndrome,ICANS)。CAR-T 细胞输注体内后,识别机体的肿瘤细胞并被激活,释放大量细胞因子,进一步激活大量免疫细胞(T 细胞、B 细胞、巨噬细胞、单核细胞等)并快速增殖,引起白介素(interleukin,IL) -1、IL-6、肿瘤坏死因子α (tumor necrosis factor,TNF-α)、粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colony stimulating factor,GM-CSF)等细胞因子的过度级联释放,形成“细胞因子风暴(cytokine storm)”[34]。
CRS 常始于发热,快速进展可致全身炎症反应、呼吸困难、低血压、凝血障碍和全身器官功能衰竭[35]。ICANS 的临床表现为中毒性脑病,严重时进展为癫痫、脑水肿、运动障碍、意识模糊和昏迷[36-37]。严重的CRS 和ICANS 有致命风险,但若发现CRS 和ICANS 的早期症状并及时进行有效干预,两者的临床进展都是可逆的[38]。CRS 与血清中多种细胞因子水平升高有关,其中IL-6 水平与CRS 严重程度密切相关。因此,阻断IL-6 受体的托珠单抗与司妥昔单抗是目前CRS 的主要治疗手段。ICANS 的患者多数伴有CRS 病史,其神经毒性的严重程度与CRS 密切相关,提示CRS 可能诱发或促进ICANS 的发生[39-40]。试验观察到患者脑脊液的CAR-T 细胞数量和细胞因子水平与ICANS严重程度存在相关性,相关机制可能是CRS 破坏血脑屏障后,渗透大量细胞因子诱发中枢神经系统炎症。ICANS 的临床干预手段是给予最低剂量的类固醇,以免影响CAR-T 疗效及产生严重的免疫抑制[41]。
4 细胞治疗的行业展望
面对以上诸多挑战与局限,越来越多的临床前与临床研究相继开展,随着对CAR-T 细胞的认识不断加深,不断优化改善临床治疗方案,CAR 结构的进一步优化设计以及联合应用其他治疗手段是潜在有效的解决方案(图2)。
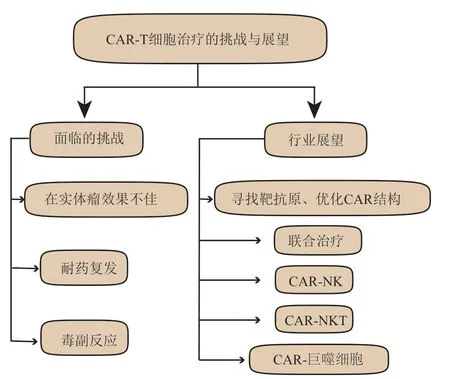
Fig. 2 Challenges and prospects of CAR-T cell therapy图2 CAR-T细胞治疗的挑战与展望
4.1 寻找靶抗原与优化CAR结构
寻找和开发高特异性、强刺激作用的靶抗原是CAR-T 细胞治疗成功的基础,如目前在研的热门靶点有间皮素(mesothelin,MSLN)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、前列腺特异性膜抗原(prostate-specific membrane antigen, PSMA)、磷脂酰肌醇蛋白聚糖 3(glypican 3,GPC3)等[42]。此外,多靶向抗原CARs的开发在应对抗原丢失密度下降导致的耐药复发与实体瘤抗原异质性等挑战取得了不错的治疗效果。如CD20、CD22 和CD123 等靶点分别与CD19 联合使用的细胞治疗在临床试验中显示出了低毒副作用和高效率的结果[43]。另一个多靶点开发方向是继续优化CAR 结构,对其进行双特异性T 细胞衔接器(bi-specific T-cell engager,BiTE)的改造,具有很好的发展前景。BiTE 包含两个scFv,一个识别T细胞表面蛋白CD3,另一个识别肿瘤细胞表面抗原,通常为肿瘤相关抗原(TAA),从而激活CAR-T 细胞及内源性T 细胞对肿瘤细胞的杀伤[44]。
4.2 与其他治疗手段的联合应用
联合治疗是肿瘤治疗的发展趋势,CAR-T 细胞疗法与其他治疗手段的联合应用,已经成为CAR-T治疗的新的发展方向[45]。
人体免疫细胞自带几十种蛋白质叫做“免疫检查点”,又叫刹车蛋白,防止免疫系统过度活跃。肿瘤细胞通过过表达细胞程序性死亡受体配体1(programmed death-ligand 1,PD-L1)特异性识别并结合免疫细胞上的PD-1,启动免疫“刹车”系统,抑制T 细胞的杀伤能力,严重影响CAR-T 细胞的疗效[46]。因此,CAR-T 联合免疫检查点,通过阻断“刹车”系统的启动,可有效增强CAR-T疗法的抗肿瘤活性。如CAR-T 联合免疫检查点抑制剂派姆单抗治疗临床恶性胸膜间皮瘤,表现出良好安全性及耐受性[42]。CAR-T联合编码PD-L1抗体,在前列腺癌模型中能够有效克服免疫抑制,增强anti-HER2 CAR-T 活 性[47]。Zou 等[48]通 过 改 造CAR结构,发现下调抑制性免疫检查点受体PD-1、Lag-3 和Tim-3 表达并抑制其信号传递的CAR-T 细胞具有更好的抗肿瘤功能。Chu 等[49]输注通过CRISPR/Cas9 技术敲除PD-1 基因的CAR-T 细胞治疗淋巴瘤,增强了其杀伤活性,实现了持久缓解。
CAR-T 联合溶瘤病毒是肿瘤细胞治疗的另一有效途径。Park 等[50]采用溶瘤牛痘病毒感染多种实体瘤细胞,通过其抗原递送标记系统与CAR-T介导的肿瘤裂解形成了肿瘤杀伤的正反馈。Watanabe 等[51]通过meso-CAR T 细胞联合表达细胞因子IL-2 和TNF-α 的溶瘤腺病毒治疗胰腺导管腺癌,促进了肿瘤微环境的肿瘤相关巨噬细胞向M1型极化,增加了树突状细胞(DC)的成熟,显著提升了CAR-T细胞的浸润及抗肿瘤作用。此外,CAR-T联合传统疗法也在临床研究中被广泛应用。如CAR-T 治疗前给与化疗药物紫杉醇与环磷酰胺的预处理[52],在胶质母细胞瘤小鼠模型中静脉注射anti-GD2 CAR-T 细胞后进行局部的放疗[53],在非小细胞肺癌的小鼠模型中采用CAR-T 联合光热治疗[54],都能够有效促进CAR-T 细胞的肿瘤浸润,改善其肿瘤微环境,并提升其抗肿瘤疗效。
4.3 CAR-NK
随着CAR-T 细胞疗法在血液系统恶性肿瘤的免疫治疗取得巨大成功,其他免疫细胞在CAR 中的应用也受到广泛关注[55]。NK细胞是机体固有免疫的重要组成部分,相较于T 细胞,NK 细胞在CAR的应用方面优点很多。异体NK细胞不会引起移植物抗宿主病(GVHD);NK细胞治疗不分泌炎症因子(IL-1、IL-6),不会导致细胞因子释放综合症的发生;NK 细胞具备更多的肿瘤杀伤途径,如执行细胞脱粒、激活凋亡途径和介导抗体依赖细胞介导的细胞毒性功能(ADCC);异体NK细胞来源广泛,包括外周血、脐带血、NK 细胞株(NK-92)与诱导多能干细胞(iPSC-NK)等;NK 细胞在体内存活周期短,不同于CAR-T 细胞滞留期长易产生副作用攻击患者自身细胞;对实体肿瘤治疗具有明显优势,因为实体肿瘤对非修饰的NK细胞会表现出不同程度的耐受性,但却对抗原依赖型的NK细胞敏感。以上优势使得CAR-NK在肿瘤免疫治疗中具有巨大潜力与广阔前景[56]。
4.4 CAR-NKT
NKT细胞是先天性T淋巴细胞,与NK细胞不同的是,NKT细胞的靶点识别受到CD1d限制,类似于T 细胞识别靶点受HLA 限制。尽管大多数肿瘤为CD1d 阴性,不能被NKT 细胞直接靶向,但NKT 细胞可响应肿瘤来源的趋化因子,迁移到肿瘤部位,在一些类型的肿瘤中,NKT 细胞在原发性肿瘤中的存在与良好的预后相关。在肿瘤内,肿瘤相关巨噬细胞刺激血管生成,促进肿瘤生长和侵袭,并介导免疫抑制,NKT 细胞能够杀伤这类细胞。此外,NKT细胞激活可间接促进NK细胞和T细胞介导的抗肿瘤反应。虽然NKT 细胞在血液中的含量较少,但是基于NKT 细胞以上优势,使其在癌症细胞治疗的开发中极具潜力[57]。在公布的CAR-NKT 治疗神经母细胞瘤的1 期临床中期数据中,接受该疗法的3 名患者,有1 人获得客观缓解,并且骨转移病灶消退[58]。
4.5 CAR-巨噬细胞
在肿瘤微环境中,巨噬细胞(macrophage)是浸润率最高的天然免疫细胞,并且与肿瘤微环境中的几乎所有细胞成分(包括肿瘤细胞、免疫细胞如T细胞、NK细胞、DC和其他常驻非免疫细胞)存在相互作用[59]。以上特性,使得研究人员对于CAR-巨噬细胞的开发也产生了极大的兴趣。巨噬细胞通常是最先被实体瘤吸收的免疫细胞,CAR能够帮助巨噬细胞准确识别肿瘤细胞,避免被吸收的命运,而且反过来吞噬肿瘤细胞。CAR-巨噬细胞还可以将癌细胞抗原碎片呈递给T细胞,激活T细胞,促进抗癌免疫[60]。目前CAR巨噬细胞的临床试验仍处于研发阶段,尚未有结果报告。
5 小 结
截至2022 年上半年,全球肿瘤免疫治疗在研管线中有2 756 种细胞疗法药物,相比2021 年有36%的增长。其中,CAR-T 占据目前正在开发或市场上细胞疗法的一半以上[61]。美国和中国主导着癌细胞免疫治疗的基础研发和临床试验,中国癌细胞免疫疗法研究紧随美国之后。截至2023 年4月,ClinicalTrials.gov 显示,全球免疫细胞治疗的临床研究超过2 000 项,主要涵盖了急性白血病、B 细胞淋巴瘤、非霍奇金淋巴瘤、神经母细胞瘤、恶性胶质瘤、肺癌、肝癌、三阴性乳腺癌等,其中,中国的免疫细胞治疗临床研究占全球的1/3,已成为仅次于美国的第二大市场。
细胞免疫疗法给肿瘤患者带来了新的希望,其中CAR-T 细胞治疗取得的成功,让难治性、复发性血液系统恶性肿瘤有了持续缓解、甚至治愈的可能。复杂的肿瘤微环境与缺乏良好的靶点致使CAR-T 在实体瘤的表现不佳,同时面临着耐药复发、毒副反应等诸多挑战,但是随着对CAR-T 细胞认识的不断加深,以及大量基础与临床研究实验的开展,相信通过进一步优化CAR 的结构设计以及联合其他治疗手段如传统放化疗、免疫检查点等,CAR-T 细胞治疗仍然具有广阔的应用前景。此外,CAR-NK、CAR-巨噬细胞等实验的相继开展与应用,弥补了CAR-T 治疗的不足,形成优势互补,丰富了肿瘤细胞免疫治疗。综上,CAR-T作为肿瘤治疗的热门领域,以其为主线的细胞免疫疗法,彰显出巨大潜力与光明前景,有望为更多的肿瘤患者带来福音。
