非典型腺苷酸激酶AK6/hCINAP的结构和功能*
2023-05-16诸葛瑞鹏黄新平郑晓峰
诸葛瑞鹏 黄新平 郑晓峰
(北京大学生命科学学院,北京 100871)
腺苷酸激酶(adenylate kinase,AK)是ATP∶AMP 磷酸转移酶,催化细胞生命中的一个关键反应,ATP+AMP↔2ADP,在古细菌、细菌和真核生物中存在[1-2]。哺乳动物细胞中有9 种具有不同底物特异性和组织分布的AK亚型(AK1~9),这9种AK分布在细胞内不同的区间,它们通过磷酸转移酶网络在核苷酸代谢和能量代谢中发挥重要作用[3]。AK1、5、7和8位于细胞质中,AK6和AK9定位于细胞质和细胞核。AK2、3 和4 位于线粒体中,其中AK3 和AK4 存在于线粒体基质中,AK2位于线粒体膜间[4]。虽然人类AK的结构和功能有许多共同之处,但它们的细胞内定位表明它们具有独特的特性。已有的研究揭示了AK家族成员的生物学功能及其与疾病的关联[5]。其中,细胞质AK1 和线粒体AK2 调节多种细胞活性,AK1 基因敲除小鼠心脏的收缩能力快速丧失,对缺血应激的耐受性降低[6]。AK2 的异常表达导致网状发育不良、造血缺陷和线粒体功能障碍[7-8],AK2 N 端区域的突变抑制AK2 依赖的中性粒细胞分化,使用果糖可部分恢复中性粒细胞的分化,进而治疗AK2 缺乏症[9]。线粒体AK2 和AK4 的缺陷与神经母细胞瘤或胶质瘤有关,AK2 被确定为癌症预后和晚期正常组织放射毒性的候选生物标志物[10]。同样,研究发现,AK5 在肿瘤组织中的表达量低于正常组织,AK5 低表达通过调节细胞周期途径促进结肠腺癌细胞的增殖和转移,AK5 高表达的患者比低表达的患者总生存期更长。AK5 低表达水平可作为一种独立的预后生物标志物,为结肠腺癌的临床诊断和靶向治疗提供了新的视角[11]。精子细胞中AK7的缺失导致原发性男性不育,此外,与正常卵巢组织相比,卵巢癌组织中的AK7 水平显著下调,AK7 低表达是卵巢癌生存率的预后指标[12]。最近的一项研究发现,AK9 基因的突变与肢带型先天性肌无力综合征有关[5]。
长期以来,人们对AK结构和生化特性进行了深入研究。腺嘌呤核苷酸的相互转化是能量代谢的关键步骤,AK与应激、昼夜节律和癌症的恶性转化等细胞内过程有关[13]。AK在催化过程中发生较大的构象变化[14]。这些构象变化有助于揭示酶的作用机制[15]。由于AK 在细胞内AMP 水平的调节对多个细胞生理过程中必不可少,AK可能是疾病治疗和新抗生素的有效靶点。
1 非典型腺苷酸激酶AK6/hCINAP
AK6 又名人coilin 相互作用核ATP 酶蛋白(human coilin-interacting nucleolar ATPase protein,hCINAP),定位于5q13.2 位置的5 号染色体上(NCBI 基因ID:102157402),全长1 119 bp,由4个外显子和3 个内含子组成,编码172 个氨基酸[16-17]。在所有真核生物基因组中都发现了AK6/hCINAP同源物。其蛋白质序列特别是二级结构不同物种中的保守性都较高,并且在人体各组织和细胞系中普遍表达。在染色体上,TAF9 基因座编码基础转录因子亚基TAFIID32,而AK6/hCINAP mRNA 是TAF9 基因座的剪接转录本,它和TAFIID32 mRNA 从不同的ATG 密码子翻译而来,并使用不同的阅读框,导致它们在各自的蛋白质序列中没有同一性[18]。
与其他AK相比,AK6具有独特的序列、酶学特性、定位和晶体结构(图1)。序列比对表明AK6/hCINAP 与其他AK(AK1~5)的序列同源性仅为18%,提示AK6/hCINAP 可能与其他AK 具有不同的功能[5]。与其他AK 不同的是,AK6/hCINAP同时具有AK和ATP酶的活性(图1a),使其有别于其他AK 家族成员。作为腺苷酸激酶,AK6/hCINAP 催化可逆 反应:Mg2+ADP+ADP ⇌Mg2+ATP+AMP。AK 在剧烈活动中迅速产生ATP,这种作用模式被认为是一种储备能量系统,可以在能量应激条件下从ADP 转化成ATP。在ATP 酶反应过程中,AK6/hCINAP His79 的咪唑氮ND1 配位一个溶解水分子:ATP+H2O⇌ADP+Pi[19]。有趣的是,野生型AK6/hCINAP 的 ATPase 活 性(1.45 L·mol-1·s-1)约为其AK活性(140 L·mol-1·s-1)的1%,但H79G突变使AK酶和ATP酶的效率分别降低了72%和76%,表明His79在催化中的作用对于AK和ATP酶反应同样重要[20]。
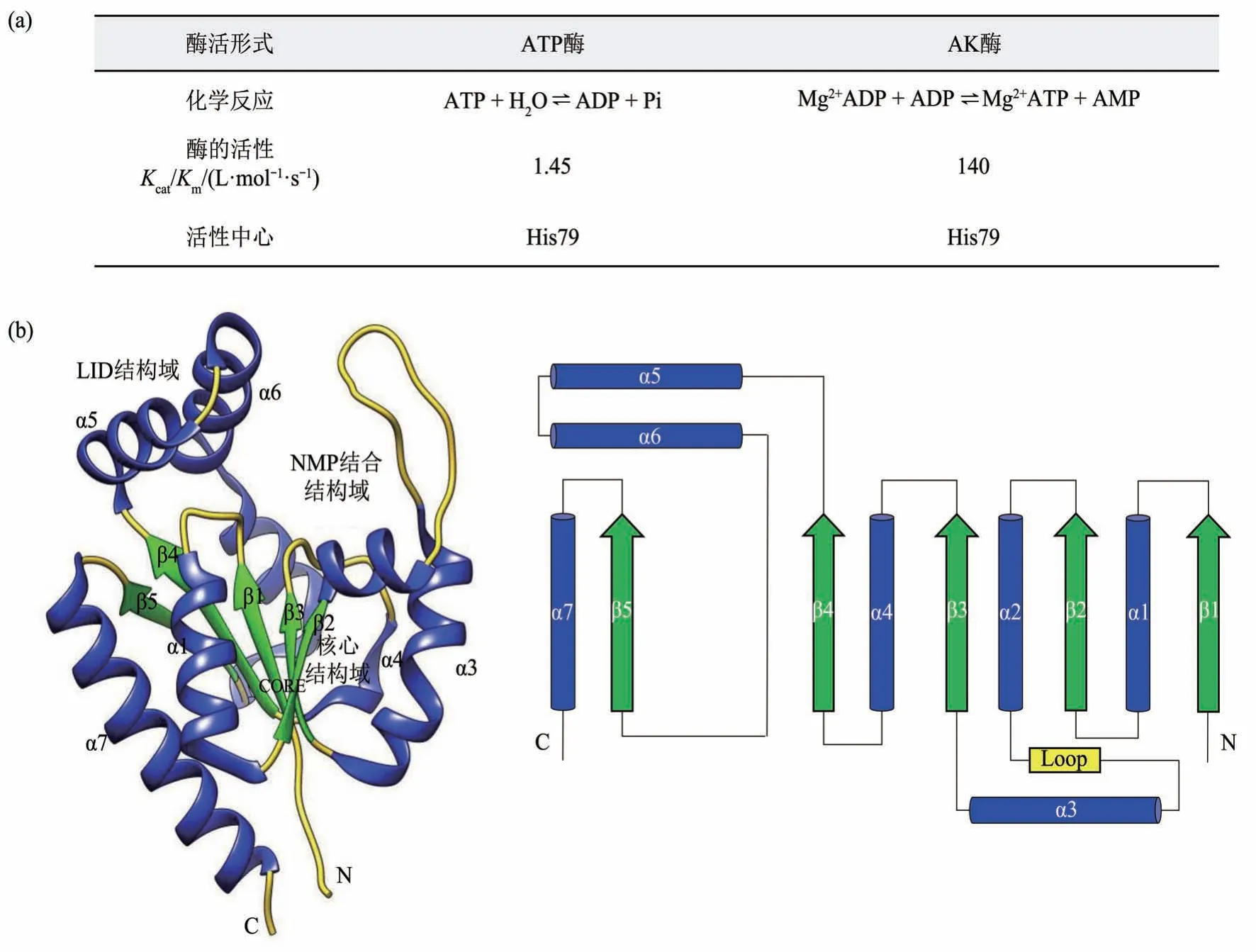
Fig. 1 The structure and enzymatic characteristics of AK6/hCINAP图1 AK6/hCINAP的结构和酶学特征
关于AK6/hCINAP的亚细胞定位研究,最初使用免疫荧光法检测过表达的GFP/YFP-hCINAP 的亚细胞定位,发现其表现出明显的核定位[17-18],但该蛋白质没有明显的核定位信号序列,进一步利用免疫荧光和核质分离/免疫印迹对细胞内源表达的AK6/hCINAP 进行分析发现,内源表达的AK6/hCINAP在细胞质和细胞核均有分布[21-23]。这些研究表明AK6/hCINAP 同时定位于细胞核和细胞质。并且其在细胞核和细胞质内分别发挥不同的调控作用:在细胞核内,AK6/hCINAP 在调控18S rRNA的剪切[23]、典型Cajal 体(Cajal bodies,CBs)形成[24]、p53稳定性[25]、DNA损伤修复[21],以及细胞衰老中发挥重要的作用[26];在细胞质中,AK6/hCINAP通过调控NF-κB活性[27]、有氧糖酵解关键酶LDHA活性[22]、YAP1的活性[28],分别在炎症、肿瘤细胞代谢以及胚胎发育中发挥重要的作用。本综述对AK6/hCINAP的结构和生物学作用相关的研究进行概述(图2)。
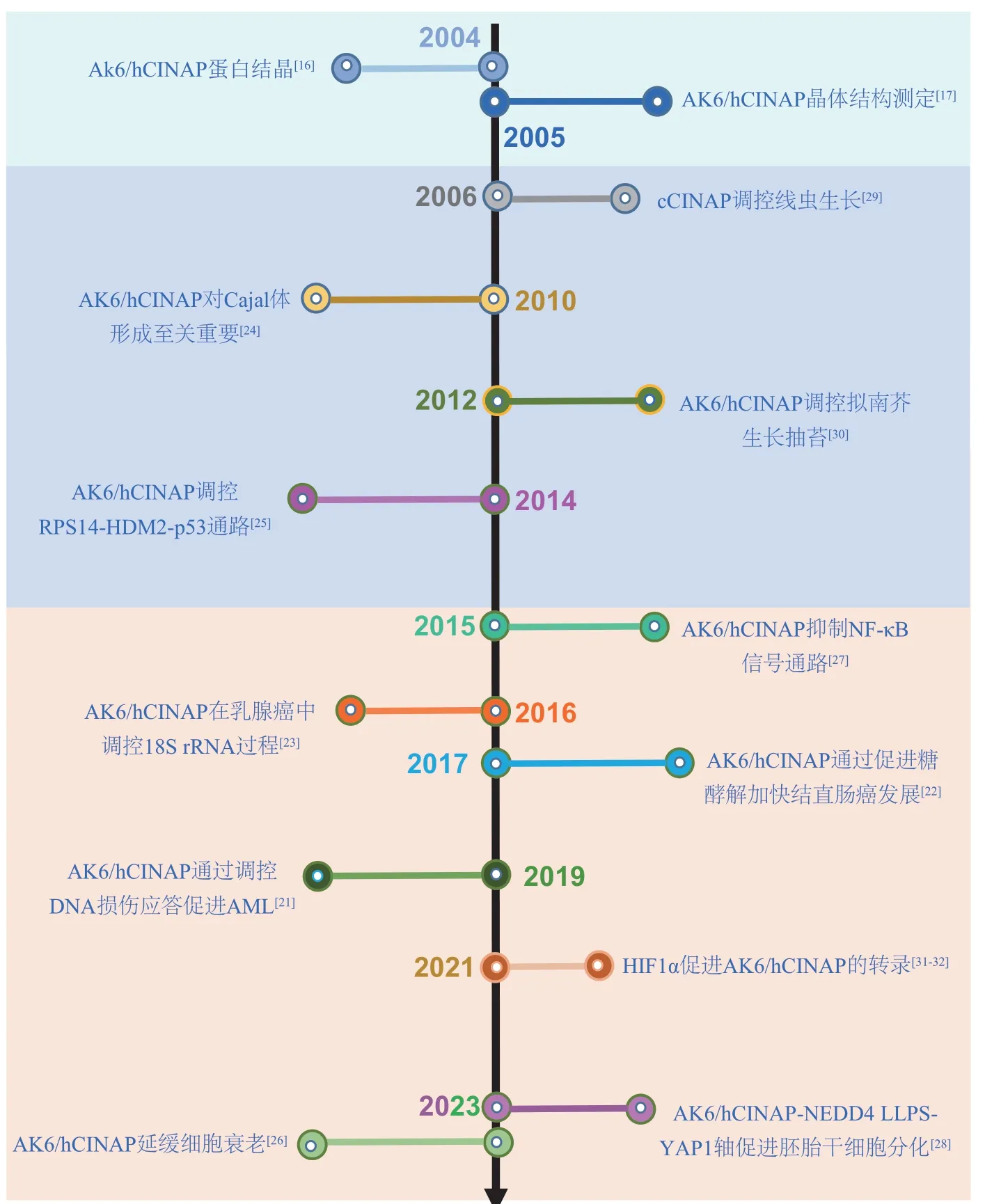
Fig. 2 Timeline of key events leading to characterization of AK6/hCINAP图2 AK6/hCINAP研究的历程
2 AK6/hCINAP独特的结构特征
对AK6/hCINAP(PDB ID:1RKB)晶体结构的解析表明(图1b),该蛋白质含有3 个功能性的结构域:由两个α 螺旋和一段不规则卷曲组成的NMP结合结构域,由两个α螺旋组成的LID结构域以及5 个β 片层平行排列组成的含ATP 结合位点的核心结构域[16-17]。此外,AK6/hCINAP 拥有一个Walker A 基序(GlyXXGlyXGlyLys),还与其酵母同源物Fap7含有一个hhh(DE)XH型Walker B基序,这是NTP 酶的特征,是AK6/hCINAP 有别于其他AK 的非典型结构特征[33]。Asp77 和His79 是调控AK6/hCINAP 酶活性的关键残基,然而,hCINAP-D77G 突变体的晶体结构(PDB ID:5JZV)显示,磷酸腺苷结合口袋的构象,与野生型结构相比没有明显改变[23]。表明虽然AK6/hCINAP催化活性位点的突变影响了其底物结合亲和力,但对其构象没有明显影响。尽管动力学分析显示,位于Walker B基序上的His79突变,显著降低ATP 酶和AK 活性,导致AK6/hCINAP同源二聚体形成,进而调节AK6/hCINAP 通过蛋白质-蛋白质相互作用的功能,Walker B 基序也不直接参与ATP 结合[20]。对AK6/hCINAP 及其在酵母中同源物的功能研究表明,催化位点的突变对其生理作用有显著影响。例如,Walker B 基序中酵母Fap7 的双突变D82AH84A 和AK6/hCINAP 的双突变D77GH79G分别抑制20S和18 S-E前体rRNA加工,AK6/hCINAP H79G 突变显著影响细胞核中CBs 形成[24]。此外,AK6/hCINAP H79G突变体不再促进乳酸脱氢酶A(lactate dehydrogenase A, LDHA)Y10磷酸化[22]。由于His79在影响AK6/hCINAP活性和功能方面发挥了重要作用,对H79G单位点突变体和D77G/H79G 双位点突变体的结构分析将有助于揭示AK6/hCINAP生物学功能的分子机制。
虽然AK6/hCINAP 具有与AK1~5 亚型相似的保守局部区域,但它具有一些明显的结构特征。例如,NMP 结合域螺旋α2 在所有AK 中都是保守的, AK6/hCINAP 的短LID 结构域与AK1 和AK5亚型相似,但与AK2、AK3 和AK4 不同。此外,AK6/hCINAP 与AK1 (PDB ID:3ADK)、AK2(PDB ID:1AK2)、AK3(PDB ID:1AK2)、AK4(PDB ID:2AR7)和AK5(PDB ID:2BWJ)的整体结构Cα 原子之间的RMSD 值分别为2.257、2.724、2.341、2.406 和2.473 Å。虽然核心区域的整体结构非常相似,但AK6/hCINAP 的LID 和NMP 结合域与其他AK 有较大的不同。AK6/hCINAP的NMP结合域是一个环而不是α螺旋,这表明其NMP 结合域比其他AK 更灵活。这些差异可能解释了AK6/hCINAP的特殊催化机制。在开放结构构象中,AK6/hCINAP 的短LID 结构域和NMP结合域通过盐桥相互作用,这与其他AK结构的相互作用不同。其NMP 结合域具有一个在其他AK中没有观察到的长环(残基33~58),而环(残基40~59)包含10个酸性残基和无碱性残基,这在不同物种中是一个很保守的特征。最后,AK6/hCINAP与其他AK的不同之处在于,它的His79插入到活性位点,靠近Arg39,而其他AK 中相应的位点是一个芳香族氨基酸,没有插入活性位点[20]。综上所述,AK6/hCINAP独特的结构特征解释了其催化机制与其他人类AK不同的原因。
3 腺苷酸激酶AK6/hCINAP 的上游调控因子
鉴于AK6/hCINAP在肿瘤细胞生长调节中的重要功能,了解AK6/hCINAP表达的调控录机制有助于确定在肿瘤发生过程中控制AK6/hCINAP表达的癌基因。
3.1 转录因子HIF-1α调控AK6/hCINAP的转录水平
最近的两项研究表明,HeLa 细胞在缺氧条件下以缺氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)依赖的方式促进AK6/hCINAP的积累。在缺氧条件下,HIF-1α 的表达呈时间依赖性上调,HIF-1α 结合至AK6/hCINAP 的启动子区域并促进其转录,导致AK6/hCINAP的表达亦呈现时间依赖的上调[31-32]。AK6/hCINAP 通过增强Akt/mTOR 信号通路促进肿瘤细胞的上皮-间充质转化,并抑制缺氧诱导的细胞凋亡[31]。敲低AK6/hCINAP 可以抑制LDHA活性,并降低缺氧诱导的乳酸积累。此外,AK6/hCINAP参与线粒体介导的凋亡,包括细胞色素c的释放和caspases的激活[32]。
3.2 去泛素化酶OTUB1调控AK6/hCINAP的蛋白质水平
最新发表的研究表明,在血清饥饿刺激条件下AK6/hCINAP 蛋白水平显著上调,去泛素化酶OTUB1 (OTU domain-containing ubiquitin aldehyde-binding protein 1) 被鉴定为调控AK6/hCINAP蛋白稳定性的重要调节因子[28]。AK6/hCINAP 在K26/115/137 位发生K48 连接的多聚泛素化修饰,诱导其发生蛋白酶体途径依赖的降解。在血清饥饿刺激条件下,去泛素化酶OTUB1与AK6/hCINAP的相互作用增强,并以去泛素化酶活性依赖的形式去除AK6/hCINAP K48连接的多聚泛素化修饰,提高AK6/hCINAP蛋白的稳定性,延长AK6/hCINAP的半衰期,提高AK6/hCINAP蛋白的丰度。
4 腺苷酸激酶AK6/hCINAP的生物学功能
AK6/hCINAP 广泛表达于多种组织,如心脏、大脑、胎盘、肺、肝脏、骨骼肌、肾脏和胰腺等[18],并参与调节许多生理过程,在细胞存活、基因组稳定性、肿瘤发生、炎症疾病、胚胎发育以及细胞衰老的调节有关(图3)。本文总结了目前对AK6/hCINAP多种生物学功能的认识。
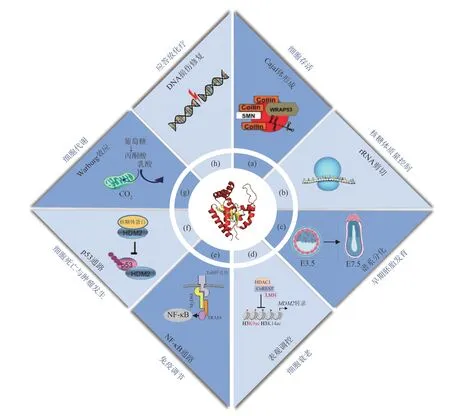
Fig. 3 Overview of the biological functions of AK6/hCINAP图3 AK6/hCINAP的功能概述
4.1 AK6/hCINAP在不同生理过程中的生物学功能
4.1.1AK6/hCINAP调控典型Cajal体的形成
CBs是一类存在于哺乳动物细胞中可发生动态变化的核细胞器[34-35],其参与调控组蛋白和核糖核蛋白基因的转录,以及小核仁核糖核蛋白(small nuclear ribonucleoproteins,snRNPs) 的 成熟[36]。最初,Santama 等[18]使用酵母双杂交系统将AK6/hCINAP 鉴定为柯浩体蛋白(coilin)的相互作用蛋白,并发现AK6/hCINAP 与coilin 的羧基端存在相互作用。在HeLa 细胞中过表达AK6/hCINAP 导致每个细胞核中CBs 的数量减少,并影响 CBs 的稳定性和组装率[18]。进一步利用RNAi技术干扰AK6/hCINAP的蛋白质表达水平,结果显示敲低AK6/hCINAP 导致典型CBs 的形成存在缺陷,并降低组蛋白转录和细胞存活率[24]。这些研究结果表明,AK6/hCINAP是典型的CBs形成与组蛋白基因转录所必需的。
4.1.2AK6/hCINAP参与核糖体的质量控制
核糖体作为蛋白质翻译的工厂,在真核细胞的生命活动中发挥重要作用。最早Granneman 等[33]在酵母细胞中发现,AK6/hCINAP的同源蛋白Fap7对于核糖体20S pre-rRNA 剪接成为成熟的18S rRNA 是必需的。随后,Ghalei 等[37]发现Fap7 与核糖体蛋白RPS14 及甲基转移酶Dim1 形成三元复合物,RPS14 会激活Fap7 的ATP 酶活性,这有助于在40S 核糖体成熟过程中释放Dim1,进一步规范核糖体小亚基的形成质量。在哺乳动物细胞中的研究结果表明AK6/hCINAP核糖体质量控制的功能是保守的[23]。AK6/hCINAP结合18S-E前体rRNA,并促进内切酶Nob1(NIN/RPN 12 binding protein 1)介导18S rRNA 的成熟,进而影响核糖体小亚基的生成和核糖体的质量。敲低AK6/hCINAP导致哺乳动物细胞中18S rRNA 的加工缺陷,抑制核糖体40S小亚基的组装过程,从而阻碍细胞内蛋白质的合成[23]。
4.1.3AK6/hCINAP对于早期胚胎发育至关重要
小鼠早期胚胎发育受到精密的调控,最近一系列研究显示Hippo 信号通路与YES 关联蛋白1(Yes-associated protein 1,YAP1)在调控小鼠早期胚胎发育过程具有重要作用[38-40]。在小鼠中敲除hCINAP的同源基因mCINAP导致胚胎死亡[23]。进一步的研究表明,mCINAP对于小鼠原肠胚阶段的谱系分化是关键的[28]。敲除AK6/hCINAP 导致YAP1 过度激活,进一步通过相互作用实验筛选,证明AK6/hCINAP与YAP1的重要调控因子E3连接酶 NEDD4 (neural precursor cell expressed,developmentally down-regulated 4)相互作用。在小鼠胚胎干细胞(mouse embryonic stem cells,mESCs)中敲除mCINAP 导致NEDD4 在细胞质中发生液液相分离(liquid-liquid phase separation,LLPS),NEDD4 募集丝/苏氨酸蛋白激酶NLK(Nemo-like kinase)与YAP1于LLPS体系中,促进了NLK介导的YAP1 Ser128位的磷酸化修饰,提高了YAP1的稳定性和转录活性,有助于mESCs向外胚层分化。在mESCs中敲除mCINAP导致YAP1过度激活,从而促进mESCs 向外胚层分化,抑制mESCs 向内胚层分化,从而导致小鼠原肠胚阶段胚层谱系分化紊乱和死亡。
4.1.4AK6/hCINAP延缓细胞衰老
细胞衰老是一个受多重因素影响,并由多层次信号应答通路协调的重要生命过程。最初,在秀丽线虫中利用RNAi 敲低AK6/hCINAP 的同源蛋白cCINAP,可以抑制秀丽线虫的生长[29]。在拟南芥中敲低AK6/hCINAP 的同源蛋白aAK6,抑制拟南芥抽苔,导致植株矮小[30]。进一步发现在秀丽线虫中敲低cCINAP 可以显著抑制秀丽线虫的寿命;与此相一致,在小鼠骨骼肌和肝脏中特异性敲除mCINAP 也能加速小鼠衰老进程[26]。这些现象表明,AK6/hCINAP是细胞衰老过程中的一个负调控因子,可以抑制细胞衰老。对其分子机制的探索发现:一方面,AK6/hCINAP与MDM2/p53信号通路的上游调控因子p14ARF 相互作用,拮抗p14ARF对E3连接酶MDM2(mouse double minute 2)的抑制作用,最终促进MDM2介导的p53多聚泛素化降解;另一方面,AK6/hCINAP 通过与去乙酰化酶HDAC1相互作用,抑制HDAC1-CoREST复合物形成,进而抑制HDAC1/CoREST 复合物对MDM2 启动子区H3K9ac的去乙酰化修饰,提高MDM2的转录水平,最终促进p53的泛素化降解,从而延缓衰老表型。
4.2 AK6/hCINAP与疾病的关联
4.2.1AK6/hCINAP通过抑制NF-κB信号通路参与调控自身免疫疾病
转录因子NF-κB 作为免疫系统的关键调控因子,诱导多种免疫应答基因的表达[41]。许多调控机制严格控制NF-κB信号通路的稳态,NF-κB的异常活化可直接引起自身免疫性疾病和炎症相关的癌变[42]。AK6/hCINAP 通过靶向IKK 复合物负调控NF-κB 信号通路[27]。在TNF-α 的刺激下,AK6/hCINAP 招 募PP1 与IKKβ (inhibitor of nuclear factor kappa B kinase subunit beta)形成三元复合物,促进PP1 去除IKKβ 的磷酸化,抑制p65 的核易位,不利于NF-κB信号通路的激活和下游基因的表达。低水平的AK6/hCINAP 会导致IKKβ 磷酸化增强,NF-κB信号通路过度激活,并与系统性红斑狼疮等自身免疫病发生密切相关。
4.2.2AK6/hCINAP通过抑制p53信号通路促进肿瘤发展
转录因子p53作为抑癌蛋白,发挥肿瘤抑制的作用,一些肿瘤细胞通过核糖体蛋白(RP)-HDM2-p53 信号传导途径抑制p53 的蛋白质水平,从而促进肿瘤的发展[43]。AK6/hCINAP 通过抑制核糖体小亚基蛋白RPS14负调控p53,促进肿瘤发展[25]。AK6/hCINAP 与RPS14 存在相互作用,并进一步招募去NEDD 化酶NEDP1 去除RPS14 的NEDD 化修饰,削弱了RPS14 与p53 泛素E3 连接酶HDM2 的相互作用,导致游离的MDM2 增多,增强了MDM2 介导的p53 多聚泛素化修饰和蛋白酶体降解,从而抑制肿瘤细胞的凋亡。
4.2.3AK6/hCINAP通过调控18S rRNA剪切促进乳腺癌的发生发展
肿瘤细胞的快速生长需要大量且高效的核糖体组装及蛋白质翻译。上文提到AK6/hCINAP参与核糖体质量控制,与其促进18S rRNA 剪切的功能一致,研究发现AK6/hCINAP在人类多种癌症组织中的表达水平显著上调。在乳腺癌细胞中敲低AK6/hCINAP的表达将引发细胞周期阻滞,促进细胞凋亡,并最终抑制肿瘤细胞成瘤。AK6/hCINAP的高表达可促进肿瘤细胞增殖。对其分子机制的探索表明,高表达AK6/hCINAP促进核糖体组装并选择性地上调促癌相关蛋白mRNA 的翻译效率,从而有利于肿瘤细胞生长。这些研究揭示了AK6/hCINAP通过上调核糖体组装选择性地提高癌症相关蛋白的翻译效率,从而促进肿瘤细胞生长[23]。
4.2.4hCINAP促进肿瘤细胞的糖酵解和结直肠癌干细胞的自我更新
肿瘤细胞代谢最主要的一个特征是Warburg效应(有氧糖酵解),即纵使在氧气充足的条件下,肿瘤细胞依旧通过糖酵解反应而非氧化磷酸化为细胞生长提供充足能量,其与肿瘤生长和细胞侵袭密切相关。本课题组研究发现,AK6/hCINAP在结直肠癌中明显高表达,能够促进结直肠癌干细胞的有氧糖酵解,进而促进表皮间充质转换、迁移、侵袭、重新成瘤、自我更新以及对化疗药物的不敏感性[22]。对其分子机制的研究发现,AK6/hCINAP与有氧糖酵解通路中的重要代谢酶LDHA 相互作用,并依赖自身的腺苷酸激酶活性催化ADP 生成ATP,提高结直肠癌干细胞的细胞质中ATP 的水平,进而促进纤维细胞生长因子受体1(fibroblast growth factor receptor 1,FGFR1)催化的LDHA 第10 位酪氨酸的磷酸化和活性,增强了结直肠癌干细胞的Warburg 效应。AK6/hCINAP 的敲低能抑制细胞有氧糖酵解,促进线粒体呼吸和活性氧的产生,进而促进结直肠癌干细胞的凋亡。而在人正常结肠干细胞的类组织中,AK6/hCINAP的敲低对细胞凋亡的影响很小,而且不影响结肠干细胞的分化,表明AK6/hCINAP作为药物靶点在结直肠癌治疗中的副作用会很小。此外,葡萄糖水平低等代谢压力引起的细胞ATP 水平的降低会抑制LDHA 的磷酸化并促进AK6/hCINAP 和LDHA 的相互作用。而在结直肠癌中,AK6/hCINAP的异常高表达能通过促进LDHA 磷酸化来促进糖酵解产生能量,从而提高结直肠癌干细胞对营养匮乏的抵抗性。综上所述,AK6/hCINAP可以调节结直肠癌干细胞的代谢重编程,是治疗结直肠癌转移的一个有前景的药物靶点。
4.2.5hCINAP调控DNA损伤修复和急性髓系白血病细胞耐药性
DNA损伤反应(DNA damage response,DDR)是一种复杂的系统,能确保细胞在发生DNA 损伤时维持基因组的完整性并顺利存活下来[44]。 泛 素 化、 SUMO (small ubiquitin-like modifier)化等多种蛋白质翻译后修饰在DNA损伤反应中发挥重要作用[45]。在DDR 通路中,AK6/hCINAP 与去SUMO 化酶SENP3(Sentrin/SUMOspecific protease 3)协同调控核仁磷酸蛋白B23(nucleophosmin,NPM1)的SUMO 化修饰[21]。当双链DNA发生断裂时,NPM1发生SUMO化修饰,并进一步招募损伤修复相关蛋白至损伤位点。与此同时,AK6/hCINAP 被募集到DNA 损伤位点,促进SENP3 去除NPM1 的SUMO 化修饰,导致修复蛋白从DNA损伤位点解离,增强DNA损伤的同源重组修复,促进急性髓性白血病细胞的存活。AK6/hCINAP 敲除的细胞中基因组不稳定性增加,并出现更多的染色体断裂,表明AK6/hCINAP 在DDR 通路中的功能对于维持基因组的稳定性至关重要。进一步研究发现,AK6/hCINAP蛋白在急性髓系白血病(acute myelocytic leukemia,AML)病人白细胞中的含量比正常人白细胞中含量偏低,在人源肿瘤移植小鼠AML 疾病模型中敲低AK6/hCINAP 蛋白的表达,会导致AML 疾病小鼠对化放疗药物更加敏感,表现为小鼠外周血细胞凋亡比例增加,脾脏内细胞损伤比例增加,恶性增殖比例降低,脾脏恶性肿大现象得到抑制,显示好的化疗治疗效果和更高的存活率。
5 展 望
在过去20 年中,对AK6/hCINAP 的生理作用及其在癌症和免疫中的调控作用和机制进行了系列的研究。对AK6/hCINAP1 生理作用及其分子机制的探索不仅会更深层次揭示其生理功能,而且有助于为肿瘤等疾病的临床治疗提供理论基础。接下来,我们将讨论AK6/hCINAP需要未来研究的关键方面。
5.1 AK6/hCINAP的双重酶活性在其生物学功能中的作用
由于AK6/hCINAP同时具有腺苷酸激酶和ATP酶活性,因此了解AK6/hCINAP的双重酶活性是否在其生理功能中发挥作用很重要。本课题组前期研究证明,AK6/hCINAP 的ATP 酶活性对其调控18S rRNA 加工至关重要[23],腺苷酸激酶活性对AK6/hCINAP促进LDHA磷酸化很重要[22]。在其他关于AK6/hCINAP的研究中较少涉及到AK6/hCINAP酶的活性,因此,未来研究可以通过使用AK6/hCINAP ATP酶活性位点突变体D77G/H79G及腺苷酸激酶特异性抑制剂AP5,阐明AK6/hCINAP的哪种酶活性在其生物学功能中发挥功能。
5.2 靶向AK6/hCINAP的小分子抑制剂和单克隆抗体
近期研究发现,结肠肠癌干细胞的代谢重编程受到AK6/hCINAP的调控,AK6/hCINAP有助于满足侵袭性结肠肠癌干细胞的能量需求,是结肠肠癌干细胞代谢重编程的有效调节剂,亦是抑制结直肠癌侵袭转移的潜在药物靶点[22]。值得注意的是,抑制AK6/hCINAP可显著促进结直肠癌非干细胞和结肠肠癌干细胞的凋亡,但对结肠类器官的凋亡无显著影响。因此,拮抗AK6/hCINAP功能对于治疗结直肠癌是一种潜在的有效策略。此外,AK6/hCINAP低表达的急性髓系白血病细胞对化疗试剂更敏感[21],暗示AK6/hCINAP 是一个潜在的治疗靶点。未来的研究可进行AK6/hCINAP小分子抑制剂和靶向癌细胞AK6/hCINAP 的单克隆抗体的筛选,并检测其对肿瘤细胞增殖、迁移、侵袭的影响,以及探讨其与不同药物和抗体联用是否能增强肿瘤细胞对放化疗的敏感性。
6 总 结
最近对AK6/hCINAP的结构、细胞功能的深入研究突出了其在正常生理条件及病理条件下的重要功能。到目前为止,已有的研究有助于进一步理解AK6/hCINAP在肿瘤发生中的作用,并为探索治疗由AK6/hCINAP功能障碍引起的恶性肿瘤提供新策略。进一步研究AK6/hCINAP的上游调控因子、结构和下游功能将为了解其活性和特异性提供重要的见解,并有助于促进AK6/hCINAP选择性抑制剂的开发及其临床应用。
