放射自显影技术应用的现状及未来趋势
2023-05-16张洪杰
张洪杰
(中国科学院生物物理研究所,蛋白质科学技术平台,北京 100101)
自20 世纪初被发现后,放射性现象在生物学和医学研究中很快就得到了广泛的应用,并为学科的发展提供了重要的实验方法。由于人们对放射性引起的环境污染和操作人员对(潜在)损伤的担忧,目前除核医学领域外,使用非放射性的替代方法已经成为一种趋势。面对新技术对放射性示踪技术服务带来的挑战,加强示踪技术共用平台的建设就必须明确当前放射示踪技术的活跃应用领域。放射自显影技术是生物学中广泛使用的放射示踪技术之一,在放射标记探针的定量以及与细胞、组织、生物体中探针作用靶点的分布等方面,已经积累了丰富的研究资料。荧光或化学发光标记探针[1-4]已经广泛替代了过去一定要使用放射性标记的核酸测序、放射免疫分析、核酸的分子杂交检测等领域。原位质谱成像技术作为一种不需外源标记的非放射性技术,已经成为放射自显影技术的竞争者[5-7],用于研究目标分子在组织切片中的分布。本文分析归纳了近年来放射自显影技术应用仍比较活跃领域中的工作进展,试图梳理放射自显影技术应用的一些主流趋势,提高共用技术平台服务的针对性和有效性。
1 放射自显影的基本方法
1.1 基于X光胶片的显影技术
X光胶片乳胶内含有细微的氯化银微晶,受到一定能量以上的光(如电离辐射、日光等)照射,就会发生光化学还原反应生成金属银颗粒。通过显影和定影漂洗将未还原的氯化银除去,从而在胶片上留下感光后生成金属银颗粒图像。射线能量越高,能够透达乳胶层的深度越深,强度越高生成的银颗粒密度也越高。32P的β射线能量太高,成像的分辨率低,仅适合于在DNA或RNA等检测中做定性、定量分析。而3H、14C、33P、35S 这类低能β 粒子,只能达到乳胶基质层的一定深度,除用于定量外还能用来分辨放射性核素在动植物组织乃至亚细胞器中的分布定位。获得理想的曝光结果通常需经较长的曝光时间,例如要想获得3H 标记探针的高分辨组织切片图像需要压片10 周左右[8]。因而在实际应用中缩短样品的自显影时间对提高科研效率有相当大的吸引力。
在分子生物学应用中,人们更关心如何快速获取检测样品的信号强度。用含3H、14C、35S 探针的凝胶电泳法分析标记蛋白质或核酸的放射自显影是实验中经常遇到的问题。以3H 为例,它在水中的射程约0.8 μm,在凝胶电泳胶中,可以近似认为只有胶表面上的样品具有放射成像的作用,采用0.75 mm厚度的薄胶容易制备成干胶,降低水介质对电离辐射的衰减作用,同时抑制因曝光时间长导致的样品条带弥散的缺陷[9],将电泳胶内的放射标记样品条带转移到薄膜上也能有效降低凝胶介质对弱β 辐射的衰减作用。试剂EN3HANCE 能够改善弱β核素的放射自显影效果,其原理是将溶有闪烁剂的二甲基亚砜(DMSO)溶液浸润胶条后,再将胶条置于曝光盒中对样品进行曝光,此时胶片曝光机制已发生改变,由处理前的电离射线直接导致氯化银的光还原反应转化为电离射线激发闪烁剂产生的荧光引起氯化银的光还原反应。由于水、DMSO 等溶剂对液闪信号有一定程度的猝灭效应,该试剂的信号增强效果有限。Long等[10]在检测组蛋白甲基化酶对核小体蛋白的甲基化作用时,采用[3H]SAM作为甲基供体,并通过胶片放射自显影展示目标蛋白产物的分子质量信息以及不同条件下甲基化产物的量的变化。为了提高样品的显影效率,利用电转技术将标记后的蛋白质样品条带从SDS凝胶转移到硝基纤维素薄膜上,再将2,5-二苯基噁唑/冰乙酸闪烁液喷涂到薄膜上,待冰醋酸挥发后,曝光盒中压片1 d,经显影和定影处理可获得很好的成像效果。与EN3HANCE 方法的不同之处是这种改进降低或消除了溶剂的猝灭作用。
1.2 基于磷屏的自显影技术
20 世纪60 年代发现了某些磷光物质在电离辐射处理后能够在特定激光的激发下产生化学发光现象(OSL)[11],分子能带理论认为电离辐射(如X光)照射磷光物质能够产生初级自由电子和空穴载体对,这些空穴载体与物质中的晶格撞击产生二级电子和空穴对并伴随着能量损失(热损失),最终通过化学发光或电子俘获而消失。如果引入一个外源激光激发就能启动空穴载体俘获自由电子的过程从而释放能量,这部分能量以化学发光的形式释放出来。晶格缺陷或掺入某种杂质对磷光物质进行改性能够提高自由电子和空穴载体的稳定性,减少体系的能量损失。
图1显示了电离辐射信息的写入、记忆、读取以及擦去的模式图。在实际操作中,往往将这类具有OSL性质的材料涂布到硬板或软板材料的一面,制成商品化的磷屏。在放射自显影时,将放射性样品和具有OSL 性质的材料涂层紧密压在一起,并保存在样品盒中,让放射性探针照射磷屏一段时间(称为写入),然后移去放射性样品,写入磷屏的信息就得到了保存(称为记忆),记忆了信息的磷屏经激光扫描,磷屏中的信息就会以光的形式释放并通过积分器记录特定时间内的光致化学发光信号强度(称为读取)。记忆在磷屏内的信息可以反复读取,但每读取一次,记忆信息的信号强度就会有一定程度的降低。磷屏中记忆的信息量和输入信息(电离辐射强度)在一定的范围内成线性关系。输入信息高于其阈值会导致信号过饱和。同时记忆在磷屏中的信号是亚稳定的,漏光/高温会损失储存的信息。使用磷屏的最后一步是对记忆信息的擦去。通常厂商会配备一定强度的日光灯箱,通过光照擦去原先记忆的信息。经这一处理后,磷屏可进入下一轮的信息写入、记忆、读取过程。利用磷屏技术进行放射自显影所需的时间较传统胶片法显著缩短,信号灵敏度也显著提高,读取电离辐射信号的线性区间广,操作更快捷。系统研究表明,磷屏成像技术可以广泛地应用于各种放射自显影的操作中,结合标准品的使用,能够获得成像图中不同区域的放射探针的定量结果[12-14]。
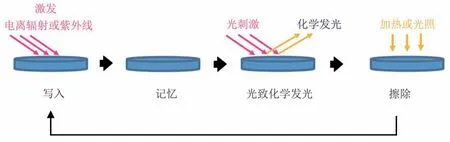
Fig. 1 An illustration of optically stimulated luminescence phenomenon图1 磷屏的光致化学发光现象示意图
磷屏技术应用到放射自显影中使得放射示踪分子生物学研究方便了许多,除缩短32P 标记样品的曝光时间、提高对放射信号的检测灵敏度外,对弱放射性核素成像操作的便利性更为显著。14C和35S标记物的SDS 凝胶电泳胶片、薄层色谱板等都可以直接压屏[15],并获得良好的信号强度。为了保证磷屏不被污染,通常是将放射标记样品用塑料薄膜包起来。因为14C和35S的穿透能力比较弱,所用的塑料膜越薄越好,而且只包裹样品。对于3H 标记的放射性样品,需要特殊型号磷屏(如美国富士生物医疗系统公司的BAS TR2040s,一种不含保护性涂层的产品型号),并且标记样品(如SDS凝胶电泳的电转膜样品)和磷屏的感应面要紧压在一起。使用磷屏做放射自显影时要留心压屏前的磷屏是没有被污染的。
目前在学术研究领域,X光胶片放射自显影法和磷屏放射自显影法同时存在,选用哪一种方法主要取决于研究人员的个人偏好和操作设备的便利可及性。
2 放射自显影技术的应用
2.1 在分子生物学中的应用
2.1.1酶活检测
放射性示踪因其信号的专一性、高灵敏性和检测的便利性在分子生物学的定性鉴定和定量检测方面得到广泛的应用,并成为诸多检测方法的金标准。伴随着放射性检测发展的同时,也出现了多种非放射性替代技术,主要是荧光标记检测或化学发光检测技术。目前荧光标记法和放射自显影法的检测灵敏度大致相当[16]。尽管放射自显影技术的应用空间受到一定的挤压,放射性标记不改变探针分子结构的特征还是为该技术的应用提供了顽强的生命力。在研究DNA聚合酶、RNA聚合酶等酶的功能方面,放射自显影技术仍是主要手段。在分析这类反应的产物时,放射性底物的量要远高于产物的量,未反应底物的信号会严重影响低放射标记的产物分析,磷屏显影技术可以非常迅速地确定游离底物的前沿位置,通过切除后适当延长曝光时间,往往容易获得较好的产物条带图像[17-18]。对于小分子底物的酶促反应,薄层层析法[19-20]的放射自显影技术也是一个适当的选择。Xu等[19]在研究环化GMP-AMP 合成酶的酶活时,以[α-32P]ATP 为放射性底物,采用HPTLC Silica gel 60 为分离介质,使得ATP和产物cGAMP得到了非常好的分离,经放射自显影得到理想的酶活变化结果。另外,通过磷屏成像扫描,还可以定量测定酶促反应的理化常数。Hao 等[21]在研究解旋酶的ATP 酶活性时,采用不同浓度[γ-32P]ATP 为底物反应一定程度后,加入EDTA猝灭酶活;过去采用放射法测定ATP酶的活性时,常采用DEAE-纤维素作为分离介质,但该产品已经停产;Hao 等[21]采用Sigma 产阳离子改性薄层纤维素薄膜(一种被低聚乙二胺修饰的纤维素材料)对反应物进行分离,经磷屏成像,读取放射性磷酸的扫描信号强度,对磷酸产物的生产速率和底物ATP 的浓度作图,并用米氏方程进行数据分析获得酶的米氏常数为6.4 μmol/L,最大反应速度为2.4 μmol/L·min。可见采用放射自显影技术测定时,不论是电泳分离法还是薄层层析分离都对设备要求不高,操作周期都比较短,分离条件的优化也比较快捷,对多种酶而言,放射自显影是一种适当的活性测定通用技术。
2.1.2磷酸化位点分析
蛋白质磷酸化是细胞信号调控的重要现象,涉及到体内信号调控的多个通路。蛋白质的磷酸化是通过蛋白激酶将ATP中的磷酸基团转移到蛋白质、多肽底物上的丝氨酸、苏氨酸或酪氨酸残基上,直接影响底物蛋白的活性、功能或定位。底物蛋白上可以有一个或多个磷酸化修饰位点,不同位点的磷酸化状态不同,蛋白质的生物功能也会有所不同。因而,鉴定蛋白质的磷酸化修饰位点,阐述其生物学意义是研究体内信号通路的一个重要内容。32P标记在蛋白质磷酸化位点分析方面有着广泛的应用,尤其是近几年质谱技术的发展,使得磷酸化位点的鉴定变得更为便捷。虽然制备磷酸化位点专一的磷酸化抗体可以鉴定特定蛋白质的磷酸化位点[22],但当存在多个潜在的磷酸化位点需要逐一验证时,如果每个磷酸化位点都要制备相应的专一性抗体,则需要投入巨大的人力物力。这时32P 标记技术的快速简洁及结果明确的优势仍然是研究工作者的首选。Zhao 等[23]发现,水稻磷酸化酶PP2A 的B'κ 亚基可以使类受体激酶SIT1 中激酶活化环(activation loop)上的磷酸化氨基酸残基去磷酸化,起到直接抑制盐诱导的SIT1 磷酸化作用,同时类受体激酶通过对B'κ亚基的磷酸化提高该亚基的稳定性,起到削弱26S蛋白酶体对其降解、增强水稻抗盐性的作用。质谱分析发现,B'κ 亚基的4 个肽段中含有4 个潜在的磷酸化位点(S330/S331,T476、T493 和S502/T508)。质谱技术的出现极大缩小了潜在磷酸化位点的待验证数目,但是还需要通过体外激酶活性实验并结合放射自显影技术做进一步验证。以B'κ亚基的不同突变体为底物进行体外磷酸化SDS-Page 放射自显影分析,发现只有B'κS502A、B'κT508A以及双突变体B'κST502508AA的磷酸化产物被显著抑制。进一步的功能分析验证了正是B'κ亚基Ser502而不是Thr508的磷酸化在调控水稻的耐盐中起着关键的调控作用。上述结果同时也暗示了单纯的体外磷酸化研究和体内的作用机制可能存在一定的差异。目前并不清楚在体内环境下Thr508 是否发生了磷酸化。如果Thr508 不发生磷酸化,细胞内又是通过怎样的机制来保持Thr508的去磷酸化状态的?如果发生了磷酸化,又会对水稻的生长、发育有何影响?因此,在许多情形下采用活细胞进行标记研究分子修饰的反应机制就显得很有必要。
正磷酸的32P 探针标记法为体内磷信号表达、加工、活化过程的功能研究提供了便利条件[24-25]。Fam20C 蛋白家族是蛋白质分泌途径中的主要激酶,是分泌型磷酸化蛋白质组的主要加工者,丢失功能的突变可导致致命的骨硬化性骨发育不良综合症[26-27]。Fam20C 是II 型跨膜蛋白,新生肽链在体内合成后,被转运到高尔基体,并在此经膜蛋白site-1 蛋白水解酶(S1P)加工切去Fam20C 的前肽,激活Fam20C的激酶活性,调控下游靶蛋白的磷酸化状态,进而调控细胞的生理功能[28]。Chen等[29]在研究S1P 剪切活化Fam20C 的激酶功能过程中,以HeLa细胞为宿主,在培养基中加入32P标记的磷酸,作为磷酸化的磷供体,对激酶底物OPN 通过免疫共沉淀进行富集分离后,经SDSPage 分离、电转到硝基纤维素膜上,再通过放射自显影分析磷酸化反应的程度。共表达Fam20C和OPN,并在培养液中加入不同浓度的S1P酶抑制剂PF-429242可以发现OPN的磷酸化程度受到了显著的抑制。通过RNA 干扰技术敲除S1P 标签基因的表达,经类似的放射自显影分析也验证了S1P 对Fam20C 前肽的切除对该激酶的活性发挥起着重要的作用。
可见放射性探针在研究蛋白质磷酸化位点的过程中不论是体外分析还是体内鉴定都提供了高效、专一的实验方法。
2.1.3蛋白质-核酸相互作用
在蛋白质-RNA 相互作用研究方面,确定存在着特定蛋白质与RNA 相互作用的现象是解决问题的第一步。尽管在RNA 的发现方面已经建立了一些非放射性技术,如基于微阵列的RNA 分析[30]、RNA的深度测序分析[31]以及荧光标记的原位杂交分析技术[32],但缺点是很难建立起RNA序列和蛋白质之间的相互作用关系。32P 标记法是确定目标蛋白具有RNA 结合功能的重要手段,专一性强,也是指导鉴定RNA序列、分析蛋白质-RNA复合物功能的锐利眼睛。Chen等[33]通过光交联结合免疫沉淀测序技术(CLIP-seq)成功发现在活化B细胞中存在着蛋白质分子ROD1 与RNA 之间的相互作用。具体操作中,首先将一定数量的B 细胞经254 nm 紫外线辐照,制备蛋白质-RNA 交联复合物,细胞裂解后经过免疫共沉淀富集产物,再经核酸酶处理,并在5'端标记32P。样品经SDS-Page 电泳后,电转到硝酸纤维素膜上,并通过放射自显影获得ROD1 处的弥散条带。回收显影条带处的RNA样品,最终完成对结合RNA的序列分析,进而阐明了存在RNA 介导的蛋白质分子ROD1 与AID 结合形成复合物,并组装到特定的基因位点,诱导免疫过程中DNA重排的反应机制。因为RNA容易降解,同时蛋白质-RNA 交联产物的丰度低,这类实验要获得好的结果往往需要反复的条件优化探索。
上述分析表明,当非放射性替代技术缺乏灵敏度高、标记产率高、标记条件温和的标记探针时,放射自显影仍是解决研究中各种问题的高效方法。
2.2 在组织化学研究中的应用
Pelc[34]通过给实验大鼠皮下注射放射性131I后,甲状腺组织经乙醇固定、石蜡包埋制成5 μm厚的切片,然后和感光胶片接触曝光,经显影、定影后获得了放射性碘在甲状腺组织中分布的清晰图片,14C、33P、35S 等人工核素的成功制备及其标记探针合成技术的进步开启了利用放射性示踪法研究标记物在生物体组织分布,及在细胞内亚细胞器定位的新纪元。按照加入放射性标记探针到细胞、组织中的方式不同,放射自显影操作可分为活体标记的组织切片放射自显影和体外标记的组织切片放射自显影两大类。在活体标记样品制备模式中,放射性标记探针直接输入到活体生物体内后,对生物体或某些器官组织进行包埋后冷冻切片,再经感光胶片或磷屏进行成像分析。依据研究目标又分为侧重于研究探针在生物体内各组织器官的分布变化的,称之为整体放射自显影 (whole-body autoradiography,WBA),以及侧重于研究探针在组织细胞中分布及其与结合靶点相互作用信息的,称之为显微放射自显影(microautoradiography,MARG)。
2.2.1整体放射自显影
动物WBA 技 术 最初由Ullberg探索成功[35]。动物经放射性喂食或注射标记后,处死并用聚合物包埋,再在低温冷冻条件下切成薄片,转移到载玻片上进行自显影操作。切片的厚度取决于切片机的性能,目前切片的厚度介于30~100 μm[36-37]。数字化成像屏替代X 光胶片使得操作变得更加便利[13-14,38-39],成像所需时间也显著缩短。对实验动物的全切片图像数据还可以进行数字化构建,形成探针在实验生物体内的三维空间分布,成为定性与定量研究标记药物的剂量与给药时间变化对药物在体内存留及分布变化的重要手段,为临床前新药的吸收、分布、代谢和排泄等药理机制研究提供重要的量化参数[40-41]。小分子化合物AZD5248 曾是一个临床前研究的口服二肽酶抑制剂,用于治疗慢性阻塞性肺病。对实验大鼠口服[14C]AZD5248 后的不同时间进行定量WBA 分析发现,给药1 h 后[14C]AZD5248在体内分布就达到高峰,且在各组织器官中广泛分布,标记药物及其代谢物主要通过胆汁和尿液分泌排泄到体外,给药21 d后仍能在主动脉观察到显著的放射性存留,而在其他组织中放射性存留已接近本底,电镜观察认为放射标记化合物结合在动脉的弹性组织中,结构分析认为AZD5248 中的伯氨基官能团与动脉血管中的弹性蛋白发生铰链是AZD5248 滞留在动脉血管最有可能的原因。这一发现终结了AZD5248 进行后续临床研究工作的可能性[42]。通过对AZD5248的结构进行系统改造,将六元环上的伯氨基经扩环变为仲氨基,使原来的六元环扩展为七元环,同时对分子的其他部位也进行改造,最终得到了一个功能良好的新的二肽酶抑制剂AZD7986[43]。[14C]AZD7986合成成功后,再次采用定量WBA法对该化合物在大鼠体内的存留分布进行研究,结果证实了AZD7986 没有类似于AZD5248 的在动脉血管弹性组织存留的问题,随后AZD7986 成功进入了临床研究[44]。WBA技术不仅在动物研究中被广泛使用,在植物的营养转运、农药的代谢分布等方面也起着重要的作用[45-46]。Kubicki等[46]研究了[14C]甲霜灵在西红柿植株中的转运过程。将已长出3片叶子的西红柿植株无土栽培到含0.2 ppm[14C]甲霜灵的培养罐中,生长10 d后,采集根、茎、叶进行分析,发现97%的[14C]甲霜灵已被吸收转运到植株体内,其中叶占70%,根占2%以下。对根和叶片的放射自显影研究显示,在根系部位放射性物质更趋向集中分布在上部一侧,在叶片中的分布情况是放射探针沿叶脉分布并终止在叶片边缘,在嫩叶中的分布更显著,且呈现出向顶性分布态势。甲霜灵的这种分布反映出[14C]甲霜灵从根吸收后向新的生长区域快速运动的特性。
虽然WBA能够提供比较丰富的放射性分布信息,但是它的不足也是很明显的。首先,WBA 法获得的只是某组织区域放射性总体信号或转化为对应探针的总浓度,至于探针分子是结合到作用靶分子上还是游离在组织细胞中,就不得而知了。其次,所得总信号中是否含有起始标记探针的代谢物也不得而知(这方面可以利用HPLC-MS技术进行代谢物的结构研究[46-47])。再次,如果所研究的探针靶点在组织中的丰度比较低,那么针对低丰度靶点的放射自显影信号就会很低,从而淹没在WBA结果的信号本底中。
2.2.2显微放射自显影
MARG技术可以部分弥补WBA的不足,成为研究放射性探针在组织细胞中与靶分子相互作用的重要方法。然而不同文献中的MARG 具体操作条件指代并不相同,某些情况下更像是一个压缩版的WBA分析[48]。对于活体标记的研究对象而言,要获得放射探针在组织亚细胞器分布的清晰图像,熟练掌握高分辨MARG 制备技术尤为关键,其中获取足够薄的切片(不超过4 μm,乃至1 μm)是降低/避免游离探针的噪音信号获取成功的共同特征之一,Stumpf[49]称这种制样操作下研究受体分布的技术为受体显微放射自显影,利用此技术他们发现[50],与大多数受体分布在细胞膜上不同,雌二醇受体分布在子宫细胞的细胞核上,近来又报道雌二醇受体在早期孕鼠的子宫内膜基质中已获得表达[51]。此方法在维生素D 受体分布的研究中也取得了一系列的成果[52-53]。而体外放射探针标记的MARG 操作在研究中使用的就更加广泛,尤其是该操作还能够以人源尸体组织为材料,研究放射探针的分布及与靶标间的相互作用,因而能够提供更加丰富的信息。与活体标记的MARG 技术不同,体外标记MARG 的优势之一就是能够控制影响探针与作用靶点专一作用的操作因素,这包括通过预先处理样品去除原本结合在靶分子中的内源性配体达到靶分子预活化的目的,也包括预先封闭可能存在的非专一性结合位点以及调整探针标记的pH、温度、作用时间等实验因素。在体外标记样品的制备过程中,通常都会在标记之后对样品进行清洗以去掉未结合的放射探针,避免活体标记方法检测样品中游离探针或其代谢产物的影响。因而在高度选择专一性的放射性标记配体存在下,MARG 能够展现靶分子蛋白质丰度的组织分布,在受体的研究中得到了广泛的应用[54-56]。 Mitsukawa 和Kimura[57]采用3H 标记的Orexin 2 受体选择性拮抗剂EMPA为探针,通过定量显微放射自显影研究了Orexin 2受体在大鼠脑及外周组织中的分布。在定量研究的51个脑组织部位和10个外周组织中发现,Orexin 2受体在大鼠脑组织广泛表达,而在外周组织几乎不表达。除受体之外放射自显影在阿尓茨海默病(AD)的病理研究以及临床诊断技术开发中也发挥着重要作用。与淀粉样纤维化Aβ类似,Tau蛋白的过度磷酸化所导致的神经纤维缠结也是导致AD的原因之一,发展神经纤维缠结的早期检测技术对于AD的早期发现、早期治疗具有重要的应用价值[58-60]。THK5117[59]是一个对Tau 导致的神经纤维缠结专一性结合的探针分子,采用死亡的AD患者脑组织的颞叶部分通过液闪方法测定发现,含有2个THK5117结合位点,解离常数分别为2.2 nmol/L和23.6 nmol/L,以[3H]THK5117 为探针,对死亡患者脑组织切片进行标记后放射自显影,结果显示[3H]THK5117 集中分布在海马区、颞皮质以及额叶等部位,为采用[18F]THK5117 进行体内的PET成像分析提供了研究基础。
体外标记显微放射自显影可以提供高精度的受体空间分布,为其他研究技术,包括正电子发射断层成像(PET)技术提供有效的比较模型及空间参数。正电子成像是研究能发射正电子射线的核素立体空间分布的一种成像方法,因其使用的核素半衰期较短,射线的电离能量不是太高,小剂量辐射对人的健康影响不大,因而在临床前以及临床诊断方面有着广泛的应用。研究人员已经发现在某些条件下PET成像提供的放射性探针分布信息存在着一定的失真,例如脑干区域的放射性配体与受体结合的定量结果的可靠性就比较差,部分原因是由于成像过程中存在的局部容积效应。采用低能量的3H 标记探针放射自显影技术定量研究放射性配体与靶向受体结合时,由于3H 的射线能量低,只有组织切片表层的探针能够使胶片或磷屏曝光,避免了组织深层处的放射性探针对感光信号的影响,从而避免类似于PET中的局部容积效应带来的信号失真。同时对完整脑干组织的每张切片自显影图像数据按照切片的依次顺序通过数据的三维构建就能够得到放射探针在脑干组织分布的三维立体图像。这种方法得到的放射探针与靶受体结合的空间分辨率更高[61]。Veldman等[62]采用[3H]AZ10419369为探针,采用人源尸体的脑干为材料,构建了5-HT1B受体的高分辨受体-配体分布模板,基于[11C]AZ10419369 探针的人脑干PET 数据按照该模板对观测空间进行分析,获得了一套放射探针空间分布的分析数据(标记为ARG模板结果);同时他们借助于磁共振成像(MRI)提供的观测空间参数并嵌入到PET 数据中作为观测空间模板,对PET 数据进行分析获得了另一套的分析数据(标记为PET模板结果),通过比较不同模型下放射性配体的分布结果发现,在脑干的大部分区域,PET模板法获得的归一化的受体结合值较ARG 模板法获得的归一化的特异性结合值高,这种差异在背部的脑干部分观测空间更加明显;相反在脑干近尾部观测空间的归一化的受体结合值(PET模板法)较归一化的专一性结合值(ARG 模板法)要低。他们认为这种差异的存在是由于PET中局部容积效应造成的,这种差异的出现值得关注。
体外标记MARG 研究不仅能用来研究靶点分子的组织细胞内定位分布,还可以定量研究探针与靶分子的结合能力。研究中多采用冷冻切片法,此时靶点蛋白仍处于活性构象,通过改变标记探针的浓度,检测探针与靶分子的结合量就获得了标记探针浓度与靶分子结合之间的定量变化关系,通过计算就能定量表征探针与靶分子间的亲和力常数以及靶分子结合探针分子的分子数等理化常数[63-64]。适度的解离常数是放射探针能够成为体内示踪探针的首要条件之一。Mikkelsen等[65]利用放射自显影技术定量表征了新合成的放射标记配体[3H]JNJ-64413739 与靶向P2X7 受体相互作用的理化参数。P2X7 受体在药物难治性癫痫患者的颞皮质组织中表达增加,被认为是PET成像临床检测神经性炎症的第二代放射性配体靶标。实验用的组织材料来自于对药物难治性颞叶癫痫患者进行神经手术治疗时切除的颞皮质组织。将载有该组织切片的载玻片在室温用含有0.5% BSA 的缓冲液进行预孵育后转移到含有不同浓度[3H]JNJ-64413739的孵育液中孵育2 h,然后晾干进行放射自显影操作,再对放射自显影信号强度与配体的浓度作图,在扣除切片组织对疏水性放射探针的非特异吸附形成的本底后,探针的结合数据按照单点结合模式进行分析。在选定的条件下,[3H]JNJ-64413739 既能与蛋白质中的P2X7 受体结合也能与灰质中的P2X7受体结合,在饱和配体条件下两者的解离常数相近,都是约7 nmol/L,但最大结合量方面白质比灰质高约40%。此前对[18F]JNJ-64413739的PET临床研究已经发现该探针适合于定量表征人脑中P2X7受体的表达[66-67],Mikkelsen 等[65]的定量研究为[18F]JNJ-64413739探针的临床应用提供了理论基础。
2.2.3正电子标记探针的显微放射自显影
磷屏扫描成像技术大大缩短了组织切片的曝光时间,为短半衰期的核素(如11C、18F、90Y等)标记探针的放射自显影提供了可能。如同14C 在有机化合物药物标记中不改变药物的分子结构和理化性质因而得到广泛应用一样,11C、18F 标记的放射探针在PET 成像中也获得了广泛的应用,但在采用放射自显影研究PET 成像探针的靶向专一性时,大多数研究人员仍采用14C或3H标记的同一结构化合物进行体外标记的放射自显影操作技术,这意味着需重新探索14C或3H标记探针的合成,因而会大幅增加研究人员的工作量和研究成本。如果能够直接采用正电子探针开始体外组织的放射自显影研究将会有力推动PET示踪剂的探索工作。5-HT1A受体广泛分布在中枢神经系统,海马、中缝核以及大脑皮质中分布更加密集,在多种神经精神性疾病以及神经退行性脑病的病理过程中起着重要的作用,因此开发高效专一,合成便利的靶向5-HT1A受体PET探针是当下研发的一个热点。Dahl等[68]合成了两个11C 标记的类似化合物[11C] AZ11132132 和[11C]AZ11895530,其骨架结构非常类似,不同点主要在叔氨基上的两个取代基略有不同,在AZ11132132 中是两个刚性非常大的环丁基,而在AZ11895530 中变为一个环戊基和一个线状的正丙基。为了鉴定这两个标记探针的靶向专一性,以死后人源全脑组织经冷冻包埋再切成100 μm 厚的切片为材料,采用体外放射标记的方法处理组织后,使用磷屏成像获得了清晰的放射自显影图像。结果显示,[11C]AZ11895530在海马区和大脑皮层有高密度的结合,高浓度的WAY1006359(10 μmol/L)通过竞争性结合抑制[11C]AZ11895530 对海马区和大脑皮层组织中5-HT1A受体的结合,说明适当增加叔氨取代基团的柔性有利于化合物与受体的结合,为进一步开展对[11C]AZ11895530 的PET 研究提供了作用机制方面的基础。采用活体样品制备方法对[11C][69]以及[18F][70]标记探针的放射自显影也取得良好的成像结果,这为放射性标记探针在体内的分布研究提供了多种方法互相参考验证的途径。
3 展 望
放射自显影技术提供了从分子、组织以及整体层次认识生物体的组织结构和新陈代谢功能的多维度研究手段。同时在分子、组织、整体层次也都存在着多种非放射性实验技术与放射自显影技术形成补充。非放射性技术能够部分取代放射自显影,已经成为常规实验的首选,但在某些条件下,放射自显影技术的检测特异性、灵敏性和不改变探针分子结构的特性使得该技术仍然是研究过程中离不开的实验方法,这一点在某些酶的活性研究、蛋白质翻译后修饰位点鉴定、低丰度蛋白质-核酸相互作用研究等应用方面已经得到充分体现。荧光标记成像的最大障碍在于标记结构基团会或多或少地改变被标记分子的性质。只有荧光标记生物大分子(如目标蛋白与荧光蛋白融合表达)的方法,在研究目标分子在体内的加工、代谢以及与靶点作用等方面已经得到了广泛的应用[71],但研究荧光标记的小分子行为时,荧光基团对小分子结构和功能的影响就不能不考虑[72],这也是荧光标记小分子技术应用受到一定限制的重要原因之一。原位质谱成像技术是放射自显影法研究组织分布的一个新的强有力竞争者。原位质谱成像的一个主要特点就是不需要进行标记,可进行单一分子的质谱成像也可同时对多个内源分子进行成像叠加,扩大研究目标分子的范围。质谱成像可以在细胞及亚细胞器分布的分辨率水平对目标分子的分布进行定性与定量分析[5-7]。应当注意到,质谱技术测定分子结构的底层核心假设是在一定的分子质量精度下,按照分子式计算的精确分子质量与测定分子质量匹配的所有分子,包括同一分子的各种同分异构体都是可能的检测结构。理论上通过提高分子质量测定的精度可以提高命中目标化合物的成功率,通过二级质谱能够进一步鉴定一级质谱筛选出的哪个潜在化合物更符合目标化合物的特征。在生物学研究中通过建立一个完善的仅在生物体系或某个亚体系存在的生物分子化合物库,确定并缩小与精确分子质量测定值相匹配的化合物个数是生物成像技术发展的重要方面之一。建立完善的生物分子数据库,尤其是每一个物种的数据库仍是一个艰巨的工作。另一方面待检测分子一旦和生物大分子形成共价修饰,如AZD5248 对动脉血管弹性组织的共价修饰[42],也会逃离质谱检测的能力范围,因而也需要放射自显影等技术的多方验证。对于检测低浓度的受体配体,质谱成像仍有许多技术细节需要不断完善[37]。因此生物质谱成像技术是放射自显影技术的有益补充。目前质谱成像技术的使用成本仍高,专用的质谱设备普及仍有一个过程。本文引用的靶分子在组织切片中分布的放射自显影数据有一部分和PET工作相关,说明尽管PET 方法在临床检测中应用广泛,得到研究人员的广泛重视,并成为发展基于新探针、新靶点的PET诊断技术工作的一个热点,但组织切片的放射自显影分析仍是开拓PET检测方法的基石。而11C、18F 等正电子核素的磷屏成像分析为PET示踪剂的筛选提供了快捷的体外组织化学方法,必将会促进PET示踪剂合成与优化的步伐。因此在组织水平的研究中,尤其是在低丰度探针的分布研究中,放射自显影技术在相当长的时间内仍然是首选方法。
放射自显影领域的应用现状说明,面对非放射性替代技术的挑战,放射性示踪的优势应用领域发生了一定程度的转移。这和在放射性的液闪检测技术应用[73]中观察到的状况是相似的。除了上述重点介绍的应用领域外,放射自显影技术在蛋白质翻译后修饰的其他领域,如甲基化[10]、糖基化及其受体[74-76]、软骨中的二硫键[77],以及动脉粥样硬化[78]、内源性大麻受体的活性[79]等方面的应用依然十分活跃。因此,放射示踪共用技术平台的建设要面向优势领域和当前核医学的热门领域提供配套的核素资源、配套的操作设施、检测设备以及严格的辐射防护管理,通过多种途径提升放射示踪操作平台的应用效率。
在实际运行中还要加强对实验操作人员的辐射安全防护知识和技能的培训。既要防止极少数操作人员认为所用核素辐射能量低、使用剂量少、盲目蛮干的问题,更要关注大多数人员对射线的性质了解不多,甚至一无所知,却盲目夸大放射性核素的辐射损伤因素。严格按照放射操作规范进行相关工作是保证每一个放射从业人员安全的关键。我们遇到多个实例,因实验人员对放射性示踪技术持排斥态度导致前期的大量非放射性替代操作结果被拒,或被要求补充相关的放射性研究结果因而耽误了宝贵的时间,尽管这可能和某些审稿人的偏见有关。因此,根据实际工作需要适时恰当地采用放射自显影等实验方法对于推动相关科研工作的进展将会起到重要的作用。
