一份矮秆玉米表型鉴定和基因初步定位
2023-05-15张艳茹邱贵兰李若楠吴元奇
唐 兰,张艳茹,邱贵兰,李若楠,赵 丽,吴元奇
(四川农业大学 玉米研究所,四川 成都 611130)
玉米(ZeamaysL.)是全球及我国第一大粮食作物,是一种典型的集粮、经、饲、能、医于一体的多元作物[1-2]。玉米种质资源具有较强的适应性、抗逆性等特点,是确保我国粮食稳产和增产的压舱石,在我国粮食安全和能源安全中扮演着至关重要的角色。株高是玉米育种过程中最重要的农艺性状之一,玉米株高若过高则容易倒伏、倒折而造成减产,矮秆玉米的增产性得益于株型紧凑、抗倒伏能力强、适宜高密度种植和群体光合利用率高。因此,育种家提出,玉米的理想株型是指中秆或者中矮秆、叶面积适中、叶夹角小、穗型好、茎秆坚韧等特点[3-4],培育出矮秆、高产密植的玉米品种是提高玉米产量的重要手段之一[5]。
20世纪60年代以后,矮秆和半矮秆的使用极大提高了作物产量,并且爆发了农业生产的第一次“绿色革命”。1935年Emerson发现的玉米矮秆基因br2是目前研究与使用最广泛的玉米矮生基因[6-7],br2矮秆基因的特点是使玉米茎节明显缩短,尤其是果穗以下茎节位点越低,缩短越显著。研究表明,矮秆性状的使用,培育出了抗倒性和耐密性的新一代玉米矮秆品种[8-9]。目前,已鉴定的玉米矮秆基因有60多个,除D8、D9、D8-1023、D*-10、D11、Dt为显性单基因控制外,其余大多数为隐性单基因[10-15],与不良性状连锁,或者一因多效,能够直接应用于育种的矮秆基因很少。因此,新矮秆资源的鉴定和新矮秆基因的筛选或克隆,对矮化育种仍然具有十分重要的意义。
本研究在吴元奇课题组前期关于该材料育种潜势及遗传模式研究的基础上,鉴定出该矮秆有较好的单株产量配合力,具有极大的育种潜力价值,因此对dwarf-12和d8227矮秆进行表型差异分析,以及d8227矮秆基因的遗传分析和基因初步定位,从而确定d8227的利用价值,丰富矮秆种质资源库,从而为培育出产量高、抗倒伏的玉米品种奠定基础。
1 材料和方法
1.1 试验材料及来源
试验材料为矮秆d8227和dwarf-12,以及矮秆dm676、Na360、125d、123d,玉米高秆自交系CA345、DR894、ZNC442、F910,构建d8227×ZNC442、d8227×F910、DR894×d8227、CA345×d8227的F1、F2和BC1。矮秆自交系d8227是将dwarf-12和普通白玉米杂交得到矮秆玉米,经过多代回交和自交,得到稳定遗传的矮秆自交系,dwarf-12是由矮秆高粱和本地玉米通过多次远缘杂交,得到的矮秆材料,研究发现[16],dwarf-12的亲本矮秆高粱可能是当时美国流通较广的由dw3基因控制的矮秆高粱,与br2基因为等位基因,但试验没进行更深入的研究,由于其表型优良,因此重新组配选育出优良的矮秆材料d8227,进行更深入的研究。
1.2 试验设计
1.2.1 矮秆农艺性状调查 将d8227与亲本dwarf-12,分别种植8行,密度49 500株/hm2,行距0.75 m,宽5 m,一行10穴,去掉两边2行和头尾2穴,一共调查48株,在抽雄株高稳定后,调查株高、穗位高、叶夹角、叶长叶宽、茎节长度、叶面积等[17]性状(各性状具体测定方法参照国家普通玉米品种区域试验调查项目和标准),用t检验性状差异显著性。
1.2.2 石蜡切片细胞观察 种植d8227和矮秆dwarf-12,待其株高稳定后,取其穗上、穗位、穗下横切、纵切的茎节组织,取样后迅速放入FAA固定液中,采用石蜡切片方法[18],用显微镜观察并拍摄相同区域的图片,参照刘小锐等[19]、张选等[20]的测量叶片面积的方法,利用Image J软件测量相同区域细胞面积,一共测量40个,用t检验来进行比较。
1.2.3 矮秆d8227遗传模式分析 将d8227和F910、ZNC442、CR894、CA345分别杂交,其中和F910、ZNC442杂交是以d8227为母本,和CA345、CR894杂交是以8227为父本,在广西种植d8227和F910、ZNC442组配的F2群体,分别种植1 000~2 000株,在云南种植CA345、DR894和d8227杂交F2群体和构建的所有BC1群体,分别种植200~400株。成株后调查F2、BC1中高株和矮株株数,用卡方检验,计算其分离比率。由于双亲中有主效基因和微效基因,处于双亲中间的株高由微效基因控制,由于群体的不同,因此划分界限也不同,对于F2群体159 cm以下为矮秆,180 cm以上为高秆,回交群体以179 cm以下为矮秆,180 cm以上为高秆。
1.2.4 矮秆d8227基因初步定位
1.2.4.1 试验设计 将矮秆d8227和高秆玉米ZNC442杂交获得F1,F1自交得到F2,收种种植F2群体,并在玉米抽雄株高稳定时取叶片,取穗位以上较嫩叶片,取群体中的高株30株和矮株30株以及亲本,取样时利用液氮和干冰保存保证样本的新鲜,用CTAB法提取DNA[21],提取的DNA等摩尔浓度混合,构建子代混池。
1.2.4.2 DNA检测与建库 对提取的DNA进行检测。将8 g琼脂糖溶解在100 mL TBE中,加入适量的核酸染色剂。用0.8%琼脂糖凝胶电泳检测提取的DNA,验证DNA的纯度。
建库的主要步骤是采用TruSeq库构建工具包进行建库。DNA片段经末端修复、加polyA尾、加测序接头、纯化、PCR扩展等步骤,完成了文库的构建。文库构建完成后,首先用Qubit 2.0进行初步定量,稀释文库至1 ng/μL,其次用Agilent 2100检测文库的插入片段大小(Insert size)。插入片段大小达到期望后,通过Q-PCR方法准确定量文库的有效浓度 (文库有效浓度>2 nmol/L),来确保文库质量。库检合格后,根据有效浓度和目标下机数据量的需求对不同文库pooling,然后进行Illumina HiSeq TM PE150测序。
1.2.4.3 测序结果与参考基因组对比 利用FASTQ软件[22],对下机获得的Raw data原始数据进行过滤,去除里面带接头、低质量的read并得到Clean reads,后面分析均基于Clean reads。去除单端测序read中N含量超过此read长度比例的10%时和单端测序read中低质量(Q≪5)碱基数超过该条read长度比例的50%时的Paired reads。
根据BWA软件[23](参数:mem-t 4-k 32-M)将得到的有效测序数据(Clean data)比对到参考基因组上(B73-V4版本),其比对结果经SAMTOOLS去除重复(参数:rmdup)。
通过比对结果进行SNP的检测及注释,采用GATK软件[24]的Unified Genotyper模块检测多个样本SNP和InDel,利用VariantFiltration进行质控,参数为--clusterWindowSize 4,--filterExpression“OD<4.0‖MQ<40.0”,-G_filter“GQ<20”。SNP和InDel检测结果利用ANNOVAR进行注释。
1.2.4.4 子代SNP/InDel频率计算和基因候选区间分析 筛选2个亲本之间纯和差异的多态性,以亲本中筛选出来的多态性为基础,分析计算2个子代在多态位点的SNP-index(即SNP的频率)和InDel-index(即InDel的频率)。基于SNP和InDel标记,为了不忽略微效QTL的影响,在全基因组范围内,选择2个子代池中SNP、InDel差异大的位点作为候选位点。对计算出SNP-index后的多态性位点和子代混池缺失的位点进行过滤,以减小测序错误和比对错误造成的影响。选择95%置信水平作为筛选阈值,超过95%置信水平的窗口作为候选区间。当提取ANNOVAR的注释结果时,优先挑选引起停止减少、停止增加、非同义突变、可变剪接的位点所在的基因作为候选基因。
1.2.5 等位性鉴定
1.2.5.1 矮秆材料来源 125d矮秆材料是玉米地方种甘洛白,通过混合授粉实现基因重组,在改良群体中自然突变的矮秆植株;123d矮秆材料是北方自交系123自然突变矮秆株,再多代自交到纯合稳定;dm676矮秆材料是玉米自交系M676自然突变矮秆植株,再经过多代自交到纯合稳定;Na360矮秆材料是从墨西哥矮秆杂交种本雀-利比亚AN-360选出的自交系
1.2.5.2 d8227矮秆基因等位性鉴定 d8227与定位区间4个已知的矮秆材料构建F1、F2群体,种植群体待株高抽雄稳定后,调查F1、F2株高分离比率,用卡方检验,确定基因等位性关系。
2 结果与分析
2.1 d8227和dwarf-12表型鉴定差异分析
经过在大田种植矮秆材料,观察整个生育期,d8227和dwarf-12苗期株高基本一致,在抽雄前,d8227和dwarf-12株高出现差异,并一直持续到株高稳定后,它们的叶片数、叶夹角、株高、穗部性状如图1,可以观察到,d8227株高比dwarf-12高,d8227和dwarf-12叶片紧凑,穗位以下茎节明显缩短,叶片颜色深绿,果穗籽粒为硬粒型,偏小,白轴。

A.左为d8227的果穗,右为dwarf-12的果穗; B.散粉结束时的去叶茎秆:左为dwarf-12,右为d8227;C.散粉结束长果穗时的整株表型:左为dwarf-12,右为d8227;D.果穗籽粒大小:左为d8227,右为dwarf-12。A.On the left is the ear of d8227,on the right is an ear of dwarf-12;B.Remove the leaf stalk at the end of the powder:Left is the dwarf-12,right is d8227;C.The phenotype of the whole plant at the end of the spikelets:dwarf-12 on the left and d8227 on the right;D.The grain size of the ear:d8227 on the left and dwarf-12 on the right.图1 d8227和dwarf-12植株各性状比较Fig.1 Comparison character of dwarf d8227 and parent dwarf-12
对d8227和dwarf-12各个性状数据进行统计分析,结果如表1所示,d8227的株高为152.94 cm、穗位高为44.73 cm,dwarf-12株高为139.86 cm,穗位高为34.01 cm,d8227株高比亲本株高增加9.35%,穗位高增加31.50%,达到显著水平。d8227茎粗比dwarf-12减少7.49%,叶片减少2~3片,达到显著水平。d8227穗上、穗位、穗下叶面积要比dwarf-12减少 0.58%,3.01%,3.44%,没有达到显著水平。穗上叶夹角增加0.11%,穗位、穗下叶夹角减少2.41%,11.25%,只有穗下叶夹角达到显著水平。说明矮秆d8227和dwarf-12只有株高相差较大,整体性状差异较小,dwarf-12株型要更紧凑。矮秆d8227的穗质量、行粒数、百粒质量、穗长、粒深比dwarf-12增加52.21%,5.26%,23.76%,6.93%,12.02%,说明d8227的穗部经济性状要比dwarf-12优良。

表1 dwarf-12和d8227主要农艺性状和经济性状比较 Tab.1 Comparisons of the main agronomic and economic trait among the d8227 and dwarf-12
从表2可以看出,d8227的茎节数要比dwarf-12少,d8227和dwarf-12的茎节越靠近基部缩短越明显,穗下7节长度差异最大且达到显著水平,达54%;穗上13节差异最显著,达84%,除穗下第1节不显著以外,其他茎节长度差异都为显著,茎节长度差异集中在穗位以上。
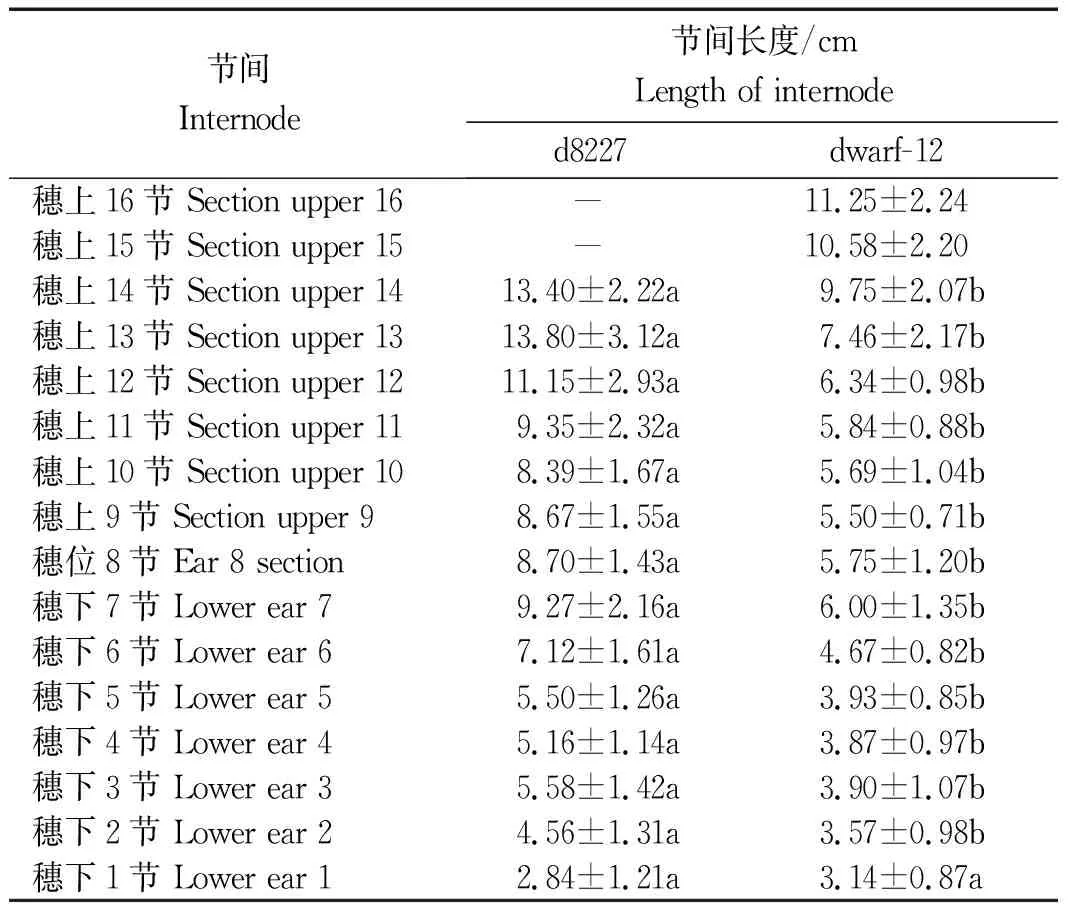
表2 矮秆d8227和dwarf-12茎节长度分析Tab.2 Analysis of stem node length of d8227 and dwarf-12
2.2 矮秆d8227和dwarf-12茎秆表皮细胞分析
图2为d8227穗上、穗下、穗位(A、B、C)和dwarf-12穗上、穗下、穗位(D、E、F)100×下相同区域的横切细胞特征,可以看出,d8227穗上、穗位、穗下的维管束逐渐减小,dwarf-12穗上维管束较小,穗位和穗下基本没变。图3为亲本矮秆d8227穗上、穗下、穗位(A、B、C)和dwarf-12穗上、穗下、穗位(D、E、F)40×下相同区域的纵切细胞,可以看出,d8227纵切细胞排列比较松散,并且细胞呈纵向伸长,dwarf-12细胞紧凑且呈横向伸长。结果分析如图4, 经过测量细胞面积,d8227在穗位、穗下的横切细胞要比矮秆dwarf-12细胞面积减少25.6%,25.6%,达到显著水平,在穗上细胞面积增加3.4%,没有达到显著水平。d8227穗上纵切面积比dwarf-12减少10%,没有达到显著水平,d8227的穗位、穗下细胞面积要比dwarf-12分别增加54%,56%,达到显著水平。
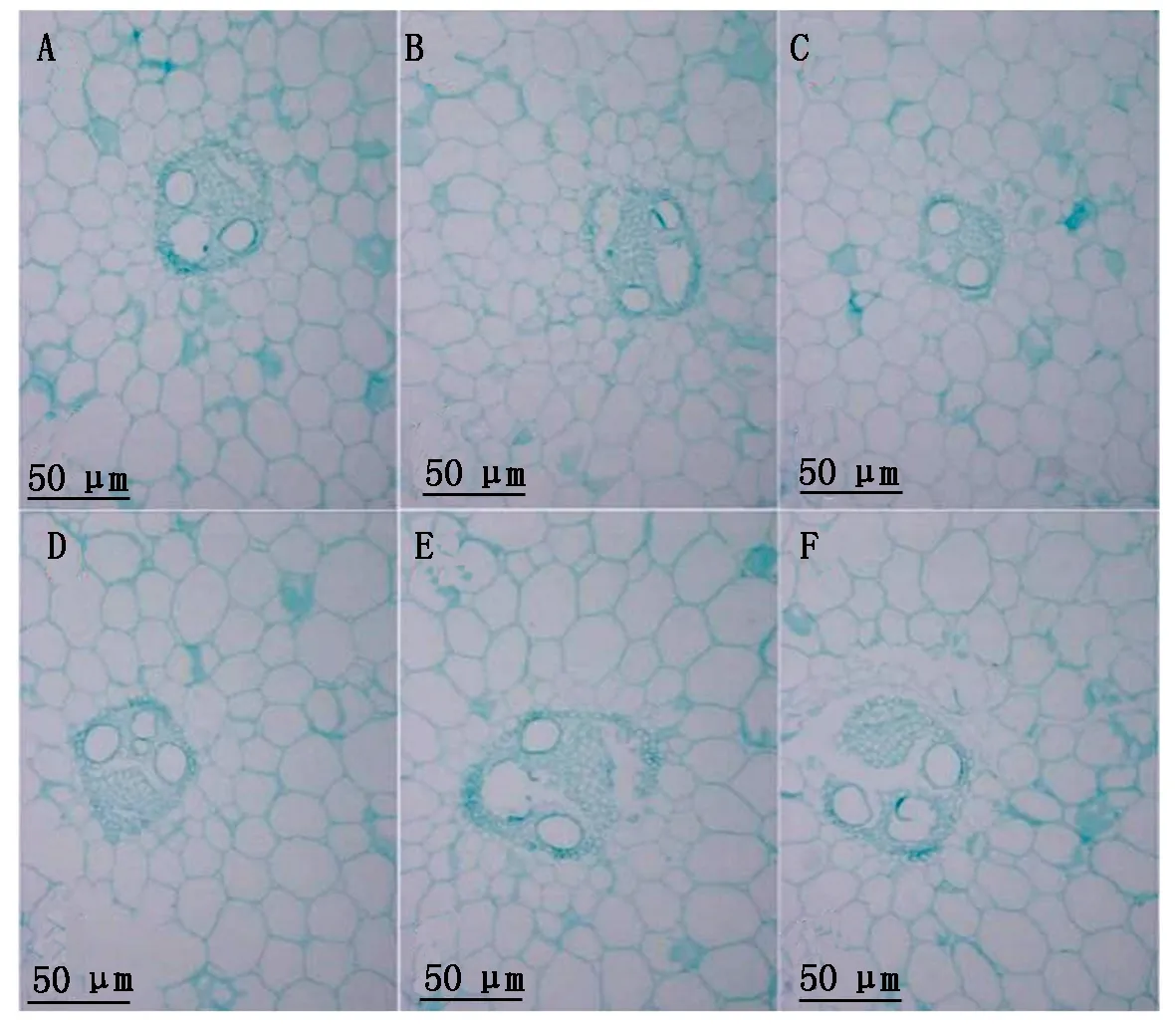
A—C.d8227穗上、穗位、穗下横切细胞图 (100×);D—F.dwarf-12穗上、穗位、穗下横切细胞图 (100×)。A—C.d8227 upper,ear and lower ear cross section cell map(100×);D—F.dwarf-12 cross-section cell map at the upper,ear,and lower ear(100×).图2 矮秆d8227和dwarf-12穗位、穗上、穗下节间横切细胞比较Fig.2 Comparison of the cross-cut cells at upper,ear and lower ear internode between dwarf d8227 and dwarf-12
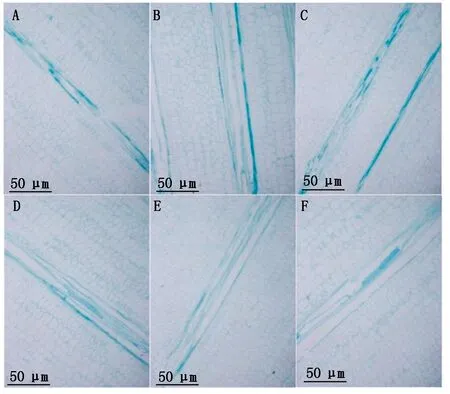
A—C.d8227穗上、穗位、穗下纵切细胞图 (40×);D—F.dwarf-12穗上、穗位、穗下纵切细胞图 (40×)。A—C.d8227 at the upper,ear,and lower ear,below the ear of the longitudinal cell map(40×);D—F.dwarf-12 at the upper,ear,and lower ear,below the ear longitudinal cell map(40×).图3 d8227和dwarf-12穗上、穗位、穗下节间纵切细胞比较Fig.3 Comparison of longitudinal section of internodes cell in the upper,ear and lower ear between dwarf d8227 and dwarf-12
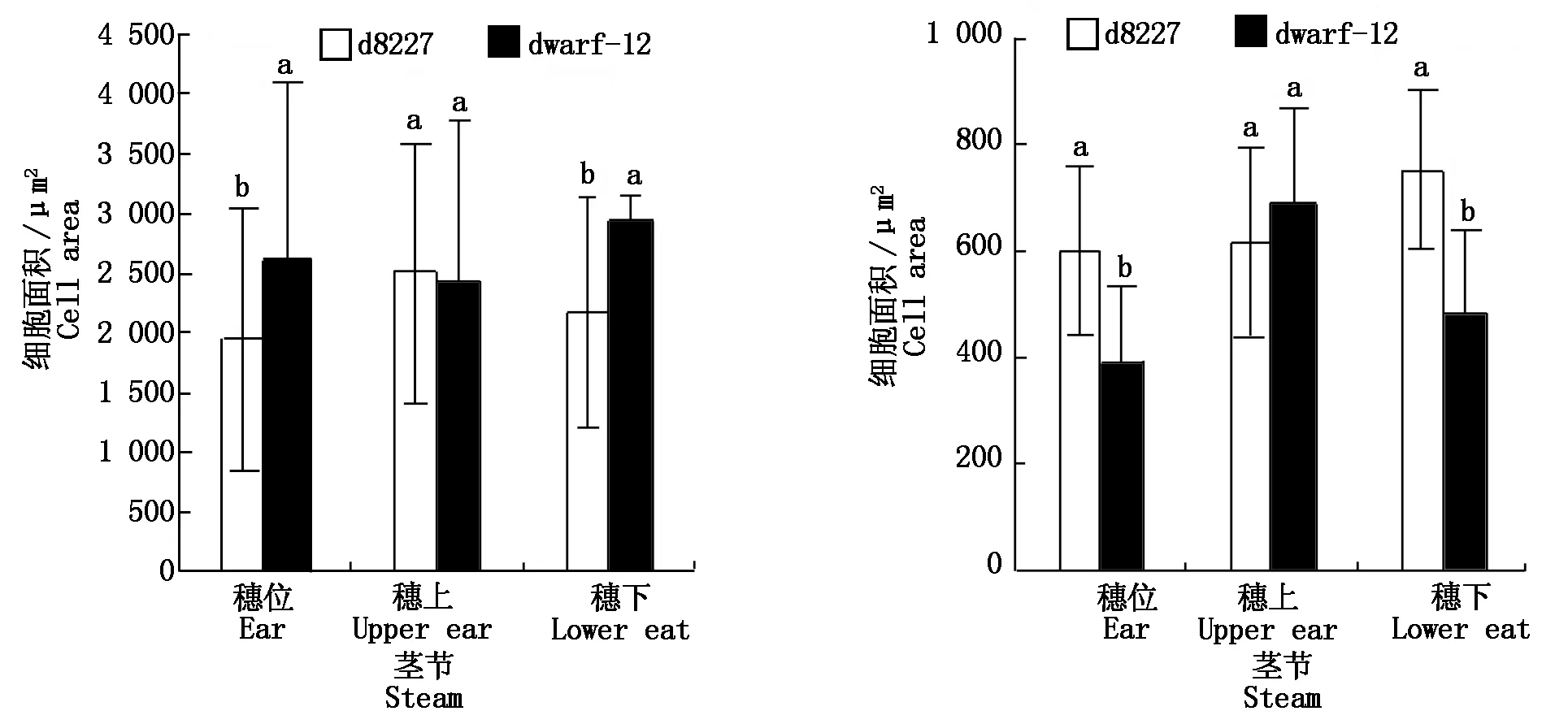
左图为细胞横切图,右图为细胞纵切图,a和b表示d8227和dwarf-12同一倍镜下的细胞面积存在显著差异。On the left is cell cross section,and on the right is cell longitudinal section,a and b indicate that there are significant differences in cell area between d8227 and dwarf-12 under the same magnification.图4 矮秆d8227、dwarf-12在穗位、穗上、穗下细胞面积Fig.4 Cell area of dwarf d8227 and dwarf-12 at the upper,ear and lower ear
综合结果来看,d8227穗位、穗下横切细胞面积相比dwarf-12显著减少,穗上横切面积和dwarf-12无显著差异,说明dwarf-12茎粗增加;纵切细胞d8227细胞纵向伸长明显,dwarf-12细胞紧凑且呈横向伸长,表明了d8227纵切细胞在穗上、穗位、穗下细胞面积增加主要是细胞纵向伸长的原因。总体来看,d8227和dwarf-12细胞伸长方式不同,也说明了株高的调控方式不同。
2.3 矮秆d8227遗传模式分析
d8227与4个测验种组配的F2以及回交群体株高,经过统计分离比率,结果如表3所示,回交群体分离比率,除了F910、DR894测验种,均符合1∶1的单基因遗传比率,F2株高分离比率,经过卡方检验,除了F910测验种,均符合3∶1的单基因遗传比率,初步推测d8227和F910、DR894组配的F2和回交群体不符合双峰,可能是由于株高较低,也有可能受遗传背景的影响,导致株高分离不显著。总体来看,该矮秆是由一个主效基因控制,排除株高由数量性状控制连续性分布,即由多基因控制的可能性较低。
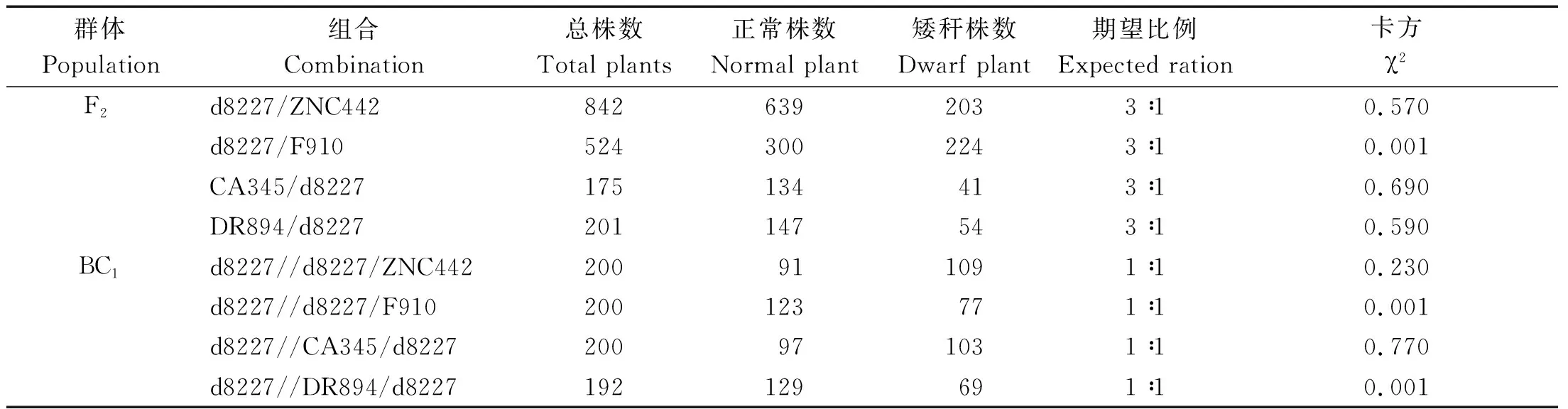
表3 回交群体和F2群体株高χ2检验Tab.3 Plant height χ2 test of backcross population and F2 population
2.4 BSA定位分析
2.4.1 混池测序质量情况 本次测序结果如表4所示,共产生Raw data 205.043 GB,过滤后为201.162 GB,各混池的Raw data 29 993.22~72 301.75 Mb,测序质量高(Q20(%)>96.28%,Q30(%)>90.15%),CG含量为46.41%~46.55%。综上,所有数据量足够,测序质量合格,GC分布正常,测序成功。
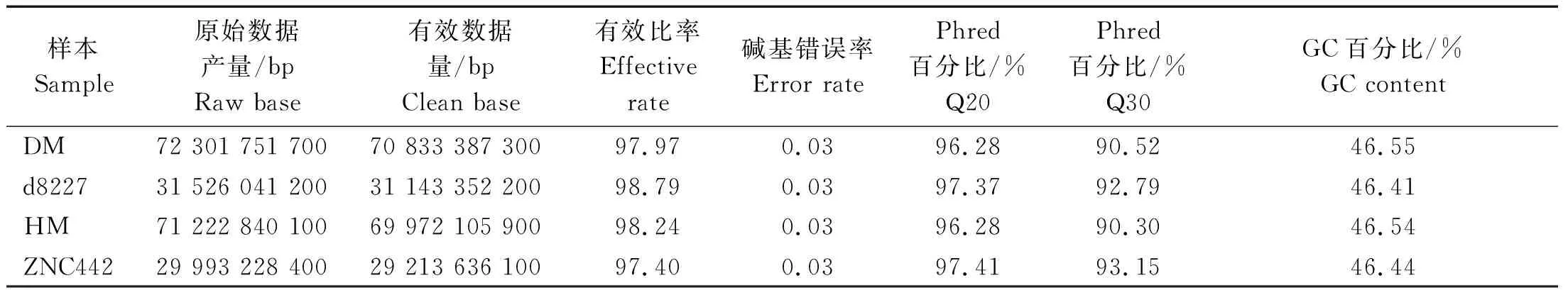
表4 测序数据质量汇总Tab.4 Summary of sequencing data quality
2.4.2 Reads与参考基因组比对情况统计根据BWA软件把有效测序数据对比到参考基因组上,然后将对比结果经过SAMTOOLS去除重复,参考基因组为B73-V4版本。经过对比结果如表5所示,亲本d8227、ZNC442平均测序深度为12.75×、12.23×,矮秆混池(DM)和高秆混池(HM)平均测序深度为27.70×和27.41×。

表 5 测序深度及覆盖度统计Tab.5 Sequencing depth and coverage statistics
2.4.3 SNP与InDel检测及注释结果统计 使用ANNOVAR对由多个基因组检测出的基因变异进行功能注释,与B73参考基因对比,结果如表6,7所示,总计得到6 180 863个SNP和870 214个InDel,其中外显子区域存在157 081个SNP变异位点,其中76 090为非同义突变,如表7,在外显子区域中29 176个为InDel变异位点,其中8 339个变异是由缺失或插入造成的。

表 6 SNP检测及结果Tab.6 SNP detection and result

表7 InDel检测及结果Tab.7 InDel detection and result
2.4.4 子代频率差异分布 筛选亲本之间具有多态性SNP位点,共挑选出1 908 082个标记,经过筛选得到过滤后的1 677 107的多态性标记位点,通过分析2个子代在亲本间1 677 107个标记位点的SNP的频率,并绘制染色体上SNP频率的分布图,以便直观地反映子代SNP-index在染色体上的分布情况。默认情况下,选择1 MB作为为窗口,1 kb作为步长。计算每个窗口的SNP-index的平均值,以反映子代的SNP的频率分布。
将2个子代的SNP-index和InDel-index作差,即Δ(SNP-index)和Δ(InDel-index)= SNP-index/InDel-index(极端性状B)-SNP-index/InDel-index(极端性状A)。将子代之间的SNP-index和InDel-index合并后的All-index在染色体上的分布作图,以便直观地反映变异位点在染色体上的分布情况。在进行1000次置换检验后,选取95%(蓝色)的置信水平,作为筛选阈值。从图5可以看出,Δ(SNP-index)、Δ(InDel-index)、Δ(All-index)结果一致,都位于1号染色体。
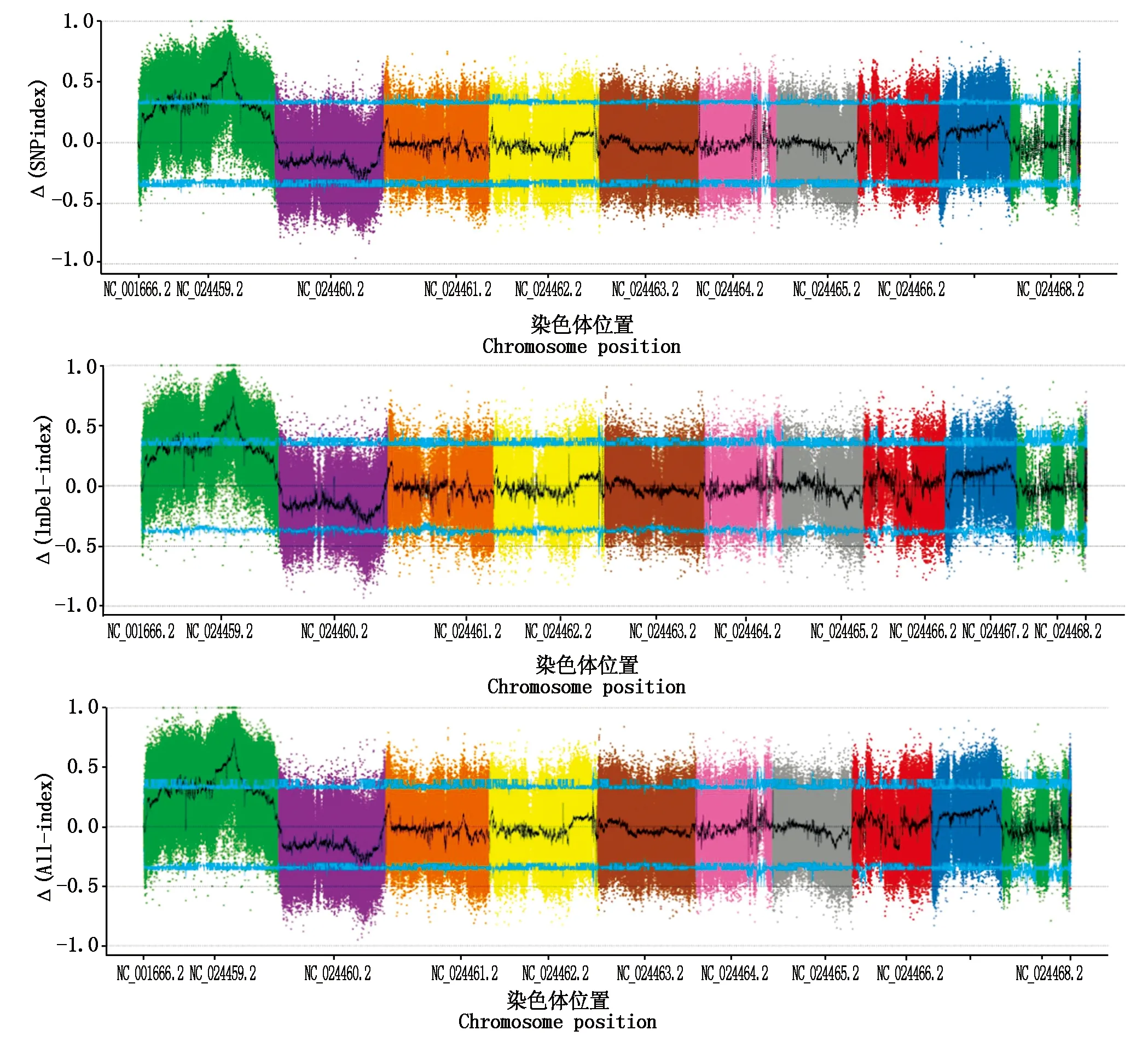
NC_024459.2~NC_024468.2.染色体1号~染色体10号。NC_024459.2—NC_024468.2.Chromosome 1—chromosome 10,respectively.图 5 2个子代的Δ(SNP-index)、Δ(InDel-index)、Δ(All-index)在染色体上的分布Fig.5 Distribution of two progeny Δ(SNP-index),Δ(InDel-index),Δ(All-index)on chromosome
2.4.5 基于SNP和InDel标记的矮秆基因区域初步定位 以InDel标记和SNP标记为基础,经过子代SNP-index作差分别得到Δ(InDel-index)和Δ(SNP-index),选择95%的置信水平,大于阈值的窗口作为候选区间。从图6可以看出,左图为Δ(InDel-index),右图为Δ(SNP-index),两者高于置信水平的区间均位于1号染色体190~215 Mb,物理距离为25 Mb。为了不忽略微效QTL的影响,在全基因组范围内选择候选SNP和InDel时,如果参考亲本和子代相同,就挑选子代池中All-index接近0的位点;如果参考基因和子代表型相反,就挑选All-index接近1的位点。选取子代差异显著的位点,共选出2 088个SNP候选位点,702 585个InDel候选位点,优先挑选引起stop loss、stop gain、非同义突变、可变剪接的位点所在的基因作为候选基因,以此作为ANNOVAR的注释结果。筛选后有176个SNP位点,190个InDel位点,由于定位区间在1号染色体190~215 Mb,在此区间一共有107个SNP位点,128个InDel位点,在maize GDB官网以B73-V4为版本查找到相关22个候选基因,在NCBI、KEGG官网查询基因功能,结果如表8所示。
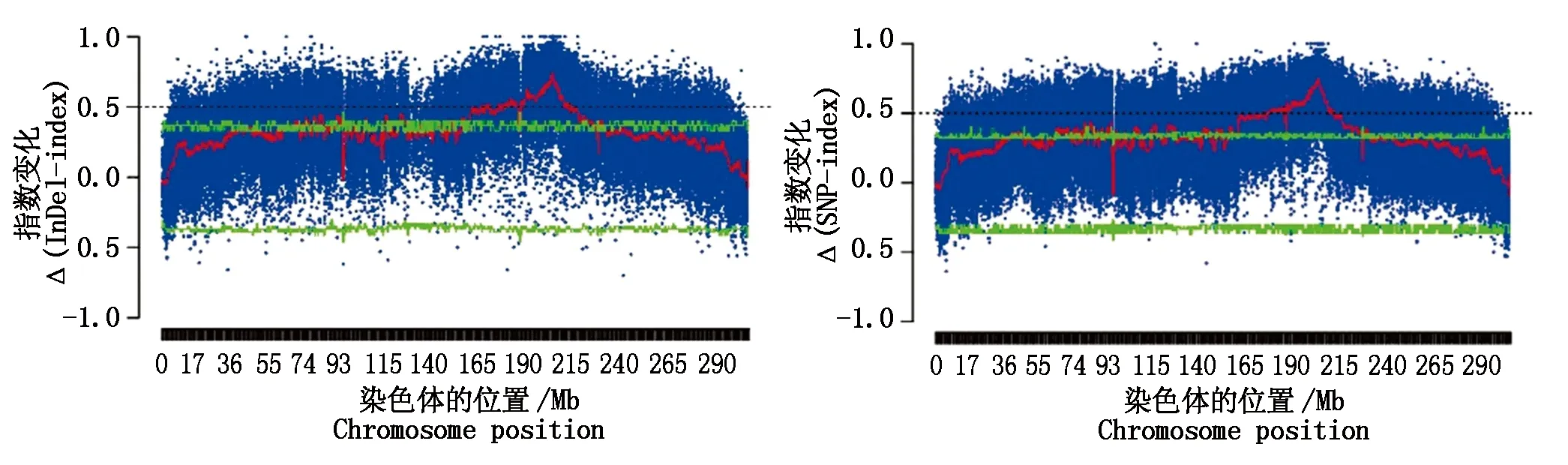
图6 2个子代Δ(InDel-index)和Δ(SNP-index)有显著差异的染色体Fig.6 Chromosomes with significantly different Δ(InDel-index) and Δ(SNP-index) between the two offspring
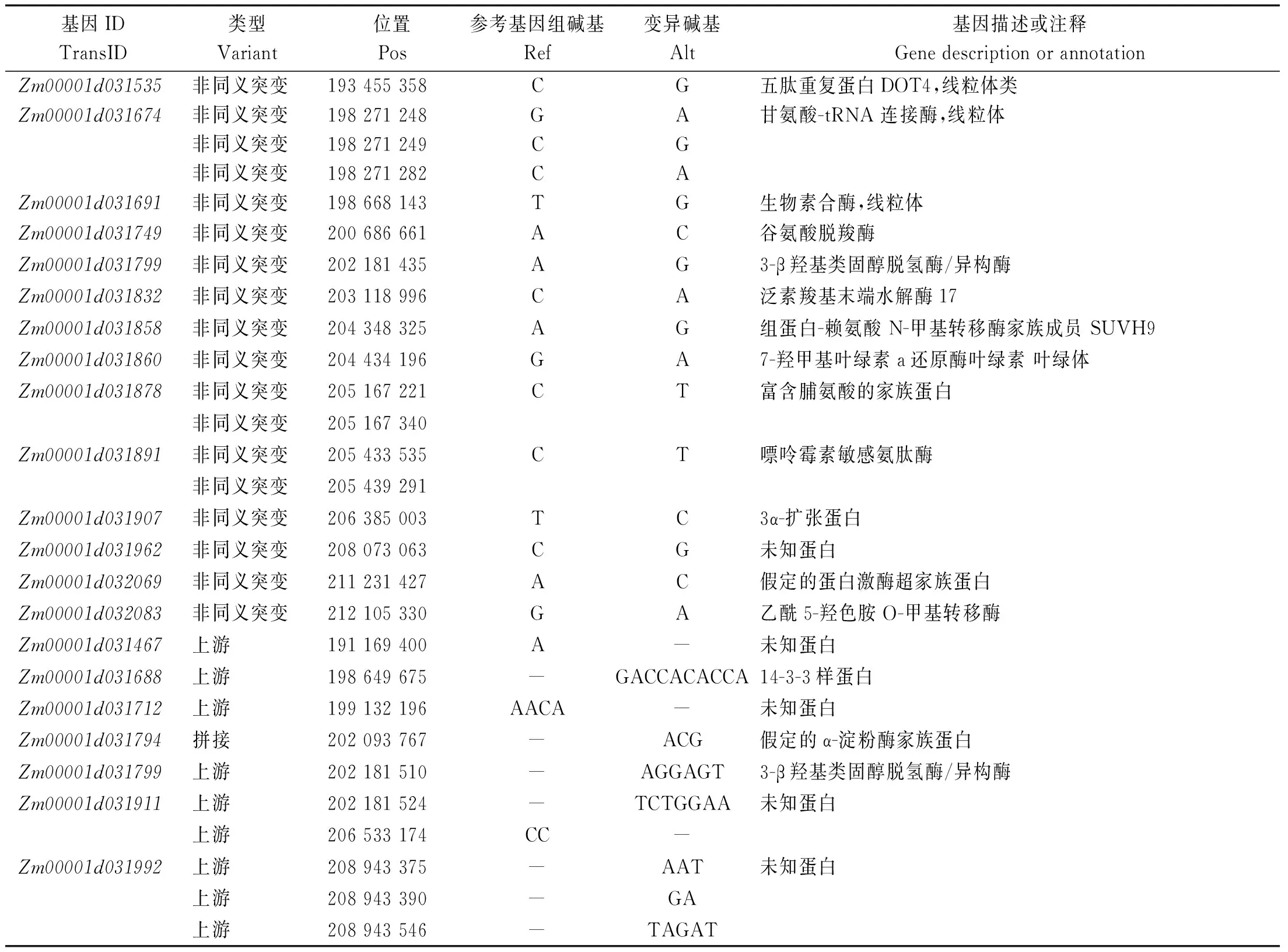
表8 候选基因Tab.8 Candidate gene
2.5 矮秆等位性鉴定分析
d8227和4个矮秆杂交得到F1,通过分析F1和亲本之间的株高、穗位高,结果如表9所示,矮秆d8227与125d、123d、Na360杂交得到的F1株高、穗位高与亲本都达到了显著水平,但d8227和125d、dm676组配的F1株高较低。通过在雅安和云南2个地点种植4个F2群体,株高分布图如图7所示,d8227和123d的F2为2个峰值,其余F2群体都为一个峰值,通过卡方检验,如表10,d8227和123d的F2群体2个峰值在云南符合 9∶7的比例,在雅安不符合遗传比例,说明株高受到环境的影响较大。123d和d8227的F2群体矮秆和高秆界限根据亲本高度划分矮秆为150 cm以下,高秆为170 cm以上。根据在雅安株高分离比例可以判断123d与d8227不为等位基因,d8227与125d、Na360、dm676杂交F2群体株高只有一个峰值,但Na360和d8227杂交F2群体高于双亲的植株较多,因此,可以排除为等位基因的可能,但是不能说明dm676、125d和d8227不是等位基因,其亲本之间表型性状差异也较大,需要后续进一步的精细定位来确定。
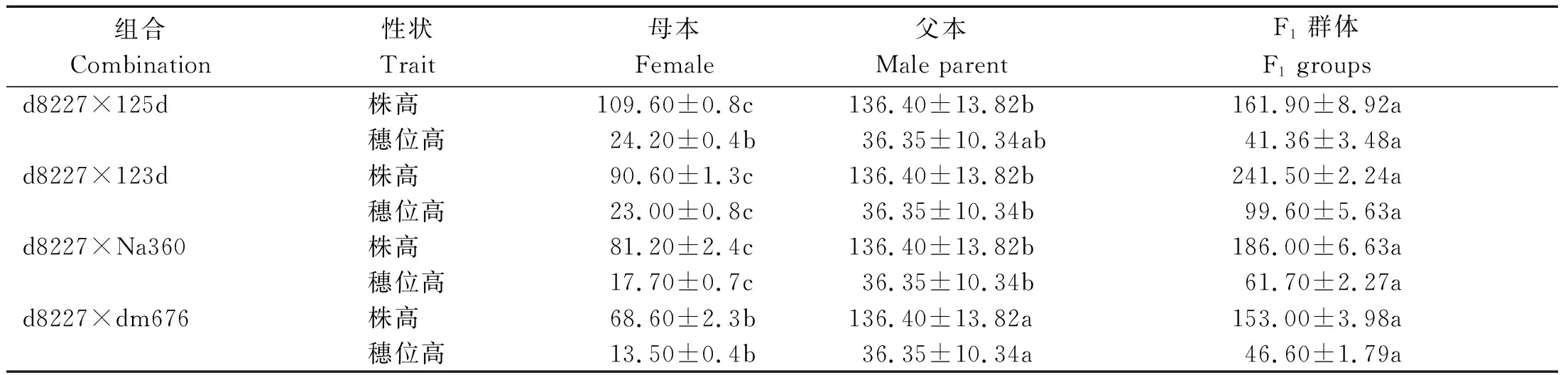
表9 双亲及子代F1株高与穗位高比较Tab.9 Comparison of plant height and ear height of parents and progeny F1 cm
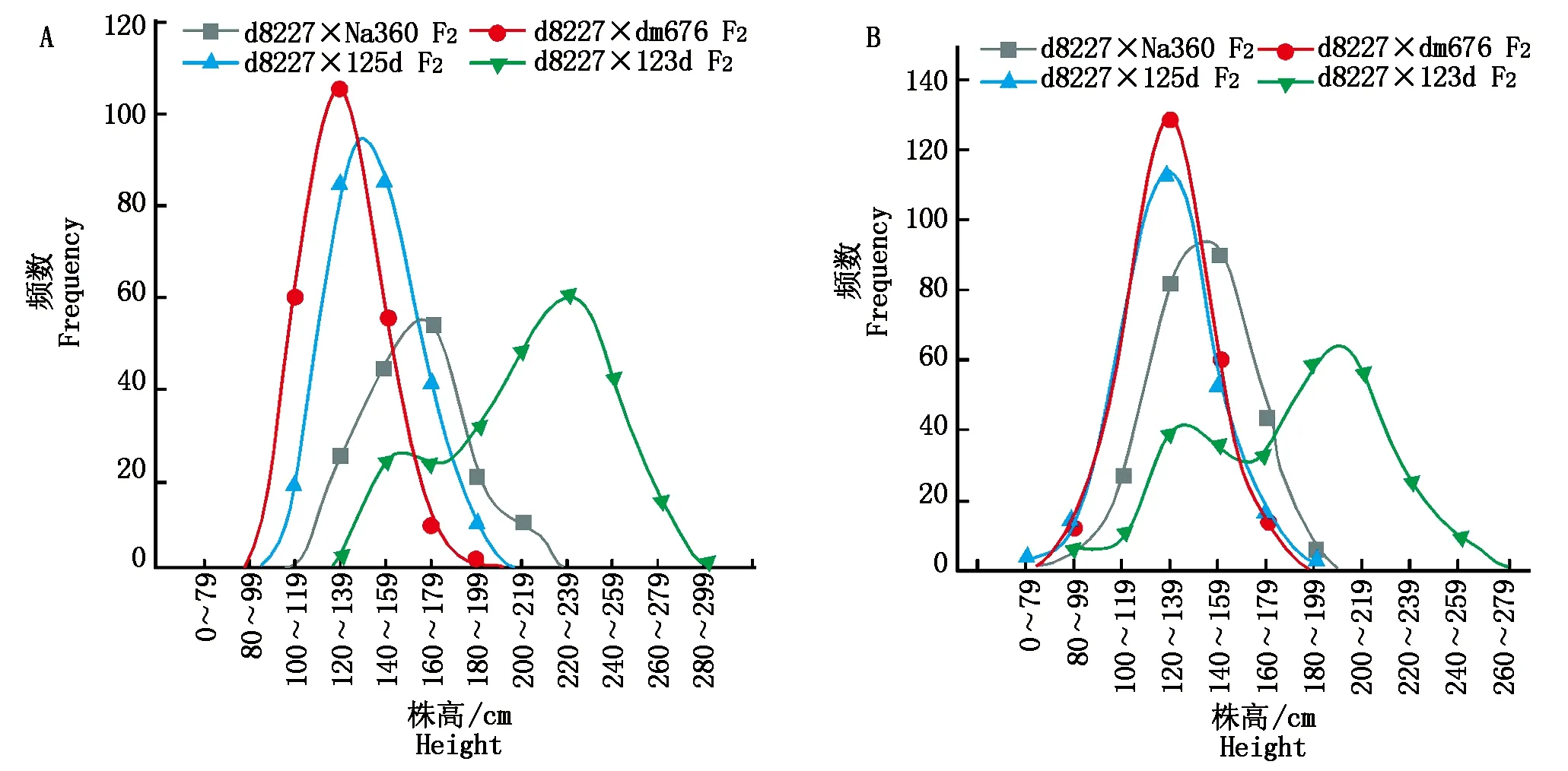
A.在雅安种植F2群体;B.在云南种植的F2群体。A.F2 population grown in Ya'an;B.F2 population grown in Yunnan.图7 矮秆d8227等位性鉴定F2株高分布Fig.7 High distribution of F2 strains identified by the allele of dwarf stalk d8227

表10 等位鉴定卡方检验Tab.10 Chi-square test for allelic identification
3 结论与讨论
3.1 矮秆d8227和 dwarf-12表型特征分析
目前,发现的矮秆玉米大多为单基因,但单基因大多会连锁不良性状,如显性矮秆玉米D*-10株高极度矮化,茎秆扭曲,花器官发育异常,不能够正常授粉[12],隐性单基因控制的矮秆dm676,叶片重叠,授粉困难,造成结实率低,因此,要选取有利性状的矮秆基因,构建合理株型,提高群体光合利用率,才能达到提高作物产量的目的。
本试验矮秆玉米d8227株高适宜,属于中等矮秆,矮秆d8227株高、穗位高比dwarf-12增加9.35%,31.5%,d8227株高增加是由于茎节长度的增加,观察矮秆株高发育动态,生长前期未出现变化,在抽雄前期亲本dwarf-12和d8227的株高开始出现差异,一直到抽雄结束株高稳定,差异达到最大。这也表明了两者节间长度的调控方式有所不同,前人研究表明,当遗传背景不同也会导致基因表型不同,即使含有相同矮生主基因,其株高也不相同,其表型也会相差极大,其原因是在主效基因起作用的同时,一些修饰基因也会对株高起到一定的作用,如前人研究的同属br2基因,其表型差异也相差较大;这也可能与基因在植物体内不同的剪切方式有关,可变剪切是转录后加工的过程,这种机制在植物体内普遍存在,研究证明,这些剪切体可能会改变蛋白序列,影响蛋白质功能,能够参与生物重要的调控进程[25-26],如前人通过对比br2等位基因变异的br2-114F和br2-117A、d2004,在植株早期发育形态,br2-114F极度矮化,br2-117A次之,但突变体d2004比较温和,不同的br2等位变异具有不同的突变效应,这与br2的可变剪切密不可分。对d8227穗部经济性性状分析,果穗性状的穗质量、行粒数、百粒质量、穗长、粒深都比dwarf-12增加,这也说明了d8227矮秆材料经济性状良好,虽然dwarf-12叶片数增加,但穗位以下茎节缩短显著,这会导致叶片重叠,减少叶片的透光率和光合作用,导致2个矮秆之间果穗性状产生差异。总体来看,矮秆d8227株高中等高度,穗位以下缩短明显,具有抗倒伏的优点,并且穗部性状优良,配合力良好,可以进行组配,从而选育出株高中等,产量好的矮秆品种,从而提高材料综合利用价值。
3.2 茎秆组织特征和矮化的关系
玉米株高是由茎节数和茎节长度决定,引起矮秆的直接原因是矮秆基因导致植株表型和细胞学产生变化,从表型上来看,矮秆会导致茎秆数目减少和茎节长度缩短;从细胞学来看,矮秆是由于茎节间细胞数目减少或单个细胞长度缩短。如王文秀等[27]通过诱变郑58自交系获得的矮秆突变体,发现矮秆株高降低是由于细胞缩短和细胞数目增加,王宇宇[28]发现的矮秆突变体,是由于穗位以下茎节缩短和细胞长度减少,导致细胞数目增加,株高出现矮化。
在本研究中d8227和dwarf-12的矮化机理可能存在差异。前人研究表明,植物激素调控植物生长发育过程,如植物种子萌发、茎的伸长和叶片的生长等,矮秆dwarf-12和d8227的矮化机理可能与植物激素合成、运输以及信号传导有关。通过观察茎秆细胞组织,dwarf-12株高比d8227矮是由于穗上、穗位、穗下纵切细胞伸长被抑制导致茎节长度缩短,dwarf-12的矮化机理和李启芳[29]研究的矮秆52333Dt矮化机理相同,都是细胞伸长受到抑制,但和王宇宇[28]研究的矮秆结果不同,王宇宇研究矮秆材料穗位以下细胞长度明显缩短,穗位以上细胞长度和野生型相比无明显变化。在本研究中d8227和dwarf-12的矮化机理可能存在差异。前人研究表明,植物激素调控植物生长发育过程,如植物种子萌发、茎的伸长和叶片的生长等,矮秆dwarf-12和d8227的矮化机理可能与植物激素合成、运输以及信号传导有关。
3.3 矮秆d8227基因初步定位和等位性鉴定
通过构建定位群体,通过对矮秆d8227的遗传分析,判断为隐性主基因控制,从而也验证了本课题组前期利用主效基因+多基因模型得出的至少有1对主效基因或2对主效基因[30]。d8227的矮秆基因初步定位于1号染色体190~215 Mb,有25 Mb长度,在此区间已经定位的矮秆有br2、br1、123d、125d、Na360、dm676,它们的突变体都具有株高变矮,节间缩短,叶宽的特点。其中123d是br2相同突变类型,在第4个外显子的编码的氨基酸替换,对赤霉素敏感[31],Na360是含有br2基因的,经过在maizeGDB网站查询,控制br2基因名称为Zm0001d031871,在204 745 698~204 758 247 bp,在d8227测序得到的候选基因中,不含控制br2的基因,d8227与含有br2基因矮秆材料Na360杂交F1、F2中超亲的植株较多, d8227与123d的F1株高极显著高于双亲,并且F2群体符合9∶7的分离比率,因此可以初步排除d8227与123d、Na360为等位基因。以br2基因模型GRMZM2G315375克隆发现125d矮秆材料在br2基因1 651个碱基处有一个9 bp片段的插入,在6 438个碱基处有一个232 bp片段的缺失,缺失导致移码突变,造成功能位点缺失[32],导致矮秆表型。经过等位性鉴定,F1、F2群体株高偏矮的植株较多,F2群体只有一个峰值,没有表现超亲植株,不能排除等位基因的可能。矮秆材料dm676初步定位于1号染色体分子标记umc2396和umc1356,物理位置在bin1.07位置,组配的F1、F2群体株高较矮,并且F2株高为一个峰,不能排除等位基因的可能。但由于dm676、125d和d8227表型差异较大,因此需要后续一系列试验,如候选基因分子学遗传验证(克隆、表达量比较)以及精细定位,才能推断出d8227与dm676、125d为等位基因,还是一个新的矮秆基因。
3.4 d8227的育种应用前景
大多发现的矮秆玉米由于组合配合力产量较低,未能在育种中进行推广应用,如br1、br3、br8等矮秆材料,刘宗华等[33]在矮秆玉米资源研究中理想的矮秆资源是即可以降低杂交种的株高,又可以提高增产的潜力。因此,发掘和寻找既能降低株高,又对产量无明显影响的矮秆材料,有利于促进矮化育种的发展[34-35]。本试验材料株高中等矮度,叶片较宽,颜色较深,叶夹角也较小,株高配合力效应为-2.77,单株产量配合力效应为21.84,综合产量性状配合力良好[30],具有较好的育种潜,矮秆d8227可以通过杂交自交重组,聚合矮生基因或者其他优良基因,选育新的综合性状优良的抗倒的矮生系。
