基于谱效关系的畲药树参茎抑制人滑膜关节炎成纤维细胞异常增殖的药效物质研究
2023-05-14张晓芹黄绳武陈张金陈琴鸣陈桂云
刘 敏,余 乐,范 蕾,张晓芹,黄绳武,陈 梦,陈张金,陈琴鸣,陈桂云
(1丽水市质量检验检测研究院·浙江 丽水 323000;2丽水市中医院·浙江 丽水 323000;3浙江中医药大学·浙江 杭州 310053)
树参为五加科树参属树参Dendropanaxdentiger(Harms) Merr.的灌木或乔木,用药历史悠久,具有祛风除湿、活血消肿的功效,可用于治疗风湿病、关节炎、半身不遂等疾病,是我国江浙一带民间使用频率较高的30种畲药之一[1-3],其药用部位包括根、茎、皮,目前药效物质基础研究的薄弱是制约树参临床推广应用的关键因素之一。现有研究表明,滑膜增生是人类风湿性关节炎病理过程中的一个重要特征[4],急、慢性滑膜炎症也同样存在于关节炎患者中,而滑膜成纤维细胞是血管翳交界处最常见的细胞类型,在类风湿性关节炎的发生、发展中发挥重要作用[5]。为探究树参抑制滑膜成纤维细胞异常增殖作用及其药效物质基础,项目组制备了树参主要药用部位茎的纯水、氯仿、乙醚、乙酸乙酯、正丁醇、不同浓度乙醇等溶剂提取物,对TNF-α诱导的HFLS-OA增殖抑制作用开展了研究,同时采用高效液相色谱法建立了上述提取物的指纹图谱,采用偏最小二乘回归法(PLSR)和灰色关联度法(GRA)联合分析色谱峰与抑制HFLS-OA异常增殖作用的关系,揭示了树参茎抑制HFLS-OA异常增殖作用的药效物质基础,在细胞水平上探讨该畲药抗炎的作用,为该品种进一步的开发应用奠定了基础。
1 材料
1.1 细胞 HFLS-OA(3代):购自北京沿程科技有限公司。
1.2 药品和试剂 树参茎制备提取物用样品由12批样品等量混合而成,12批样品经李建良主任中药师鉴定为五加科科植物树参Dendropanaxdentiger。12批样品具体信息见表1。紫丁香苷对照品(111574-201605,含量为95.2%)、绿原酸对照品(110753-201716,含量为99.3%)、芦丁对照品(100080-201409,含量为91.9%)、异绿原酸A对照品(111782-201706,含量为97.3%):中国食品药品检定研究院;异绿原酸B对照品(102776,含量≥95%)、异绿原酸C对照品(102317,含量≥95%)、Saikolignanoside A对照品(103203,含量≥95%):江苏永健医药科技有限公司;芥子醛葡萄糖苷对照品(DST210311-292,含量≥95%):德思特生物技术有限公司;松柏醇对照品(wkq20052602,含量≥98%):四川省维克奇生物科技有限公司。

表1 树参茎样品信息表
甲氨蝶呤注射液(MTX,批号:DL6898,规格:2 mL∶50mg):Pfizer(Perth)Pty Limited;TNF-α:南京金斯瑞生物科技有限公司;乙腈、甲酸、四氢呋喃为色谱纯;氯仿、石油醚、乙醚、乙酸乙酯、正丁醇、甲醇为分析纯;水为哇哈哈纯净水;高糖培养基(DMEM)、澳洲优级胎牛血清(FBS)、二甲基亚砜(DMSO):美国Gibco公司;噻唑蓝试剂(MTT):美国Amresco公司;双抗(青霉素-链霉素100X):上海源培生物科技股份有限公司;胰蛋白酶(EDTA):吉诺生物医药技术有限公司。
1.3 仪器 1260型高效液相色谱仪:美国安捷伦公司;XS105DU型电子天平:瑞士梅特勒公司;IX71型荧光倒置显微镜:奥林巴斯;MK3型酶标仪:赛默飞世尔科技公司;3111型二氧化碳培养箱:赛默飞世尔科技公司;TC20型细胞计数器:美国伯乐公司。
2 方法与结果
2.1 不同提取物指纹图谱的建立[6]
2.1.1 色谱条件 色谱柱为sunfire TM C18(4.6 mm×250 mm,5μm),流动相为乙腈(A)-混合水溶液(含甲酸为0.2%和四氢呋喃0.2%)(B),梯度洗脱:0~5 min,4%~9%A;5~35 min,9%~14%A;35~50 min,14%A;50~60 min,14%~20%A,60~80 min,20%~30% A。检测波长为256 nm,柱温30 ℃,体积流量为1.0 mL·mim-1,分析时间为80 min,进样量为5μL。
2.1.2 供试品溶液的制备 取干燥过2 号筛树参茎粉末(12批样品等量混合)100 g,用10倍量纯水加热回流提取3次,每次2 h,合并提取液,减压浓缩后置于减压干燥箱内烘干,即得水提取物(S1);称取干燥过2号筛树参茎粉末(12批样品等量混合)5份,每份300 g,分别以8倍量20%、40%、60%、80%、100%乙醇为溶剂加热回流提取3次,每次2 h,合并提取液,减压浓缩至无醇味,置于减压干燥箱内烘干,即得相应浓度乙醇提取物(分别为S2~S6);80%乙醇提取后的药材粉末加入10倍量的纯水,加热回流提取3次,每次2 h,合并提取液,减压浓缩后置于减压干燥箱内烘干,即得醇提后水提取物(S8);称取80%乙醇提取物5 g混悬于50 mL水中,转移到分液漏斗中,依次加入氯仿、乙醚、乙酸乙酯、正丁醇萃取,各重复3次,分别收集萃取所得成分至蒸发皿中减压干燥得相应溶剂提取物(分别为S9、S10、S11、S7)。称取上述相当于原药材5 g的提取物,用提取溶剂溶解并定容至5 mL容量瓶中,过滤,即得供试品溶液。
2.1.3 对照溶液的制备 分别精密称取标准物质适量至10 mL容量瓶中,加甲醇溶解并定容制成每1 mL含紫丁香苷为618.0 mg·L-1、绿原酸621.0 mg·L-1、芥子醛葡萄糖苷361.0 mg·L-1、松柏醇579.0 mg· L-1、Saikolignanoside A 400.0 mg·L-1、芦丁402.7 mg·L-1、异绿原酸A 554.0 mg·L-1、异绿原酸B 572.0 mg· L-1、异绿原酸C 506.0 mg·L-1的标准物质储备液。再分别精密移取上述标准物质储备溶液1.5、1、0.5、0.2、0.2、0.2、1、1、1 mL于同一15 mL容量瓶中,加甲醇定容至刻度即得混合对照品溶液。
2.1.4 方法学考察 以提取最费时的正丁醇提取物为考察样品,以分离度较好、保留时间适中的绿原酸为参照,进行精密度、重复性、稳定性考察。
2.1.4.1 精密度考察 取按“2.1.2”项下方法制备的正丁醇提取物供试品溶液,连续进样6次,记录色谱图,相对保留时间的RSD为0.07%~0.23%,相对峰面积的RSD为0.15%~2.96%,结果表明各共有指纹峰的相对保留时间和相对峰面积基本一致,测定结果精密度较好。
2.1.4.2 重复性试验 按“2.1.2”项下的方法同时制备6份正丁醇提取物供试品溶液,分别进样,记录色谱图,相对保留时间的RSD范围为0.07%~0.27%,相对峰面积的RSD范围为1.85%~4.67%,结果表明重复性较好。
2.1.4.3 稳定性试验 取按“2.1.2”项下方法制备正丁醇提取物供试品溶液,分别在0、2、6、12、24、48 h进样,记录色谱图,相对保留时间的RSD范围为0.06%~0.41%,相对峰面积的RSD范围为0.62%~2.91%。结果表明样品在48 h内基本稳定。
2.1.5 供试品的测定 取供试品溶液5 μL,按“2.1.1”项下条件进样分析,比较11 个提取部位的色谱峰,确定34 个明显特征峰,记录相应峰面积,根据树参茎化学成分鉴定结果,采用对照品比对法对9个成分进行了指认,结果见图1~图2。
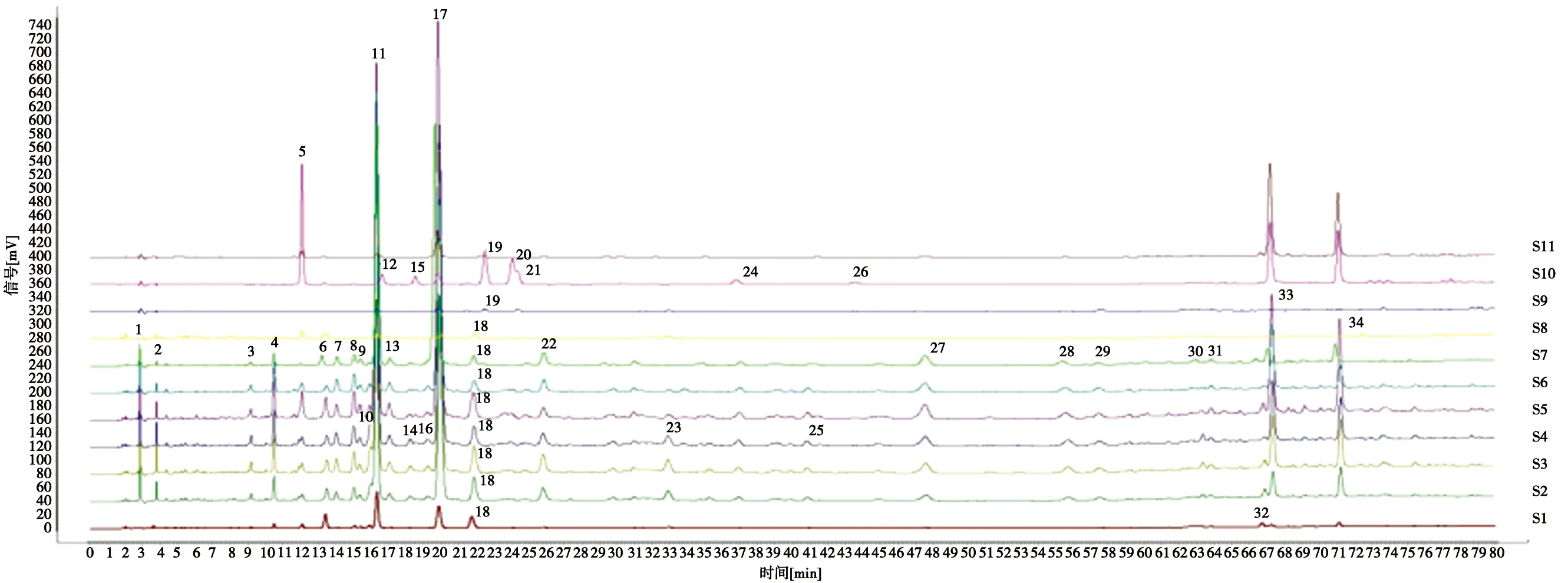
S1.水提取物; S2.20%乙醇提取物; S3.40%乙醇提取物; S4.60%乙醇提取物; S5.80%乙醇提取物; S6.100%乙醇提取物;S7.正丁醇提取物;S8.醇提后水提取物; S9.氯仿提取物; S10.乙醚提取物; S11.乙酸乙酯提取物
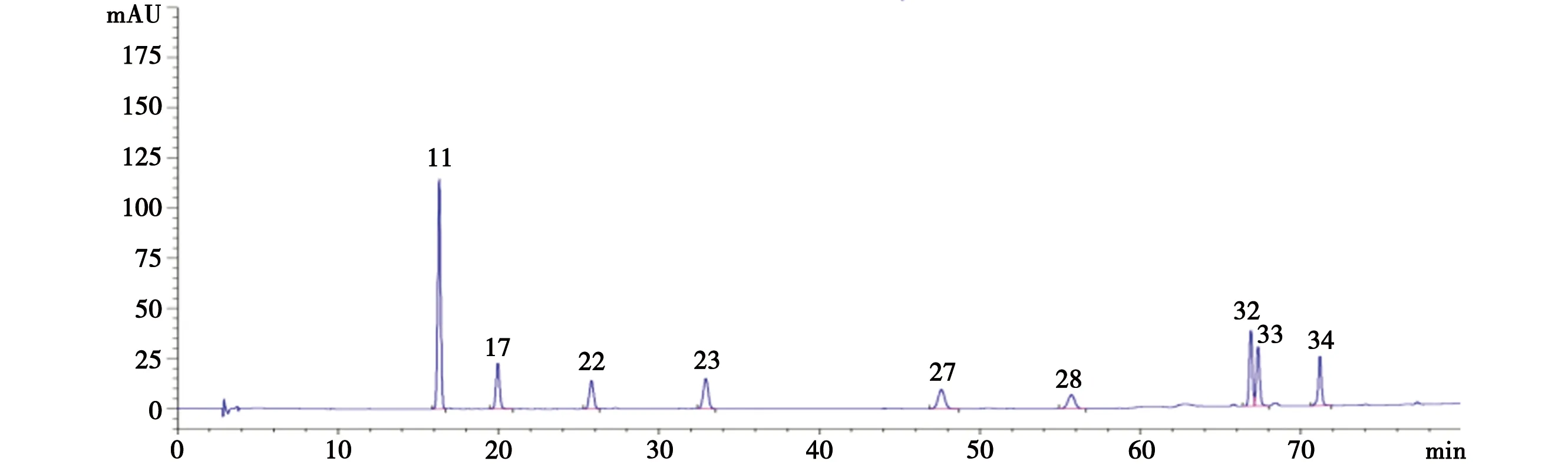
11.紫丁香苷;17.绿原酸;22.芥子醛葡萄糖苷;23.松柏醇;27.Saikolignanoside A;28.芦丁;32.3,4-O-二咖啡酰基奎宁酸; 33.3,5-O-二咖啡酰基奎宁酸;34.4,5-O-二咖啡酰基奎宁酸
2.2 不同提取物对HFLS-OA异常增殖的抑制作用[7]
2.2.1 细胞培养 HFLS-OA细胞放入含10%胎牛血清和1%双抗的DMEM培养基中,置37 ℃、5%CO2培养箱中静置培养,待细胞长至80%~90%时进行传代,接种于培养瓶或培养板中进行培养。
2.2.2 造模及分组 用TNF-α刺激HFLS-OA细胞造模。将细胞分为空白组(DMEM培养液),模型组(加入终质量浓度为10μg·L-1的TNF-α溶液);阳性甲氨蝶呤组(MTX,加入终质量浓度为20 mg·L-1与10 μg·L-1TNF-α溶液的混合溶液);树参茎不同提取物组(S1~S11,加入终质量浓度为31.25 g·L-1的提取物溶液与10 μg·L-1TNF-α溶液的混合溶液)。
2.2.3 细胞增殖抑制实验 采用MTT法测定细胞增殖活性。取对数生长期细胞,用含0.25%EDTA的胰酶消化,800 r·min-1离心5 min后,接种于96孔培养板中,每孔100 μL。用一次性吸管吹打混匀成单细胞悬液,置37 ℃、5%CO2培养箱中培养至细胞融合80%后按“2.2.2”项下的分组给药。每孔100 μL,每个浓度设置6个复孔,培养24 h后,每孔加入MTT溶液20μL,37 ℃孵育4 h后,采用酶标仪于490 nm处测定各孔吸光度值(A),计算细胞增殖抑制率。细胞增殖抑制率(%)=(TNF-α模型组A值-药物组A值)/TNF-α模型组A值×100%,重复3 次。
2.2.5 细胞增殖抑制实验结果 与空白组比较,TNF-α模型组细胞明显增殖(P<0.01);与模型组比较,除S8醇提后水提取物外,各给药组细胞的增殖均收到明显抑制(P<0.05);树参茎各提取物相对20 mg· L-1阳性MTX组均有显著性差异,S1、S2、S3、S4、S7的HFLS-OA增殖抑制率较高,范围为41.9%~42.9%,且相互之间无显著性差异;同等条件下,次之的是S5、S6、S9、S10,HFLS-OA增殖抑制率范围为37.8%~39.6%,S11的HFLS-OA增殖抑制率为32.3%,S8则无明显抑制作用。结果见图3。
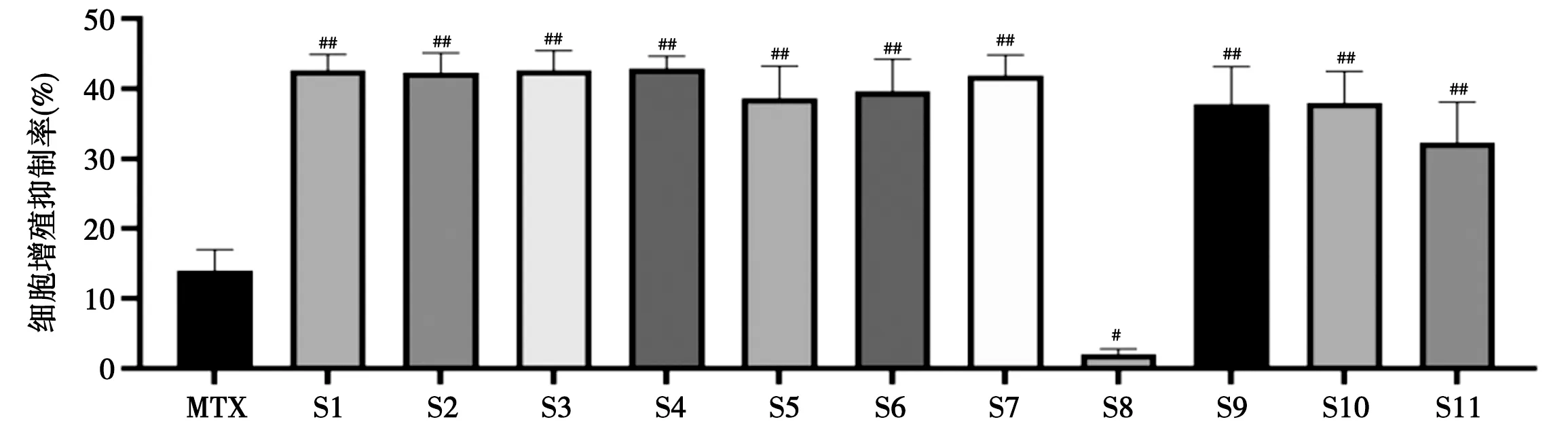
注:与MTX组比较,#P<0.05,##P<0.01
2.3 树参茎抑制HFLS-OA异常增殖作用谱效关系的建立[6-10]
2.3.1 PLSR法 将指纹图谱各色谱峰的峰面积作为自变量,细胞增殖抑制率作为因变量,采用Simca-P 14.1软件对其进行偏最小二乘回归分析,数据选择标准差标准化处理,消除变量量纲差异,计算得到34个特征峰与抑制率的标准化回归系数(图4-A)和VIP值(图4-B)。VIP>1时,自变量在解释因变量时具有重要意义。由图4可知,峰34、21、22、17、11、27、7、13、24、8、4、31、14、9、33、29、16、3、10的VIP值均大于1(按VIP值从大到小排列),并且其回归系数均为正相关,说明这些峰号对应的物质对于抑制HFLS-OA异常增殖有重要影响。
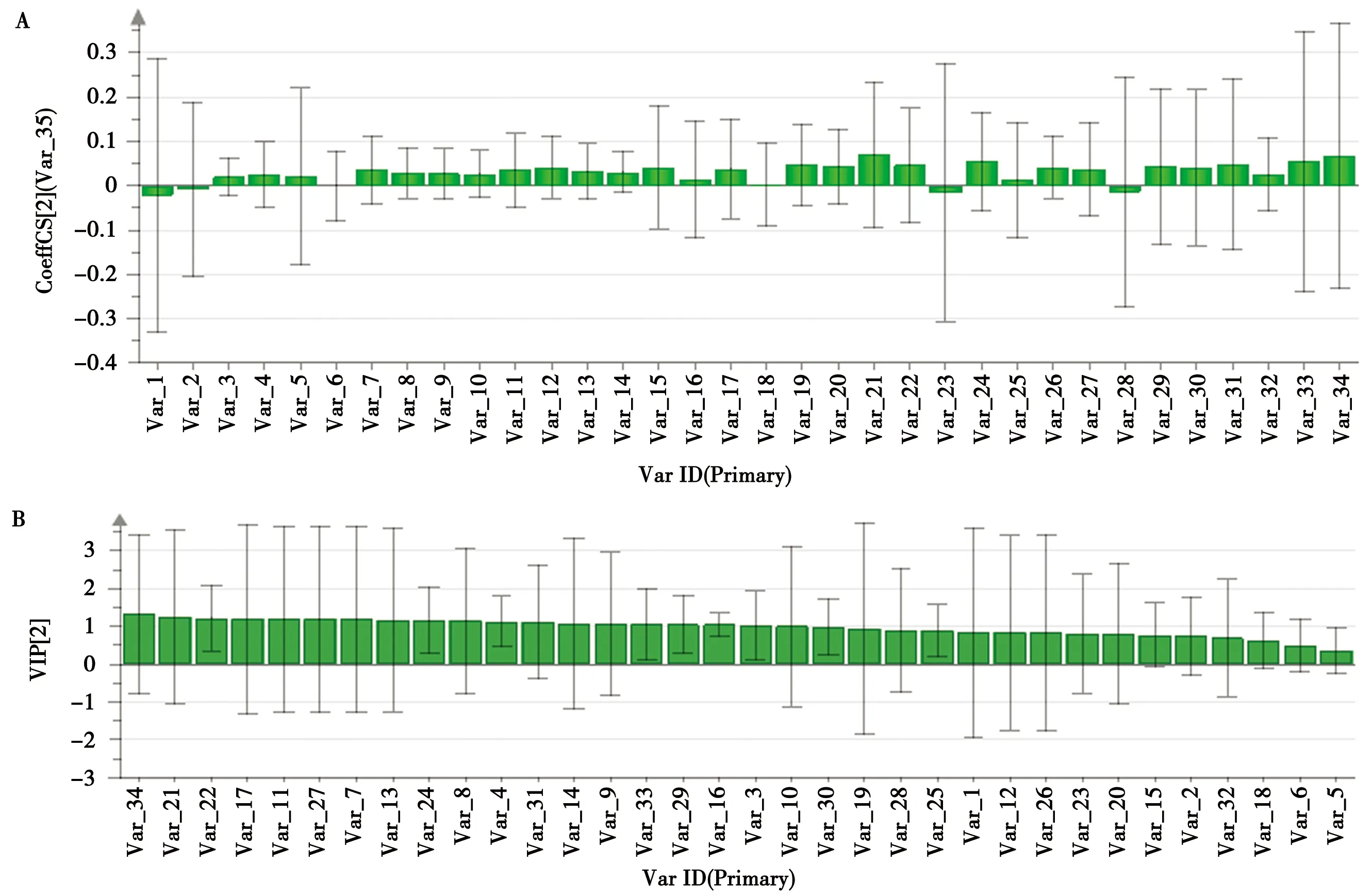
图4 树参茎提取物PLSR标准化回归系数图(A)和药效的VIP贡献图(B)
2.3.2 GRA法 将细胞增殖抑制率作为参考序列,指纹图谱各色谱峰的峰面积作为比较序列,采用均值变化法进行无量纲化处理,分别计算每个比较序列和参考序列所对应的关联系数,再取序列平均值,得到34个峰对抑制率的灰色关联度(r)。关联度越大,说明该物质对药效的影响越大,除峰12、26外,其他峰的r值均大于0.8,其中贡献最大、r≥0.9的前7个峰分别为34、17、11、7、24、33、27。
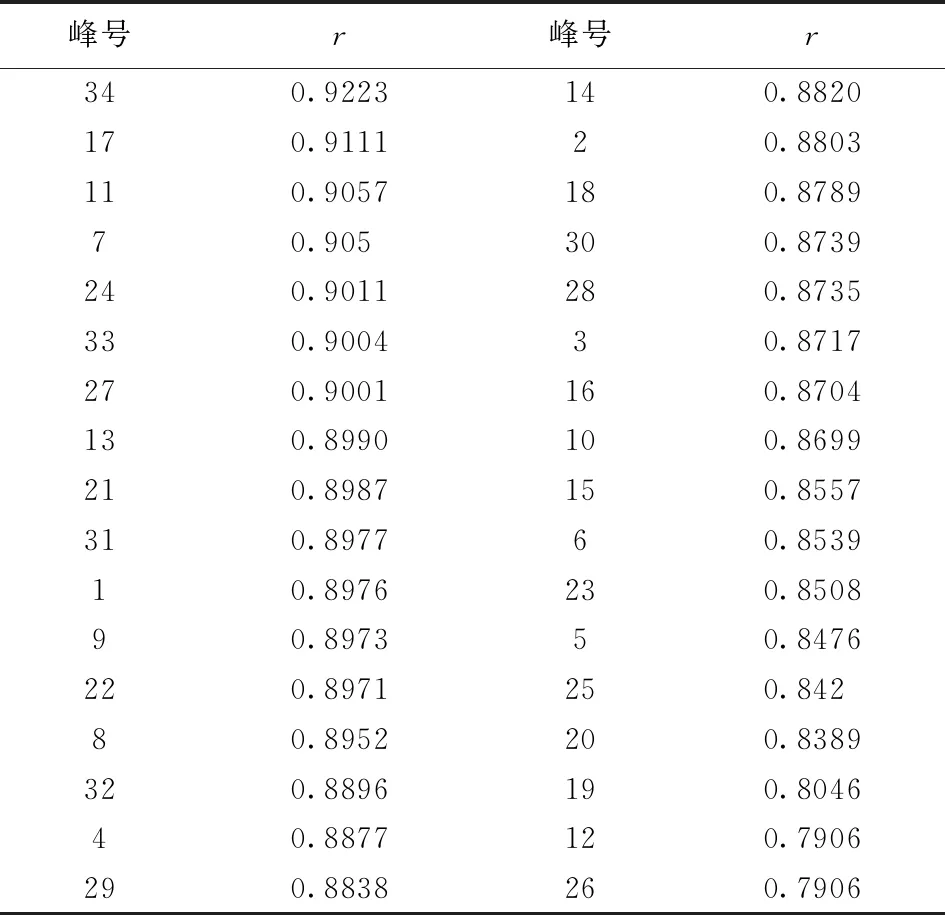
表2 关联度结果
2.3.3 PLSR和GRA联合比较 将VIP>1和r≥0.9的色谱峰整合,得到重叠的色谱峰,与抑制作用相关性由高到低顺序为峰34>17>11>7>24>33>27,说明这些峰号对应的成分对于树参茎抑制HFLS-OA异常增殖有重要影响。
3 讨论
3.1 在前期的研究中采用LC-MS联用、NMR法对树参茎中所含的化合物进行了分析,共分离鉴定出10个化合物,分别是绿原酸、异绿原酸A、异绿原酸B、异绿原酸C、Saikolignanoside A等酚酸成分,芦丁、山柰酚-3-O-芸香糖苷等黄酮类成分,紫丁香苷、松柏醇、芥子醛葡萄糖苷等苯丙素类化合物,其中异绿原酸C、绿原酸、紫丁香苷、异绿原酸A含量较高,而山柰酚-3-O-芸香糖苷含量极低,高效液相色谱法难以鉴别,故在建立树参茎不同提取物指纹图谱时,未将其作为特征性色谱峰;此外,采用DAD检测器对比了未知成分的色谱峰,结果发现峰11和12,峰18和19的出峰时间接近,但是各色谱峰的紫外吸收完全不同,其中峰19为树参茎氯仿提取物、乙醚提取物的特有成分;峰12为乙醚提取物的特有成分;另外,峰26也为树参茎乙醚提取物的特有成分。
3.2 在前期的预试验中,考察了1.95、3.90、7.81、15.62、31.25、62.50、125 g·L-1的树参茎不同浓度提取物(按生药量算)对HFLS-OA细胞增殖的影响。结果,当树参茎提取物浓度低于3.90 g·L-1时,其对HFLS-OA细胞增殖无明显影响;当树参茎提取物浓度高于31.25 g·L-1时,其对HFLS-OA细胞增殖有抑制作用;当给药浓度在3.90~31.25 g·L-1时,其对细胞的增殖抑制率具有浓度依赖性,当给药浓度为31.25 g·L-1时抑制率最高可达42.9%,故选择该浓度作为树参茎构建谱效关系的给药浓度。结果表明,在该浓度下,除了树参茎醇提后水提取物外,其他10个提取物均有一定的抑制HFLS-OA异常增殖作用,其中树参茎20%、40%、60%乙醇提取物、正丁醇提取物、水提取物的HFLS-OA增殖抑制率较高,且无显著性差异。研究结果同时表明树参茎可通过抑制HFLS-OA异常增殖而发挥抗炎作用,为后续抗炎机制的研究奠定了基础。
3.3 常用的相关性分析方法包括GRA法、PLSR法,其中GRA法具有多目标性、整体性、模糊性等性质,但无法描述相关方向;PLSR法能最大限度地利用数据信息,体现各成分对药效指标的综合作用,但只能给出自变量与因变量之间抽象的结构关系,而无法精确地定量。故在构建谱效关系时采用了两者分析方法,以期相互佐证,从整体上评价各化学成分与药效指标的相关性大小、变化方向及显著程度。分析结果表明,树参茎抑制HFLS-OA异常增殖的作用是化学成分群共同作用的结果,其中峰34(异绿原酸C)、17(绿原酸)、11(紫丁香苷)、7(未知成分)、24(未知成分)、33(异绿原酸A)、27(Saikolignanoside A)是树参茎抑制HFLS-OA异常增殖的主要药效成分。
