冬凌草甲素对脓毒症大鼠脑损伤的保护作用及机制研究
2023-05-14姜亚威陈霁虹
姜亚威,楼 屹,徐 英,陈霁虹
(浙江省宁波市中医院重症医学科·浙江 宁波 315010)
脓毒症是感染引起的宿主对炎症反应失控导致的全身多器官功能损伤性疾病,为ICU常见危重症。脑是脓毒症较易受累的器官,70%的脓毒症患者可表现为从谵妄到昏迷不同症状的脑功能损伤称为脓毒症相关性脑病(Sepsis-associated encephalopathy,SAE),合并SAE可使脓毒症病死率升高20%,且幸存者多遗留长期的认知功能障碍[1-2]。目前SAE缺乏特效疗法,现多以抗感染治疗为主,但对脑损伤效果较差,这是造成脓毒症患者预后不佳的重要原因。脑内炎症反应是SAE发生发展的中心环节,Toll样受体4(Toll-like receptor-4,TLR-4)/核因子-κB(Nuclear factor-κB,NF-κB)信号通路参与调控炎症反应,在脓毒症脑损伤病理机制中起着重要作用[3]。
冬凌草甲素(oridonin, Ori)是提取自药用植物冬凌草的二萜类化合物,具有抗炎、抗氧化、抗肿瘤和神经调节等多种药理学特性[4],是近年来国内外学者研究热点中的中药单体。Ori可抑制脓毒症炎症反应,减轻肺等重要靶器官的炎症损伤[5]。TLR-4/NF-κB信号通路是Ori发挥抗炎和肺保护等药理作用的关键靶点[6]。然而,Ori及其介导的TLR-4/NF-κB信号通路能否影响SAE病理过程,对脓毒症脑损伤起到保护作用尚不清楚。本研究建立脓毒症大鼠模型,观察Ori在脓毒症脑损伤病理过程中的作用并探讨其可能的分子机制,为SAE治疗提供新的思路和实验依据。
1 材料与方法
1.1 实验动物与分组 SPF级健康雄性SD大鼠,鼠龄7~8周,90只,体质量(200±20)g,由宁波大学医学院实验动物中心提供,许可证号SYXK(浙)2019-0005。饲养环境:20~25 ℃,50%相对湿度,12 h明暗周期环境下适应性饲养5 d后进行实验。整个实验过程中对动物的各种处理均遵照中华人民共和国科技部2006年颁布的有关动物的《关于善待实验动物的指导性意见》中相关规定。将大鼠按随机数字表法分为假手术组(Sham)、模型组(Model)、Ori低(Ori-L,10 mg/kg)、中(Ori-M,20 mg/kg)、高(Ori-H,40 mg/kg)剂量组及TAK-242组(TLR-4抑制剂),每组15只。
1.2 实验药物和试剂 冬凌草甲素(纯度≥98%标准品):北京北纳创联生物技术研究院;TAK-242:美国MCE公司。Evans蓝试剂:北京索莱宝科技有限公司;HE染色试剂盒、RIPA裂解液、BCA试剂盒:上海碧云天生物技术有限公司;肿瘤坏死因子α(TNF-α)、白介素1β(IL-1β)、白介素-6(IL-6)ELISA试剂盒:上海桥社生物科技有限公司;兔抗鼠Iba-1(小胶质细胞特异性标志物)、TLR-4、MyD88、NF-κB p65、β-actin抗体和HRP标记的羊抗兔二抗:美国Abcam公司。
1.3 实验仪器 电子荧光显微镜、共聚焦显微镜:日本奥林巴斯公司;Thermo离心机、Thermo切片机:美国赛默飞世尔公司;Spectra Max190酶标仪:MD,美国。
1.4 大鼠脓毒症模型建立及给药处理
采用盲肠结扎穿孔法(CLP)建立脓毒症模型[7]。具体操作:大鼠术前8 h禁食禁水,称重后经2%戊巴比妥钠(4 mL/kg)腹腔麻醉,腹部皮肤去毛消毒,超净工作台内于大鼠腹部前正中线作长约2 cm切口,游离盲肠和肠系膜,以5号丝线环形结扎盲肠根部,结扎完毕仔细检查,保持肠道通畅,在距盲肠末端约1 cm处用22号针头贯通穿刺2次,自穿刺孔挤出少许粪便,拭净后还纳盲肠,逐层缝合关腹。术后皮下注射生理盐水20 mL/kg液体复苏。Sham组既不结扎也不穿孔,余同CLP大鼠。术毕各组大鼠分笼饲养,密切观察6 h。以CLP术后6 h内出现寒战竖毛、蜷缩懒动、眼角分泌物增多、保护性反射减弱等为大鼠脓毒症造模成功标准。若造模失败,则以备用大鼠补充造模。
按10、20、40 mg/kg称取Ori并溶解于1 mL生理盐水中配制成Ori低、中、高3 个剂量予Ori各剂量组大鼠腹腔注射[6],TAK-242组予TAK-2425 mg/kg腹腔注射[3],均在造模成功后1、24、48 h给药。Sham组和Model组在相同时间点予等体积生理盐水腹腔注射给药。
1.5 观察指标及检测方法 观察大鼠一般情况及造模后72 h病死率,存活大鼠评估神经功能;随后各组取6只存活大鼠断头处死,无菌操作下取脑组织,生理盐水冲洗后用于病理形态学、血脑屏障通透性、脑含水量、小胶质细胞活化、脑内炎症因子及Western blot检测,部分冻存于液氮备用。
1.5.1 神经功能评估 采用耳廓反射(轻触外耳道诱发摇头运动)、角膜反射(棉签轻触角膜诱发眨眼或摇头运动)、翻正反射(仰卧位放置观察其是否能翻身成俯卧位)、甩尾反射和逃避反射(短暂刺激尾部引起躲避或转头逃避伤害刺激的反应)进行神经行为学评分[7]。无反射(>30 s)为0分,反射减弱(>10 s但<30 s)为1分,正常反射为2分,满分10分。
1.5.2 脑组织病理学变化 取部分脑组织,4%多聚甲醛固定,常规脱水、石蜡包埋、切片,行苏木精-伊红(HE)染色,光镜下观察脑组织病理学改变。
1.5.3 血脑屏障通透性检测 取材前1 h经尾静脉注射Evans蓝试剂(2%,5 mL/kg),循环1 h处死大鼠,经PBS灌注后取左侧大脑称重后浸于甲酰胺中,60 ℃孵育24 h收集浸出液,使用酶标仪在620 nm波长处测定吸光度(OD)检测脑内Evans蓝渗出量评估血脑屏障通透性。
1.5.4 脑含水量检测 解剖分离所取大脑称重得湿重,随后置于100 ℃烤箱中烘烤24 h直至重量不再变化称重得干重。脑含水量=(湿重-干重)/湿重×100%。
1.5.5 小胶质细胞免疫组化染色 取制备的脑组织切片进行Iba-1免疫组化染色。切片脱蜡,3%过氧化氢灭活,枸橼酸盐热修复后加入Iba-1抗体(1∶500稀释)4 ℃过夜,滴加HRP标记的二抗(1∶1 000稀释)3 ℃孵育,加入DAB显色液至棕色、苏木素复染、梯度酒精脱水、中性树胶封片,光镜下观察活化小胶质细胞数量及形态。
1.5.6 脑组织炎症因子检测 取脑组织约0.1 g制备匀浆,4 ℃下离心后取上清,采用ELISA法检测TNF-α、IL-1β和IL-6水平,操作按试剂盒说明书进行。酶标仪于450 nm处测定吸光度,绘制标准曲线,根据标准曲线计算TNF-α、IL-1β和IL-6水平。
1.5.7 Western blot检测TLR-4、MyD88、NF-κB p65蛋白表达 取脑组织约0.1 g,加入RIPA裂解液冰上裂解,4 ℃离心后取上清液,BCA法进行蛋白定量,按30 μg总蛋白进行上样,经SDS-聚丙烯酰胺凝胶电泳后转印到聚偏二氟乙烯(PVDF)膜上,5%脱脂奶粉封闭2 h,加入目的蛋白一抗∶TLR-4抗体(1∶500稀释)、MyD88抗体(1∶500稀释)、NF-κB p65抗体(1∶500稀释)4 ℃孵育过夜,TBST洗膜后加入HRP标记的二抗(1∶1 000稀释)孵育2 h。ECL液发光显影,以β-肌动蛋白(β-actin)作为内参,图像分析软件测定各蛋白条带灰度值,以目的蛋白与内参的灰度值比值作为目的蛋白的相对表达量。

2 结果
2.1 各组大鼠CLP后72 h内病死率 Model组死亡7只(46.7%),TAK-242组和Ori-H组各死亡2只(13.3%),较Model组明显降低(P<0.05),Ori-L组和Ori-M组分别死亡5只(33.3%)和4只(26.7%),也较Model组降低,但差异并不显著(P>0.05)。
2.2 各组大鼠行为学变化及神经功能评估结果 各组大鼠术后1 h逐渐苏醒,除Sham组外,其余各组均出现竖毛、懒动、眼角分泌物增多、反射减弱等表现,并从造模后24 h开始出现死亡,解剖可见腹腔内血性渗液,盲肠肿胀粘连,严重者发生肠坏死,符合脓毒症模型标准。
与Sham组[(9.62±0.41)]分比较,Model组[(3.72±0.28)分]造模后72 h神经行为学评分明显降低(P<0.05);与Model组比较,Ori-L组[(4.48±0.38)分]、Ori-M组[(6.12±0.71)分]、Ori-H组[(7.72±1.48)分]和TAK-242组[(7.42±1.39)分]均呈不同程度升高,且Ori各组评分呈剂量递增效应,其中Ori-M 组、Ori-H组和TAK-242组升高明显(P<0.05)。
2.3 各组大鼠脑组织病理学变化 Sham组脑组织结构清晰,神经元形态正常;Model组可见神经元固缩、紊乱,基本结构破坏,间隙扩大,出现空泡;不同剂量Ori组和TAK-242组脑组织病理学有不同程度改善,以Ori-H组和TAK-242组最明显。见图1。
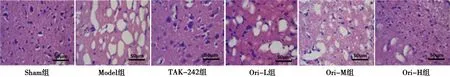
图1 各组大鼠脑组织病理学改变(HE,×200)
2.4 各组大鼠血脑屏障通透性和脑含水量比较 见表1。
表1 各组大鼠血脑屏障通透性和脑含水量比较
2.5 各组大鼠脑内小胶质细胞活化数量和形态比较 造模后72 h,Model组小胶质细胞数量较Sham组明显增加(P<0.05),呈明显激活状态,表现为胞体增大、突起回缩。而Ori-L组、Ori-M组、Ori-H组和TAK-242组则较Model组小胶质细胞数量减少,且Ori各组呈剂量相关性,激活状态不明显(P<0.05)。见图2,表2。
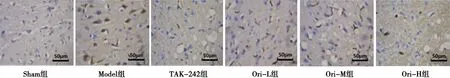
图2 各组大鼠脑组织Iba-1免疫组化染色(×200)
表2 各组大鼠脑组织Iba-1阳性细胞数比较个/mm2)
2.6 各组大鼠脑组织炎性因子水平比较 见表3。
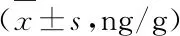
表3 各组大鼠脑组织TNF-α、IL-1β和IL-6水平比较
2.7 各组大鼠脑组织TLR-4/NF-κB信号通路蛋白表达的比较 见图3,表4。
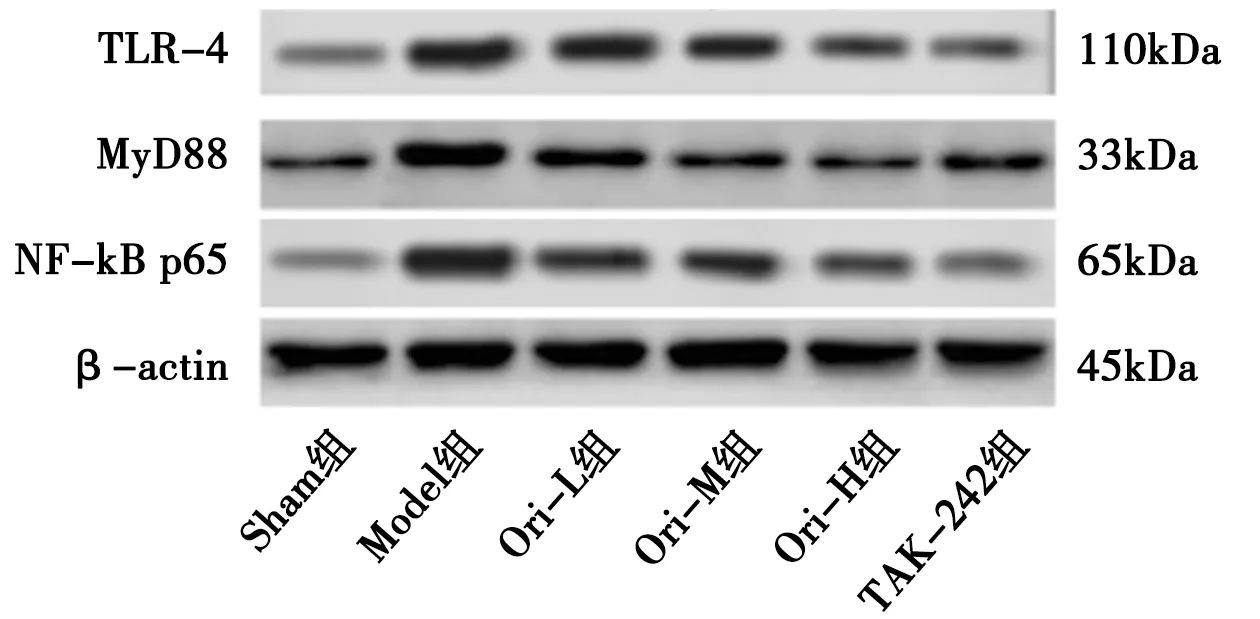
图3 各组脑组织TLR-4、MyD88和NF-κB p65蛋白表达的Western blot检测结果

表4 各组大鼠脑组织TLR-4、MyD88和NF-κB p65蛋白表达的比较
4 讨论
脓毒症相关性脑病(SAE)发病机制尚未完全阐明,目前认为,脑内炎症反应在脓毒症脑损伤和SAE发病机制中起着至关重要的作用。脓毒症时,组织器官感染部位将病理刺激信号通过迷走神经及位于神经内分泌和自主神经核附近的室周器两条感知途径穿过血脑屏障传递到大脑,脑内炎症因子大量释放,引起脑水肿、血脑屏障破坏、神经元变性凋亡、神经递质传递障碍等一系列病理改变,最终出现各种中枢神经系统症状,成为SAE[1,8-9]。本研究采用CLP法建立脓毒症模型后,Model组除表现为各种脓毒症症状外,并出现神经功能障碍及脑组织病理学改变,血脑屏障通透性和脑含水量升高,同时脑内TNF-α、IL-1β和IL-6等炎症因子水平升高;说明SAE建模成功,脑内炎症反应引起严重脑损伤。因此,选择针对性治疗措施,降低脑内炎症反应,对减轻脓毒症脑损伤,改善脓毒症预后具有重要意义。
Ori是一种天然的二萜类化合物,既往对Ori研究主要聚焦于抗肿瘤方面[10]。近年来随着对其药理学研究的拓展,Ori的强效抗炎且易透过血脑屏障的特性成为国内外学者研究的新热点。Ori能抑制脓毒症大鼠的炎症反应,减轻肝、肺等重要器官炎症损伤,降低病死率[5]。因此,理论上来说Ori的药理学特性对治疗SAE具有一定潜力。本研究重点观察了Ori对脓毒症脑损伤的影响,结果显示Ori各组大鼠脑组织病理学变化呈现不同程度的改善,血脑屏障破坏和脑水肿亦减轻,更为重要的是,Ori能缓解脓毒症引起的神经功能障碍,降低病死率,且疗效呈剂量递增效应。说明Ori对脓毒症脑损伤具有保护作用,可用于SAE治疗,进而改善预后。
小胶质细胞作为脑内的先天免疫细胞,能感知各种病理刺激并作出快速免疫应答,大量活化的小胶质细胞在清除抗原的同时,释放大量炎症因子引起脑损伤[11]。已有多项研究表明,小胶质细胞参与调控脑内炎症反应,与脓毒症脑损伤的病理过程密切相关[12-13]。而Ori可通过降低小胶质细胞活化介导脑内炎症反应,减轻β-淀粉样蛋白诱导的阿尔茨海默病大鼠脑损伤[14]。本研究中,Model组小胶质细胞出现明显的数量和形态改变,伴有炎症因子水平升高,再次证实脓毒症时存在小胶质细胞活化介导的脑内炎症反应。而Ori各组小胶质细胞改变不明显,且炎症因子水平均有不同程度降低;说明Ori可呈剂量依赖性降低小胶质细胞活化介导的脑内炎症反应,从而减轻脓毒症脑损伤。
TLR-4作为一种跨膜信号分子,在脑内主要在小胶质细胞上表达,是小胶质细胞活化并行使免疫炎症反应的重要识别受体。TLR-4可特异性识别抗原,通过细胞内接头蛋白MyD88将抗原刺激信号转入细胞内,进一步使下游NF-κB发生核转录,促进小胶质细胞活化和一系列炎症因子的释放[15-16]。本研究中,Model组脑组织TLR-4、MyD88和NF-κB p65蛋白表达量显著增加,说明TLR-4/NF-κB信号通路被激活,该信号通路参与炎症反应,脓毒症脑损伤与TLR-4/NF-κB信号通路调控的脑内炎症反应密切相关[3]。Ori对TLR-4/NF-kB信号通路中上游信号分子有明显抑制作用,Ori可通过抑制该信号通路减轻高糖诱导的肾脏炎症损伤[17],亦可减轻脓毒症诱导的急性肺损伤炎症反应,起到肺保护作用[6]。本研究中,Ori各组可呈剂量依赖性降低上述蛋白表达量,说明TLR-4/NF-κB信号通路被抑制,特别是Ori-H组抑制作用与TAK-242组(TLR-4抑制剂)类似,且两组脑内炎症因子水平及脑损伤情况亦相似,进一步说明Ori主要通过抑制TLR-4/NF-κB信号通路,减轻脑内炎症反应,对脓毒症脑损伤起到保护作用,且以Ori-H组效果最佳。
综上,Ori可通过抑制TLR-4/NF-κB信号通路,减轻脑内炎症反应,对脓毒症大鼠脑损伤起到保护作用,且疗效呈剂量递增效应,并改善脓毒症大鼠预后,为临床SAE治疗提供新的思路,具有一定临床应用价值。但关于Ori临床用药安全剂量、作用TLR-4/NF-κB信号通路的直接靶点及是否涉及其他信号通路参与有待进一步研究。
