沉默SNAI1 对口腔鳞状细胞癌细胞生物活性的影响
2023-05-13武艳飞杨卫平邵莉
武艳飞,杨卫平,邵莉
湖州市第一人民医院口腔科,浙江湖州 313000
口腔鳞状细胞癌(oral squamous cell carcinoma,OSCC)约占口腔恶性肿瘤的90%。在过去的20 年中,OSCC 的治疗手段有所进展,但OSCC 患者的5年生存率仍不足55%[1]。转录因子SNAI1 为转录抑制因子Snail 家族成员之一,目前普遍认为,SNAI1可通过调控下游靶基因上皮钙黏素(E-cadherin)等的表达介导肿瘤细胞发生上皮间质转化(epithelialmesenchymal transition,EMT),促进肿瘤的迁移与侵袭。相关文献证实,SNAI1 在黑色素瘤、结肠癌、胃癌、肝癌、口腔鳞癌、乳腺癌、胰腺癌等多种肿瘤中高表达[2-8]。但SNAI1 在OSCC 中的研究较少,本研究通过沉默转录因子SNAI1 观察其在OSCC Tca8113 细胞中的表达情况及对OSCC Tca8113 细胞生物活性的影响。
1 材料与方法
1.1 细胞
人舌鳞癌细胞Tca8113(货号:BFN60700396)购买于BFB 生命科学有限公司。
1.2 主要试剂与仪器
DMEM 培养基(货号:10567014)、胎牛血清(fetal boyine serum,FBS)(货号:SH30080.03)、0.25%胰酶消化液(货号:SH30042.01)均购自美国Gibco 公司;脂质体LipofectamineTM2000(Invitrogen,美国,货号:11668027);MTT 检测试剂盒、BCA蛋白检测试剂盒(上海嵘崴达实业有限公司,货号:23250、4890-025-K);SYBR Premix Ex TaqTM(Tli RNaseH Plus)、PrimeScriptTM RT reagent Kit with gDNA Eraser Kit(Perfect Real Time)(TAKARA公司,日本,货号:RR820A、RR047AA);膜联蛋白 V-异硫氰酸荧光素/碘化丙啶(Annexin V-fluoresceinisothiocyanate/propidium iodide,Annexin V-FITC/PI)细胞凋亡检测试剂盒(BD 公司,美国,货号:556547);GAPDH 兔多抗(Bioworld 公司,美国);兔抗SNAI1、兔抗胱天蛋白酶3(caspase-3)、兔抗基质金属蛋白酶(matrix metalloproteinase,MMP)-2、MMP-9(Abcam,美国,货号:ab216347、ab13748、ab92536、ab228402);兔抗Bax、兔抗c-Myc、兔抗Bcl-2、兔抗cyclin D1(R&DSYSTEMS,美国,货号:MAB846、MAB3696、MAB8272、MAB4314);辣根过氧化物酶标记的山羊抗兔二抗(Santa Cruz 公司,美国,货号:sc2004);SNAI1 shRNA(sh-SNAI1)及其阴性对照(sh-control)(上海生工生物公司)。
流式细胞仪(BD 公司,美国);酶联免疫标记分析仪(雷勃Multiskan MK-3,芬兰);CO2培养箱(SHEL-LAB 公司,美国);荧光定量聚合酶链反应仪(ABI 公司,美国);倒置显微镜(OLYMPUS公司,日本)。
1.3 方法
1.3.1 细胞培养 Tca8113 细胞复苏后,将其置于10% FBS DMEM 培养基中,在37℃、含5%CO2的培养箱中培养。
1.3.2 细胞转染与实验分组 实验分为 3 组:Tca8113 细胞组、sh-control 组、sh-SNAI1 组,其中sh-control 组、sh-SNAI1 组分别用 sh-control、sh-SNAI1 转染Tca8113 细胞,而Tca8113 细胞组不作任何处理,转染48h 后进行检测。
1.3.3 MTT 法检测Tca8113 细胞增殖 Tca8113 细胞调整为1×105个/ml,将其接种于96 孔板(100μl/孔),48h 后,添加MTT 溶液10μl,4h 后,每孔添加二甲基亚砜150μl,充分混匀,酶标仪检测492nm波长处的光密度(optical density,OD)值。细胞存活率=实验组OD 值/对照组OD 值×100%。
1.3.4 流式细胞术检测Tca8113 细胞凋亡 各组Tca8113 细胞培养24h 后,依据Annexin V-FITC/PI凋亡检测试剂盒说明书的操作方法,先加入5μl Annexin V-FITC,再加入5μl PI,室温条件下避光反应20min,使用流式细胞仪观察各组Tca8113 细胞凋亡情况。
1.3.5 Transwell 实验检测Tca8113 细胞侵袭能力首先在小室内加入100μl 稀释好的Matrigel 基质胶放置超净台紫外线消毒杀菌过夜,在小室上部加入200μl 无血清培养基,下室中加入600μl 含10% FBS的DMEM 高糖培养液,48h 后弃去24 孔板下室中的培养基,加入无水乙醇对细胞进行固定,结晶紫染色,轻轻擦掉未侵入基质胶中的Tca8113 细胞,显微镜下观察并记录侵袭细胞个数,取平均值。
1.3.6 划痕愈合实验评估Tca8113 细胞迁移能力Tca8113 细胞以l×106cell/ml 的浓度接种于6 孔板,使用10μl 枪头进行划线,分别在0h 和24h 观察拍照记录同一位置的划痕宽度,并依据公式[划痕愈合率=(0h 划痕宽度-24h 划痕宽度)/0h 划痕宽度×100%]计算划痕愈合率。
1.3.7 实时荧光定量聚合酶链反应检测 SNAI1 mRNA 表达水平 利用Trizol 一步法进行RNA 提取;取1μl RNA 利用反转录试剂盒进行反转录得到cDNA。采用SYBR Green 试剂盒评价SNAI1 mRNA表达水平。循环条件如下:94℃ 5min,94℃ 30s,58℃ 20s 和72℃ 40s,35 个循环,最后72℃ 5min。引物序列:SNAI1 正向引物5'-TTCTTCTGCGCTA CTGCTGCG-3',反向引物5'-GGGCAGGTATGGAG AGGAAGA-3';GAPDH 正向引物5'-GCACCGTCAA GGCTGAGAAC-3',反向引物5'-TGGTGAAGACGC CAGTGGA-3'。
1.3.8 蛋白质印迹法检测SNAI1、c-Myc、cyclin D1、Bcl-2、Bax、caspase-3、MMP-2、MMP-9 蛋白表达水平 按照实验分组处理细胞后48h,收取各组细胞,分别加入蛋白裂解液进行总蛋白提取。用BCA蛋白试剂盒检测其蛋白浓度,于99℃进行蛋白变性,并进行10% SDS 凝胶电泳,转膜,5%脱脂奶粉封膜1h,分别添加兔抗SNAI1(1∶500)、c-Myc(1∶1000)、cyclin D1(1∶200)、Bcl-2(1∶500)、Bax(1∶1000)、caspase-3(1∶500)、MMP-2(1∶200)、MMP-9(1∶200)4℃下过夜孵育,次日添加兔二抗(1∶5000)孵育膜1h,再使用ECL 底物进行显色,Image J 软件进行定量分析。实验重复3 次。
1.4 统计学方法
采用SPSS 20.0 软件进行数据统计分析。计量资料采用均数±标准差()表示,符合正态分布及方差齐性的采用单因素方差分析,两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组Tca8113 细胞中SNAI1 mRNA 表达水平
sh-control组和Tca8113细胞组中SNAI1 mRNA表达水平比较差异无统计学意义[(1.07±0.14)vs.(1.06±0.13),P>0.05];但与sh-control 组相比,sh-SNAI1 组中SNAI1 mRNA 表达水平显著降低[(1.07±0.14)vs.(0.51±0.08),P<0.05]。
2.2 沉默SNAI1 对细胞存活率的影响
sh-control 组与Tca8113 细胞组的细胞存活率和c-Myc、cyclin D1 蛋白表达比较差异均无统计学意义(P>0.05);但与sh-control 组相比,sh-SNAI1 组的细胞存活率和c-Myc、cyclin D1 蛋白表达均显著降低(P<0.05),见图1、表1。
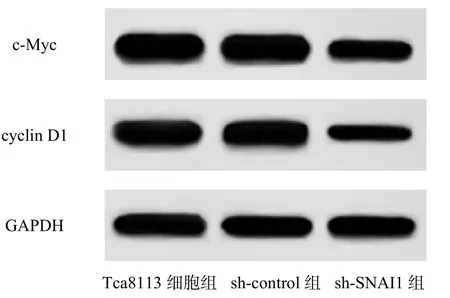
图1 各组增殖相关蛋白条带图
表1 沉默SNAI1 对Tca8113 细胞增殖的影响()
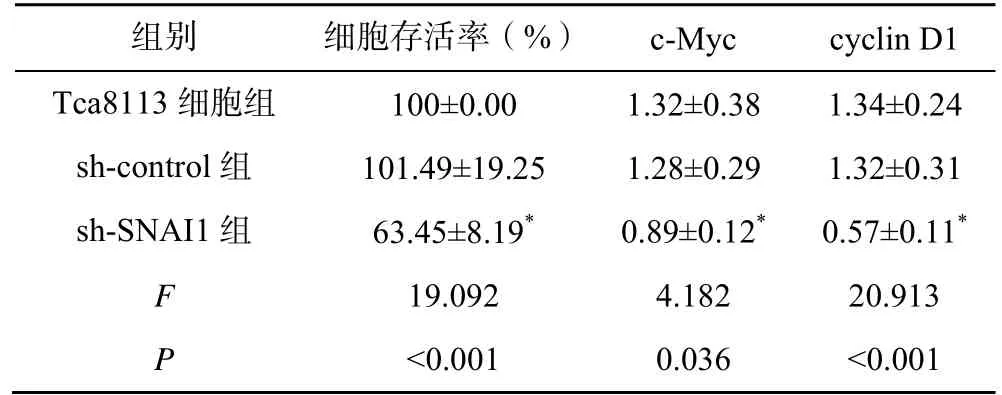
表1 沉默SNAI1 对Tca8113 细胞增殖的影响()
注:与sh-control 组比较,*P<0.05
2.3 沉默SNAI1 对细胞凋亡的影响
sh-control 组和Tca8113 细胞组的细胞凋亡率和Bcl-2、Bax、caspase-3 蛋白表达比较差异均无统计学意义(P>0.05);sh-SNAI1 组的细胞凋亡率和Bax、caspase-3 蛋白表达显著高于sh-control组(P<0.05),Bcl-2 蛋白表达显著低于sh-control组,见图2、表2。
表2 沉默SNAI1 对Tca8113 细胞凋亡的影响()
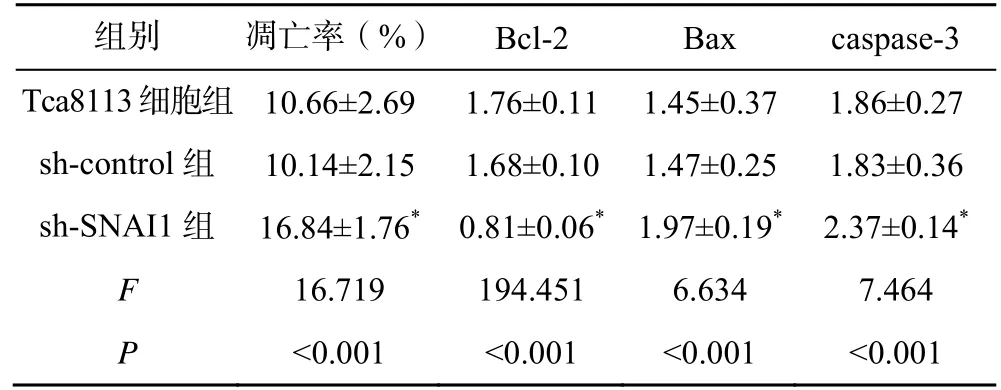
表2 沉默SNAI1 对Tca8113 细胞凋亡的影响()
注:与sh-control 组比较,*P<0.05
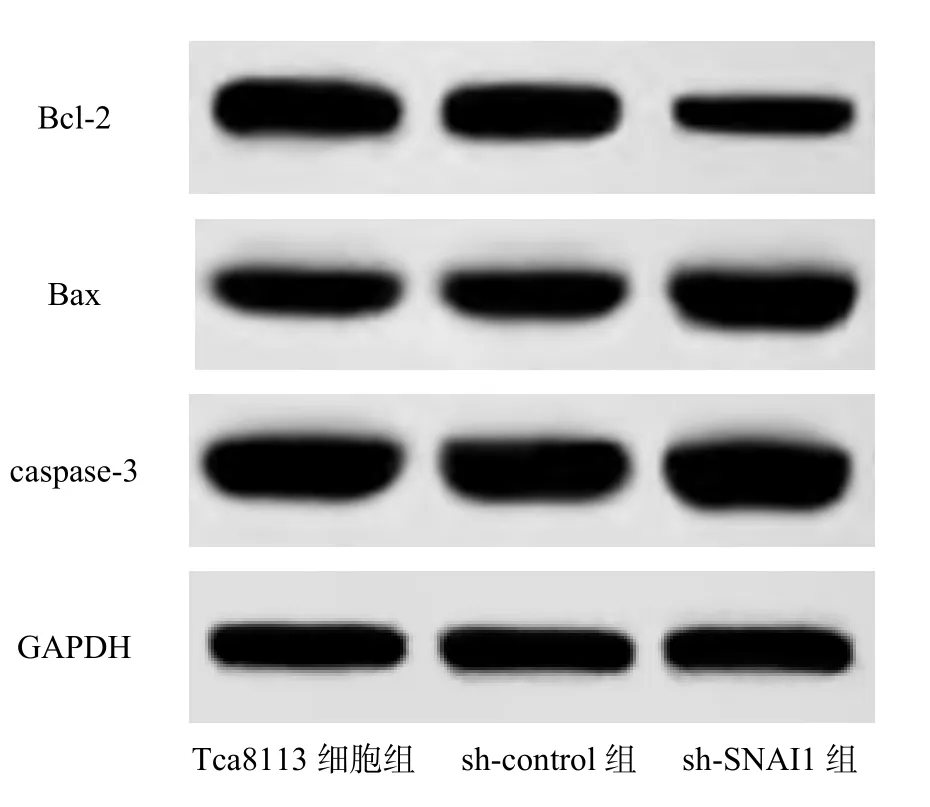
图2 各组凋亡相关蛋白条带图
2.4 沉默SNAI1 对Tca8113 细胞迁移能力的影响
sh-control 组和Tca8113 细胞组的划痕愈合率比较差异无统计学意义[(26.38±2.53)%vs.(25.66±2.37)%,P>0.05];与sh-control 组比较,sh-SNAI1 组的划痕愈合率显著降低[(26.38±2.53)%vs.(10.36±1.53)%,P<0.05],见图3。

图3 划痕试验检测各组细胞的迁移能力(×100)
2.5 沉默SNAI1 对Tca8113 细胞侵袭能力的影响
sh-control 组和Tca8113 细胞组的侵袭细胞数比较差异无统计学意义[(165.77±12.16)个vs.(164.89±12.55)个,P>0.05];与 sh-control组比较,sh-SNAI1 组的侵袭细胞数显著减少[(165.77±12.16)个vs.(80.13±11.37)个,P<0.05],见图4。
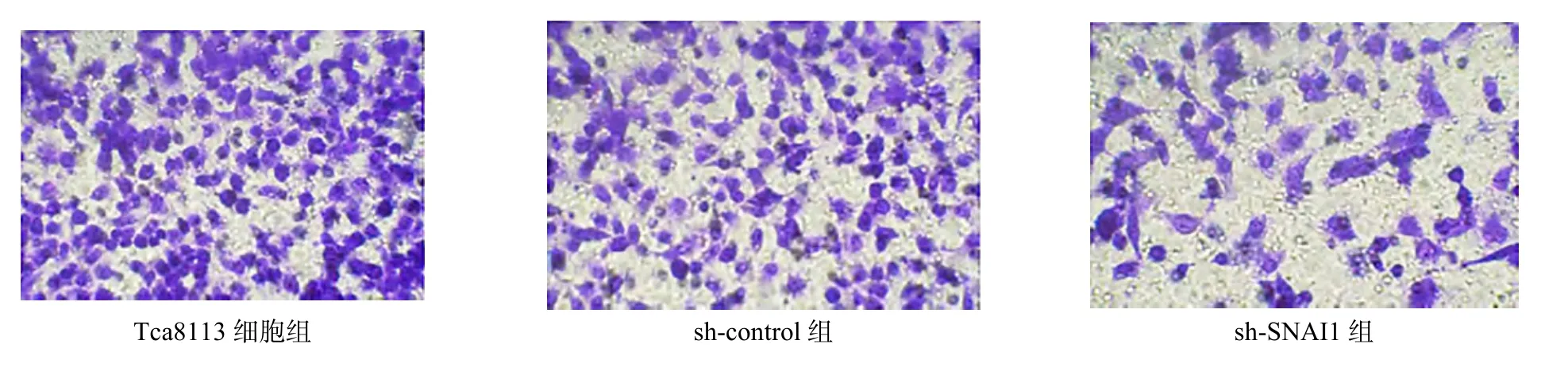
图4 Transwell 实验检测各组细胞侵袭能力(结晶紫染色,×200)
2.6 沉默SNAI1 对Tca8113 细胞SNAI1、MMP-2、MMP-9 蛋白表达的影响
sh-control 组和Tca8113 细胞组的SNAI1、MMP-2、MMP-9 蛋白表达比较差异均无统计学意义(P>0.05);与sh-control 组比较,sh-SNAI1 组的SNAI1、MMP-2、MMP-9 蛋白表达水平均显著降低(P<0.05),见图5、表3。

图5 各组SNAI1 蛋白及侵袭迁移相关蛋白条带图
表3 沉默SNAI1 对SNAI1、MMP-2、MMP-9蛋白表达的影响()
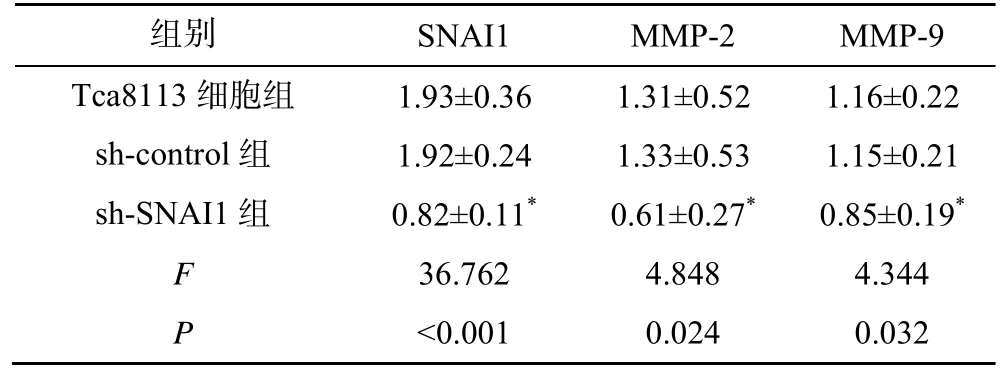
表3 沉默SNAI1 对SNAI1、MMP-2、MMP-9蛋白表达的影响()
注:与sh-control 组比较,*P<0.05
3 讨论
OSCC 是常见的恶性肿瘤,尽管治疗手段取得较大进展,但OSCC 患者的存活率仍低于50%[9-10]。OSCC 发病机制复杂,至今尚未完全明确。
SNAI1 作为关键的EMT 调节因子,在侵袭和转移中发挥重要作用,主要与SNAI1 抑制E-cadherin表达而介导上皮细胞向间充质细胞转化有关[11]。在骨肉瘤细胞研究中,miR-153 通过靶向抑制SNAI1控制肿瘤细胞的浸润、迁移和EMT[12]。在乳腺癌MCF7 细胞中,沉默SNAI1 可影响EMT 相关蛋白表达,减弱肿瘤的扩散、迁移和侵袭能力[13]。此外,值得注意的是,在OSCC 细胞系SCC-9 和HSC-4 的细胞研究中,核粒梭菌可通过上调SNAI1 表达,促进OSCC 细胞中EMT 转化[14]。另外,Yang 等[15]研究发现SNAI1 在OSCC 组织中高表达,且与T 分期、淋巴结转移、临床分期和分化程度有关,与Song 等[16]研究结果相吻合,对OSCC 的临床诊断、预后预测和靶向治疗具有重要的理论参考价值。基于以上研究,当细胞转染sh-SNAI1 后,SNAI1 mRNA 表达水平显著降低,细胞存活率、划痕愈合率与侵袭细胞数显著降低,凋亡率显著升高,Tca8113 细胞增殖、迁移、侵袭均降低,促进细胞凋亡;蛋白质印迹法检测结果显示,cyclin D1、MMP-2、MMP-9、c-Myc、Bcl-2 水平显著降低,细胞凋亡蛋白caspase-3、Bax水平显著升高,进一步表明沉默 SNAI1 可抑制Tca8113 细胞的恶性行为。
综上所述,沉默SNAI1 可抑制OSCC 的增殖、侵袭与迁移,促进细胞凋亡,为OSCC 的诊治提供新靶点,但由于机制复杂,单一细胞研究存在不足之处,后续将进一步研究以证实。
