骨髓间充质干细胞修复放射性涎腺损伤大鼠实验研究
2023-05-13梁珉,刘莉
梁 珉,刘 莉
(1.三峡大学第二人民医院口腔科,湖北 宜昌443000;2.国药葛洲坝中心医院口腔科,湖北 宜昌443000)
头颈部恶性肿瘤患者多采用手术、综合治疗、放化疗等,而在放化疗中电子直线加速器为常用医疗设备,虽然可高效杀灭肿瘤细胞,但同时可对涎腺细胞增殖起到抑制作用,进而造成了细胞凋亡,最终对涎腺功能造成了影响[1-3]。骨髓间充质干细胞是可支持骨髓造血干细胞的组织工程,主要在骨髓基质中所存在,具有体外培养快速增殖的优点,在心肌细胞损伤、牙髓组织再生、脑损伤、肾脏衰竭等医学领域的临床及基础研究中应用,可较好的修复组织原有功能[4-5]。目前临床关于骨髓间充质干细胞在放射性涎腺损伤的应用研究较少,一些外文文献中也仅仅集中在一个层面上进行分析。基于此,本研究对骨髓间充质干细胞对放射性涎腺损伤大鼠的干预效果进行分析,以期为放射性涎腺损伤的临床治疗提供参考。
1 材料与方法
1.1 实验材料 取30只SPF级Wistar大鼠,体重210~240 g,由北京维通达生物技术有限公司提供,动物许可证号SYXK(京)2019-0025,所有大鼠在无病原菌,相对湿度、室温分别为50%、23 ℃的笼子中进行喂养,所使用的水、食物均经高温高压杀毒,适应性喂养5 d。根据实验时间取1只周龄SPF乳鼠用于骨髓间充质干细胞分离培养。本试验操作均参照动物试验伦理要求的相关规定,且经我院伦理委员会批准同意。倒置显微镜(上海无陌光学仪器有限公司);流式细胞仪[安捷伦科技(中国)有限公司];PBS(武汉普诺赛生命科技有限公司);羧基荧光素二醋酸盐琥珀酰亚胺脂(CFSE)(西安齐岳生物科技有限公司);毛果芸香碱(湖北日升昌新材料科技有限公司);Takara逆转录试剂盒(上海玉博生物科技有限公司);鼠源性一抗(上海嵘崴达实业有限公司);PCR试剂盒(南京欧凯生物科技有限公司)
1.2 实验方法
1.2.1 分组与建模:适应性喂养5 d后,取30只大鼠,10只作为空白组,剩余20只参照高彦辰等[6]建立放射性涎腺损伤模型,取大鼠将其断颈处死,在无菌条件中将颌下腺分离放置在平皿内,通过胰酶消化的方法取得其颌下腺细胞,将其在培养箱内接种并培育,1 d后经差速贴壁的方式将细胞予以纯化,接着每隔3 d调换培养液1次,可取得正常水平培养下的颌下腺细胞,可在每一次换液之前用光镜下观察大鼠的细胞状态并记录,在培养原代3 d之后,将细胞制作成为单细胞悬液,分别对大鼠头颈部经一次性的钴予以照射1~9 min,放射源选择60Co γ射线,对照射视野2 cm×3 cm,大鼠与照射源的距离为80 cm,参数设置为1250 cGy/min,1次/d,2 Gy/次,共照射5 d,中间间隔2 d继续照射,总照射剂量为30 Gy。完成照射后,一部分的细胞在培养箱内继续孵育,另一部分细胞按3×104个/ml在96孔板内接种,每个孔为120 μl,继续孵育。分别在结束照射后的1、3、5 d通过倒置显微镜对其进行检测记录,最后将建模成功的20只大鼠分为放射对照组、实验组各10只。
1.2.2 骨髓间充质干细胞原代培养:建模成功后第2天对大鼠进行干预,取大鼠将其断颈处死,在无菌环境下用PBS洗涤骨髓腔,集取细胞悬液进行离心后,取每个细胞核分别在培养皿内接种,并将其标记出原代,在培养皿中铺骨髓间充质干细胞80%左右,进行传代培养。
1.2.3 治疗方法:取2代的骨髓间充质干细胞,消化胰酶成为单细胞悬液,使用流式细胞仪进行测定,取骨髓间充质干细胞第2代,滴加5 μmol/L羧基荧光素二醋酸盐琥珀酰亚胺脂(CFSE),放入培养箱内继续培养30~35 min,经PBS洗涤3~4次,以此计算每组的荧光标记率。实验组腹腔注射100 μl骨髓间充质干细胞悬液,1次/d,共注射7 d,空白组、放射对照组不做干预,正常喂养。
1.3 观察项目
1.3.1 大鼠一般情况:观察骨髓间充质干细胞悬液干预前空白组大鼠及建模大鼠毛发色泽、精神状况、活动情况、饮食等一般情况。
1.3.2 唾液流量检测:待大鼠骨髓间充质干细胞悬液干预完成后,对各组大鼠进行麻醉,之后将大鼠气管切开,将4 mg/kg毛果芸香碱注入大鼠颈部皮下,对其唾液分泌进行刺激,共收集30 min,以重量代表体积,对唾液流量进行计算。
1.3.3 腮腺指数、下颌下腺指数检测:麻醉后取大鼠腮腺、下颌下腺组织,称取湿重量,计算腮腺、下颌下腺指数=腮腺(下颌下腺)质量/大鼠体质量×100%。
1.3.4 病理学观察:于上述指标检测完成后,取大鼠腮腺组织,经脱水、石蜡包埋处理后,做HE染色,光镜下观察病理形态改变。
1.3.5 细胞增殖检测:选取MTT比色法对细胞增殖情况予以检测,将所检测的细胞浓度调至4×104个/ml,将待测细胞接种于96孔板中,每个孔内滴加220 μl的细胞悬液经24、48、72 h培养后(培养环境为37 ℃、5% CO2)加入15 μl MTT试剂,培养4 h,通过酶标仪检测其OD值,算出增殖率。细胞增殖率=检测细胞组OD值/空白组OD值×100%。重复试验3次。
1.3.6 细胞凋亡检测:应用TUNEL法检测细胞凋亡情况,将所培育的细胞清洗、DAPI染色封片后的细胞核显现出绿色荧光,其中绿色荧光表示阳性细胞数,接着用荧光显微镜对细胞凋亡情况予以观察计算细胞凋亡指数,细胞凋亡指数=阳性细胞数/总细胞数×100%。试验重复测定3次。
1.3.7 水通道蛋白5(AQP5) mRNA表达量检测:取1.3.4待检大鼠腮腺组织,AQP5 mRNA表达量通过实时荧光定量法进行鉴定,提取总RNA,将腮腺组织中的RNA使用Takara逆转录试剂盒逆转录为cDNA,采用Primer 5.0软件设计引物序列,启动PCR仪。通过2-△△Ct方法计算出AQP5的mRNA表达量。AQP5上游、下游引物序列分别为:5’-CATCTTCTCCTCCACCGACTCT-3’、5’-GGGTGCTTCAAACT-CTTCGTC-3’;内参GAPDH上游、下游引物序列分别为:5’-GCTTVGGCACATATACTAAAAT-3’、5’-CGCTTCACGAATTTGAGTGTCAT-3’。
1.3.8 AQP5蛋白相对表达量检测:通过Western blot对腮腺组织中的AQP5蛋白相对表达量进行检测,将各组大鼠腮腺组织剪碎后加入裂解液,进行30 min裂解,以离心半径3 cm,转速3000 r/min离心处理10 min,取上清液,做BCA蛋白定性检测,将样品上样至8%SDS-PAGE凝胶上,经电泳后转移至PVDF膜上,用PBS封闭2 h后,加入TBST稀释的羊抗鼠AQP5(1∶2500)一抗,后4 ℃孵育过夜,洗膜3次,加入1∶10000的稀释羊抗鼠二抗,温室孵育1 h,做TBST洗膜3次,以GAPDH为内参照,定量分析蛋白表达情况,重复试验3次。
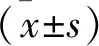
2 结 果
2.1 一般情况观察 空白组大鼠体重、精神状况、饮食、进水均无明显变化,建模大鼠进食、进水减少,颈部毛发光泽度下降,精神状态不佳。
2.2 各组大鼠唾液流量对比 见表1。与空白组相比,放射对照组、实验组唾液流量水平下降(均P<0.05);与放射对照组相比,实验组唾液流量水平上升(均P<0.05)。

表1 各组大鼠唾液流量对比(ml/30 min)
2.3 各组大鼠腮腺指数、下颌下腺指数对比 见表2。与空白组相比,放射对照组、实验组腮腺指数、下颌下腺指数水平下降(均P<0.05);与放射对照组相比,实验组腮腺指数、下颌下腺指数水平上升(均P<0.05)。
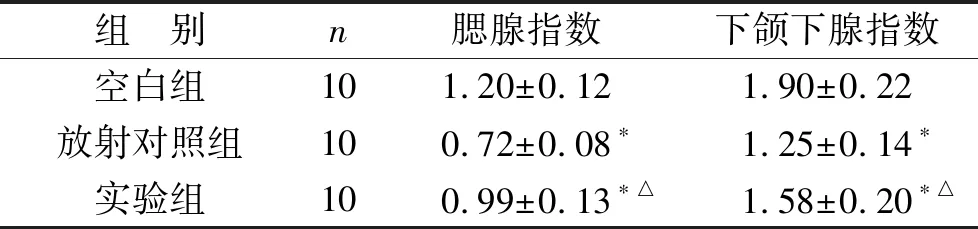
表2 各组大鼠腮腺指数、下颌下腺指数对比(%)
2.4 各组病理学特征对比 见图1。空白组大鼠腺泡呈球状、排列整齐,腮腺组织结构清晰完整,腺叶间有纤维组织间隔,放射对照组大鼠腺叶间纤维化间隙增大,胞浆染色加深,实验组大鼠少许腮泡出现变形、收缩。
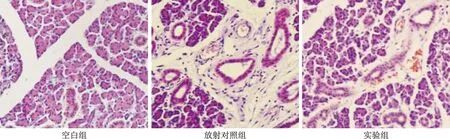
图1 各组病理学特征对比(HE染色,×400)
2.5 各组细胞增殖率对比 见表3。与对照组对比,放射对照组细胞增殖率上升,实验组的细胞增殖率降低(均P<0.05);与放射对照组对比,实验组细胞增殖率下降(P<0.05)。

表3 各组细胞增殖率对比 (%)
2.6 各组细胞凋亡率对比 见表4。与对照组比较,放射对照组细胞凋亡率下降,实验组细胞凋亡率上升(均P<0.05);与放射对照组比较,实验组的细胞凋亡率升高(P<0.05)。

表4 各组细胞凋亡率对比(%)
2.7 各组AQP5 mRNA表达量对比 见表5。与空白组相比,放射对照组、实验组AQP5 mRNA表达量下降(均P<0.05);与放射对照组相比,实验组AQP5 mRNA表达量上升(P<0.05)。
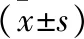
表5 各组AQP5 mRNA表达量对比
2.8 各组AQP5蛋白相对表达量对比 见表6。与空白组相比,放射对照组、实验组AQP5相对表达量下降(均P<0.05);与放射对照组相比,实验组AQP5相对表达量上升(P<0.05)。
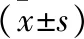
表6 各组AQP5蛋白相对表达量对比
3 讨 论
舌下腺、下颌下腺、腮腺为主要涎腺,其解剖位置多位于头颈部恶性肿瘤的浅表或者肿瘤组织相交处,对放射中产生X线敏感性较高,因此在治疗的同时X线对舌下腺、下颌下腺、腮腺等涎腺会造成一定的损伤,进而造成涎腺分泌功能下降或完全丧失,随着病情的发展易引发发音障碍、灼口综合征、味觉丧失、吞咽困难等并发症,最终对患者生活质量造成了严重影响[6-8]。目前临床多通过使用促涎腺生成药物、放疗前行下颌下腺腺体转移、改进放疗技术等手段改善放射性损伤涎腺,但仍不能达到长期改善涎腺腺体组织、功能的治疗目的,因此寻找新型治疗手段具有关键意义[9-10]。
当前治疗放射性涎腺损伤的手段有限,因此通过组织工程对放射性损伤涎腺功能进行重建成为患者生存质量提升的关键所在,但组织工程中对正常涎腺细胞需求量较大,因此找寻涎腺细胞的种子细胞为目前首要目标[11-13]。骨髓间充质干细胞可分化为包含中胚层、外胚层、内胚层的多数细胞类型,且可分泌免疫调节因子、血管形成因子、外泌体等生物活性因子,在组织的修复、再生中具有重要作用[14-16]。本研究发现,放射性涎腺损伤大鼠经骨髓间充质干细胞干预后唾液流量、AQP5蛋白相对表达量增加,腮腺指数、下颌下腺指数水平上升,腮腺组织结构,腺叶间组织结构改善,提示骨髓间充质干细胞可修复放射性涎腺损伤。
涎腺是可产生唾液并经导管系统进入口腔内的外分泌腺,在发生损伤后可出现唾液流量下降,唾液成分及性质改变,而上述改变不仅可对口腔生物环境造成影响,且可引发黏膜炎、猖獗性龋等,同时可造成腮腺、下颌下腺体积缩小,对机体影响较大[17-18]。本研究发现,放射性涎腺损伤大鼠经骨髓间充质干细胞干预后唾液流量增加,腮腺指数、下颌下腺指数水平上升。相关学者[19]研究发现,骨髓间充质干细胞可促进组织修复、再生,进而对涎腺组织功能恢复起到了促进作用,与本文研究结果一致,提示骨髓间充质干细胞可改善放射性涎腺损伤大鼠涎腺功能。
AQP5是一种在胃肠道、泪腺腺泡、肝脏、胰腺上皮、肾上皮细胞等多种组织细胞中均有存在的特异转运水蛋白质,可参与涎腺唾液分泌,且可抑制腺泡细胞凋亡[20]。本研究发现,放射性涎腺损伤大鼠经骨髓间充质干细胞干预后AQP5表达量增加。有关研究[21]表明,AQP5是构成涎腺损唾液分泌的主要通道之一,可发挥转运水的功能,在涎腺损伤时可参与细胞的液体转运,进而降低了腺泡细胞凋亡,改善了涎腺组织功能,与本文结论保持一致。提示骨髓间充质干细胞可通过调控AQP5表达而修复涎腺损伤。
综上所述,放射性涎腺损伤发生后伴随唾液流量减少,腮腺指数、下颌下腺指数水平下降等表现,骨髓间充质干细胞干预后上述情况改善,其机制可能与AQP5表达量增加有关。
