连翘苷抗番鸭呼肠孤病毒增殖及对炎症因子表达的抑制作用
2023-05-13许泽锴张凯照沈沛津吴异健黄小红
许泽锴, 郑 钰, 张凯照,2, 胡 会, 沈沛津, 吴异健,2, 黄小红,2
[1.福建农林大学动物科学学院(蜂学学院);2.中西兽医结合与动物保健福建省高等学校重点实验室,福建 福州 350002]
番鸭呼肠孤病毒(Muscovy Duck Reovirus, MDRV)属于呼肠孤病毒科正呼肠孤病毒属的双链RNA病毒[1],可通过垂直传播和水平传播,引起雏番鸭和半番鸭发生免疫抑制性传染病[2].研究表明,雏番鸭感染MDRV后,其免疫器官、呼吸道和消化道局部免疫组织中的免疫细胞大量死亡[3-4].番鸭呼肠孤病在多个国家均有报道,并表现出较高的发病率和死亡率[5].自1997年传播至中国以来[6],番鸭呼肠孤病的致死率不断提高,已成为影响番鸭养殖的重要疾病之一,给番鸭养殖业造成严重的经济损失[7],因此深入研究该病的预防和控制措施十分重要.
目前,防控番鸭呼肠孤病的方式以疫苗和抗生素为主,但近年来MDRV不断产生变异,病毒传染性逐渐增强,使现有的疫苗不能起到显著的防治效果[8];而长期滥用抗生素,产生药物残留和耐药性等一系列问题也日益严重,给畜禽食品安全和人体健康造成隐患[9].因此亟需寻找新型抗MDRV的药物.中药及其有效成分具有无污染和低耐药性的独特优势[10],目前已大量应用于畜禽生产中.大量研究表明,黄芪多糖[11]、猴头菇多糖[12]和绿原酸[13]等多种中药提取物具有良好的抗病毒及提高机体免疫力的作用.连翘苷是连翘的主要活性成分之一,具有抗病毒、抗炎、抗菌和抗氧化等多种药理作用[14];对SARS冠状病毒[15]和甲型流感[16]等病毒有明显的抑制效果.但连翘苷对MDRV的作用鲜有报道.
感染病毒后,宿主的先天性免疫信号通路首先被激活.病毒主要通过宿主的模式识别受体对病原相关模式分子进行特异性识别,从而启动下游信号级联反应,诱导产生干扰素、促炎因子和趋化因子等[17].研究表明:MDRV感染能诱导宿主炎症因子的异常表达,对宿主肠道黏膜造成损伤,导致局部免疫缺陷[18];在MDRV感染严重时,趋化因子CC和CXC亚家族显著富集[19].据此,本研究以鸡胚成纤维细胞DF-1为模型,选取促炎因子基因IFN-β、TNF-α、IL-1β、IL-6及禽类趋化因子CC、CXC亚家族基因CCL20、IL8L1、IL8L2、K203、SCYA4为研究对象,对连翘苷抗MDRV增殖和抗炎作用进行评估,旨在为进一步开发和筛选抗MDRV的药物提供参考.
1 材料与方法
1.1 材料
1.1.1 病毒和细胞 MDRV-YB株由福建农林大学动物科学学院预防兽医学实验室分离鉴定并保存;鸡胚成纤维细胞DF-1(商品代码:CRL-12203)购于武汉普诺赛生命科技有限公司.
1.1.2 主要试剂 连翘苷(纯度≥98%)购于成都曼思特生物科技有限公司;胎牛血清、DMEM细胞培养基、PBS和青霉素-链霉素购于美国Hyclone有限公司;0.25%胰酶-EDTA购于Life Technologies公司;噻唑蓝(methyl thiazolyl tetrazolium, MTT)购于北京索莱宝科技有限公司;总细胞RNA提取Trizol试剂购于美国Ambion有限公司;反转录试剂盒和荧光定量试剂盒购于宝生物工程(大连)有限公司.
1.2 连翘苷对DF-1细胞安全质量浓度的测定
将DF-1细胞按每孔5×104的个数接种至96孔板中,待细胞生长至每孔面积的70%~80%后,吸去孔中培养液.各连翘苷试验组每孔分别加入100 μL由DMEM(含2%血清)配制的7.81、15.63、31.25、62.50、125.00、250.00、500.00 μg·mL-1连翘苷,每组设8个复孔,同时设未加入药物的对照组及孔中未接种细胞的空白组.将各组细胞置于细胞培养箱(37 ℃、5% CO2)中培养24 h后,每孔加入10 μL MTT溶液,于37 ℃避光培养4 h后吸出上清液,每孔再加入150 μL二甲基亚砜(DMSO),充分吹打溶解.采用酶标仪测定各孔溶液在490 nm处的光密度(D),计算细胞存活率.
细胞存活率/%=[D490 nm(试验组)-D490 nm(对照组)]/[(D490 nm(空白组)-D490 nm(对照组)]×100
1.3 连翘苷给药方式的筛选
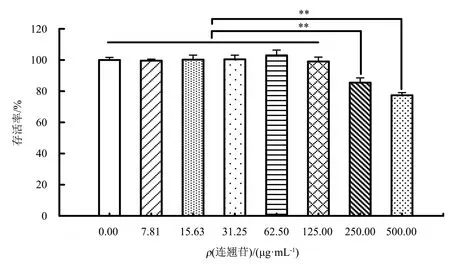
根据测定的连翘苷对DF-1细胞的安全质量浓度,将连翘苷(7.81、15.63、31.25、62.50、125.00 μg·mL-1)和100 TCID50(半数组织培养感染剂量)MDRV病毒液(每毫升TCID50为10-4.6)以3种给药方式分别感作DF-1细胞.给药方式Ⅰ(连翘苷与病毒共同感作):将各质量浓度连翘苷与病毒的混合液以每孔100 μL加入到96孔板的细胞中感作2 h;给药方式Ⅱ(先感染病毒再给药连翘苷):每孔先加入100 μL病毒液于96孔板的细胞中感作2 h后弃去,再加入100 μL各质量浓度的连翘苷感作2 h;给药方式Ⅲ(先给药连翘苷再感染病毒):每孔先加入100 μL各质量浓度的连翘苷于96孔板的细胞中感作2 h后弃去,再加入100 μL病毒液感作2 h.2 h后换成细胞维持液继续培养细胞.每组均设8个复孔,并设置孔中未加入药物的对照组及孔中未接种细胞的空白组,24 h后采用MTT法测定各孔溶液在490 nm处的D,计算病毒抑制率.
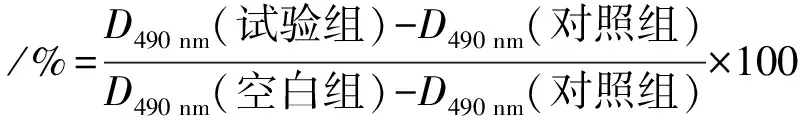
1.4 连翘苷对MDRV增殖影响的检测
根据筛选出的最佳给药方式,将DF-1细胞以每孔5×104的个数接种至96孔板中,待细胞生长至每孔面积的70%~80%后,吸去孔中培养液,加入1 000 TCID50病毒液感作DF-1细胞,2 h后吸去病毒液,再加入62.50 μg·mL-1连翘苷感作细胞,2 h后换成细胞维持液培养细胞.每组均设8个复孔,并设置对照组,分别在12、24、36、48 h时间点收集细胞上清液,使用Reed-Muench法测定不同时间点病毒的TCID50.
1.5 连翘苷对DF-1细胞炎症因子基因表达水平影响的实时荧光定量PCR检测
细胞接板和药物处理方法与“1.4”中的相同.在12、24、36、48 h时间点收集细胞,使用Trizol法提取总RNA,并反转录获得cDNA.以cDNA为模板,采用实时荧光定量PCR检测促炎因子基因(IFN-β、TNF-α、IL-1β、IL-6)和趋化因子基因(CCL20、IL8L1、IL8L2、K203、SCYA4)mRNA的表达水平.PCR引物序列[20]如表1所示,由生工生物工程(上海)股份有限公司合成.以β-actin为内参基因,采用2-ΔΔCt法计算基因mRNA的表达水平.

表1 实时荧光定量PCR引物序列
1.6 数据处理
试验数据以“平均值±标准差”表示,采用SPSS 25.0软件对数据进行单因素方差分析,P<0.05表示差异显著,具有统计学意义.
2 结果与分析
2.1 连翘苷对DF-1细胞的安全质量浓度
采用MTT法检测连翘苷对DF-1细胞的安全质量浓度.结果(图1)显示:当连翘苷质量浓度为125.00 μg·mL-1以下时,DF-1细胞活力无显著变化(P>0.05),表明该范围质量浓度的连翘苷对细胞正常生长无影响;当连翘苷质量浓度为125.00 μg·mL-1以上时,DF-1细胞活力极显著下降(P<0.01).表明连翘苷对DF-1细胞的安全质量浓度为0~125.00 μg·mL-1.
**表示差异极显著(P<0.01).
2.2 连翘苷的最佳给药方式
根据连翘苷的安全质量浓度筛选最佳的给药方式.结果(图2)显示:给药方式Ⅰ、Ⅲ对病毒的抑制率均低于15%,对病毒无明显的抑制作用(P>0.05);给药方式Ⅱ对病毒的抑制率与对照组的差异极显著(P<0.01).表明先感染病毒再给药连翘苷的方式对病毒有明显的抑制作用,其中以62.50 μg·mL-1连翘苷的抑制作用最强,病毒抑制率为71.41%.因此,最佳的给药方式为先感染病毒再给药连翘苷,并选取62.50 μg·mL-1连翘苷进行后续试验.
2.3 连翘苷对MDRV增殖的影响
采用TCID50检测连翘苷对MDRV增殖的影响.结果(图3)显示,与对照组相比,连翘苷处理组在24~48 h的病毒滴度极显著低于对照组(P<0.01),而在12 h的病毒滴度与对照组无显著差异(P>0.05).
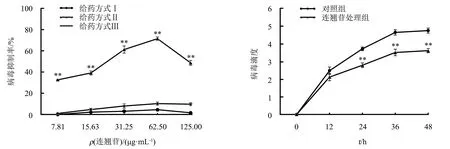
**表示差异极显著(P<0.01).
2.4 连翘苷对DF-1细胞炎症因子基因表达水平的影响
采用实时荧光定量PCR检测连翘苷对DF-1细胞促炎因子基因(IFN-β、IL-1β、TNF-α、IL-6)和趋化因子基因(IL8L1、IL8L2、CCL20、SCYA4、K203)mRNA的表达水平.结果(图4-5)显示:与对照组相比,MDRV攻毒组IFN-β、IL8L1、IL8L2和CCL20 mRNA的表达量在12~48 h时显著升高(P<0.05);TNF-α和SCYA4 mRNA的表达量在12~24 h时显著升高(P<0.05),在24~48 h时下降;IL-6和K203 mRNA的表达量在12~36 h时急剧并持续上升,在36 h时达到最大值,随后开始下降;IL-1βmRNA的表达量在12~36 h时呈先升高后下降的趋势,并在48 h达到最大值(P<0.05).总体来看,MDRV攻毒组促炎因子和趋化因子在每个时间段mRNA的表达量均显著高于对照组(P<0.05).与MDRV攻毒组相比,连翘苷处理组IFN-β、TNF-α、IL-1β、IL-6、IL8L1、IL8L2、CCL20、K203和SCYA4 mRNA的表达量在不同时间点均显著下降(P<0.05);IFN-β、IL-1β、IL8L2、CCL20和SCYA4 mRNA的表达量在48 h时与对照组的差异不显著(P>0.05).
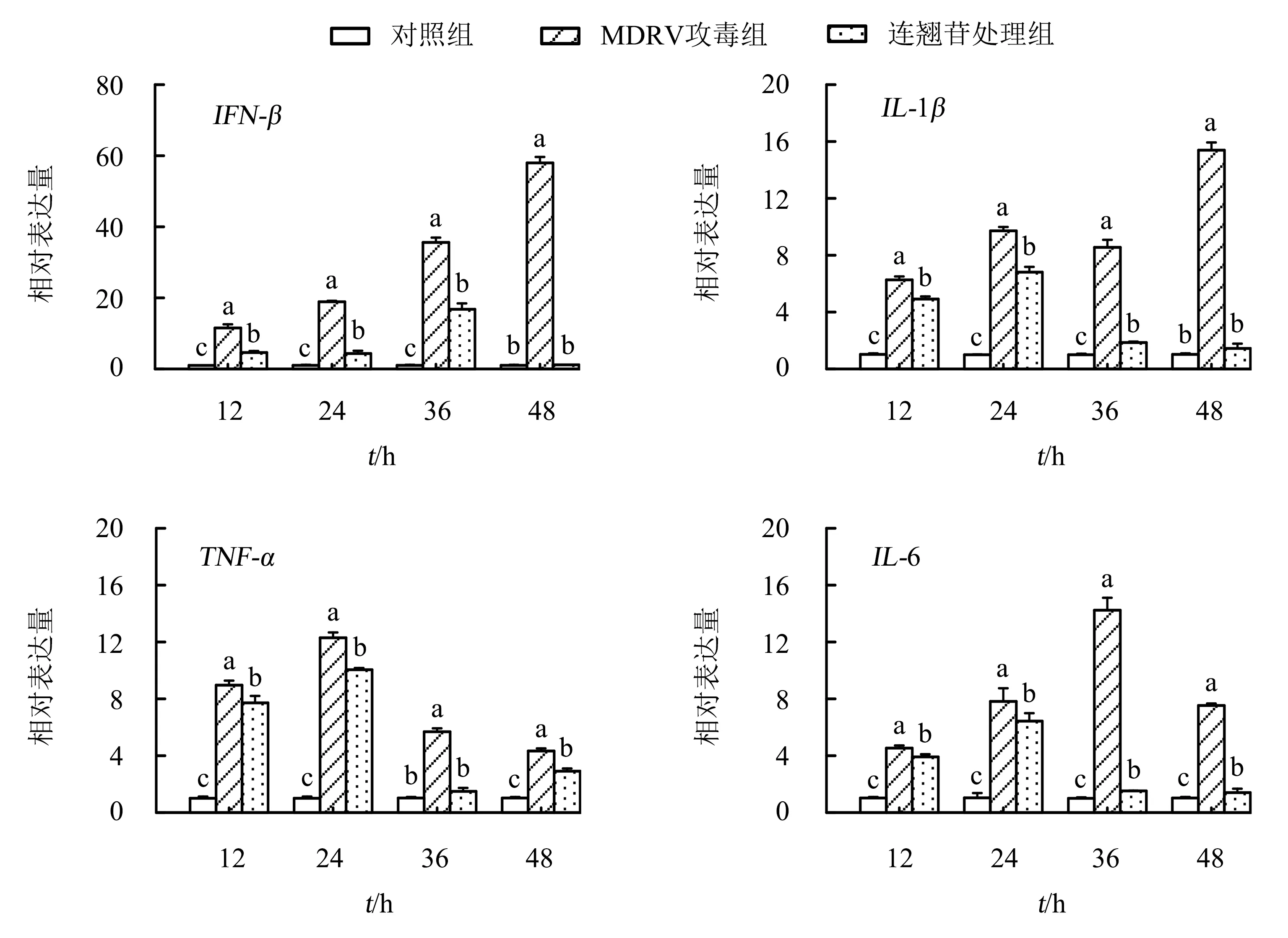
不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05).
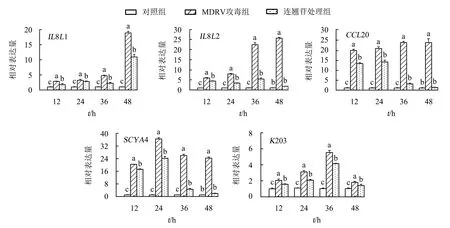
不同字母表示差异显著(P<0.05),相同字母表示差异不显著(P>0.05).
3 讨论
连翘作为我国的传统中药,具有清热解毒、消肿散结和疏散风热的功效.连翘苷是连翘主要的活性成分之一,主要发挥着抗病毒和抗炎的临床作用.目前,连翘苷对MDRV增殖和抗炎活性仍缺乏系统研究.因此,本研究在连翘苷对DF-1细胞安全质量浓度的基础上,选择3种给药方式初步探究连翘苷抗MDRV增殖及抑制炎症因子的作用.结果显示,先感染病毒再给药连翘苷的方式,连翘苷能显著抑制MDRV在DF-1细胞中的增殖,并具有时间依赖效应,这表明连翘苷在MDRV增殖的过程中发挥了抗病毒作用,具有良好的抗病毒活性.此结果与赵冰倩等[21]的研究结果“连翘水提液对H5N1和H9N2禽流感病毒有直接的抑制作用”一致.
炎症是机体对病原体感染及各种组织损伤等产生的一系列应答反应,它出现在机体识别损伤或免疫稳态扰动的起始阶段.宿主感染病毒可激活炎性细胞产生高水平的促炎因子、趋化因子和其他抗病毒效应因子,而持续性感染会造成过度的炎症反应[22],可能会导致组织损伤,对宿主机体造成严重损害.Ⅰ型干扰素是参与细菌和病毒感染的内源性免疫反应的中枢细胞因子,具有抗病毒、抗肿瘤和免疫调节等生物学活性[23].IL-1β、IL-6和TNF-α作为机体重要的促炎因子,具有调节促炎和抗炎、免疫细胞分化和激活的作用,在抑制和清除病毒的过程中发挥着重要作用[24].本研究中,MDRV感染DF-1细胞后,促炎因子和趋化因子基因的表达水平均出现不同程度的上调,表明MDRV感染激活了宿主细胞内源性免疫反应和炎症反应,细胞持续处于抗病毒状态.此结果与大量体内研究结果[11,25-26]一致.研究表明:MDRV感染初期,在番鸭脾脏TLR基因网中检测出IFN-β、IL-1β和IL-6等20个基因表达水平上调[25];MDRV入侵肠道后,诱导番鸭机体产生IFN-α和IFN-β等相关炎症因子[26];在感染中期,MDRV能促进感染组番鸭血清中IL-1、IL-6和TNF-α的分泌,导致肝损伤[11].此外,CCL20、K203和SCYA4属于趋化因子CC亚家族成员,具有典型的CC类结构,能够趋化嗜酸性粒细胞、中性粒细胞、单核细胞、自然杀伤细胞、树突状细胞和T淋巴细胞;IL8L1和IL8L2属于趋化因子CXC亚家族成员,IL8L1对嗜异性细胞有特异趋化性,IL8L2对单核细胞和巨噬细胞有趋化性,而对嗜异性细胞不具有趋化性[27].MDRV感染细胞后,激活趋化因子招募巨噬细胞和淋巴细胞等免疫细胞,免疫细胞激活PI3K/Akt/NF-κB和STAT3信号通路,刺激信号通路下游炎症因子高表达,引起宿主发生炎症反应,对机体造成损伤[28].
本研究中,连翘苷处理组DF-1细胞促炎因子和趋化因子基因的表达均显著下降,表明连翘苷可通过调节炎症相关的信号通路,降低促炎因子和趋化因子基因的表达水平,进而干预MDRV在DF-1细胞中的增殖.研究表明:连翘苷通过调节NF-кB信号通路上调促炎因子基因的表达水平,在体外显著抑制SARS-CoV-2病毒的增殖[15];此外,MDRV可入侵宿主巨噬细胞和淋巴细胞等免疫细胞,侵害肝脏和脾脏等免疫器官,而连翘苷具有保护免疫细胞和器官的作用[29-30],发挥抗炎和抗病毒功能,对MDRV的复制起到抑制作用.本研究仅探讨连翘苷对感染细胞促炎因子和趋化因子基因表达水平的影响,未对具体抗炎通路进行验证,对此还需进一步探讨.
本研究结果表明,连翘苷能抑制MDRV在DF-1细胞中的增殖,降低感染细胞促炎因子和趋化因子基因的表达水平,具有良好的抗病毒和抗炎活性.本研究结果为筛选独特的抗MDRV的候选药物提供参考,也为MDRV的预防和治疗提供新的思路.
