免疫性血小板减少症治疗新进展
2023-05-13梁子杨LiangZiyang张国扬ZhangGuoyang娜仁朵兰NarenDuolan马丽萍MaLiping
梁子杨(Liang Ziyang),张国扬(Zhang Guoyang),娜仁朵兰(Naren Duolan),马丽萍(Ma Liping)
中山大学孙逸仙纪念医院血液内科,广州 510120;
免疫性血小板减少症(immune thrombocytopenia,ITP)是以血小板减少为特征的一种获得性自身免疫性疾病,约占出血性疾病总数的1/3,严重者可发生危及生命的出血[1]。 目前国内尚无基于人口基数的ITP 流行病学数据,国外报道的成人原发ITP的发病率约为每年3.9/10 万[2⁃3]。 糖皮质激素作为一线治疗虽然短期反应率高,但长期治疗副作用大且易复发。 丙种球蛋白常用于治疗出血倾向明显的ITP,但疗效短暂[4⁃5]。 二线治疗如血小板生成素受体激动剂(thrombopoietin receptor agonists,TPO⁃RAs)、CD20 单克隆抗体等极大改善了ITP 的疗效[6],但仍有部分患者难以达到早期缓解。 随着对ITP 病理生理机制的深入研究,针对不同靶点的新药物及不同类型药物的联合治疗延长了初诊患者的缓解时间,提高了难治性患者的缓解率。 但目前国内对于新药以及联合治疗方案文献综述尚少,为进一步探索和总结ITP 治疗进展,本文就治疗ITP的多种新型药及联合治疗的研究进展进行综述。
1 ITP 的治疗现状
ITP 治疗应遵循个体化原则,在控制不良反应最小化基础上,保证血小板计数在安全水平,减少出血事件。 糖皮质激素治疗仍然是ITP 治疗的基础,对于初诊的患者,其缓解率可达60%以上,并且起效时间短,85%的患者在3 d 内均可起效[8]。 目前激素主要有两种使用方法,一是使用泼尼松1 mg/kg,持续2~3 周,后缓慢减量;二是口服或静脉使用地塞米松40 mg/d,连续4 d,无效或复发患者可以重复1 个周期[8]。 2016 年一项前瞻性多中心随机试验对比了两者的疗效差别,大剂量的地塞米松(high⁃dose dexamethasone,HD⁃DXM)治疗组中有较高的初次缓解率和完全缓解率,且起效时间更短,然而其后续的持续缓解率并无显著差别。 在安全性上,两种不良反应事件类似,而HD⁃DXM 的耐受性更好[9]。 静脉注射免疫球蛋白(intravenous immunoglobulin,IVIg)冲击治疗可用于紧急治疗,虽早期缓解率高,但大部分的患者仍然会复发[10]。 ITP 二线治疗包括脾切除术、利妥昔单抗(rituximab,RTX)以及血小板生成素受体激动剂TPO⁃RAs。 虽然脾切除术的反应率很高(一项系统回顾研究显示,脾切后中位随访29 个月,完全缓解率达66%),但由于潜在的严重并发症,如术后血栓性栓塞以及凶险性感染事件发生几率升高,加上新药的应用,现在越来越少人选择[11]。 RTX 二线治疗ITP 已有多年历史,早期反应率约为60%,但是起效时间较长,平均起效时间5.5 周[12]。 TPO⁃RAs 的出现给ITP 治疗带来了重大的改变。 第一代TPO⁃RAs 有效率在60%~90%,但国外有研究显示在健康人及化疗所致血小板减少症患者中,使用第一代TPO⁃RAs 后,体内会产生抗TPO 的抗体,血小板的数量出现了下降[13],且第一代TPO⁃RAs(PEG⁃rHuMGDF)没有提高清髓方案化疗患者的血小板计数,但在13 名接受多次注射PEG⁃rHuMGDF 的受试者中出现了抗TPO 的抗体,导致了血小板减少,该不良反应结束了此药物的所有临床试验[14]。 第二代TPO⁃RAs 与人源化TPO 无相似之处,因此不会产生抗TPO 的抗体,成功解决了第一代临床试验不良反应问题[15]。 罗米司亭、艾曲波帕作为二线药物,它们早期有效率均在80%左右,且不良反应轻微[16]。 但TPO⁃RAs 效果并不是持续的,大多数患者在停药后复发,仅不到15%患者在停药后可保持血小板稳定[17]。 此外TPO⁃RAs 价格昂贵,给病人带来的经济负担也是不容忽视的。
尽管目前ITP 可选择的治疗方案明显增多,但仍有患者使用一、二线药物未能得到缓解,这些患者的生活质量较差,死亡率较高。 因此,新的治疗方案的研发仍刻不容缓。
2 针对巨噬细胞的药物
抗体依赖的细胞吞噬是血小板抗体产生和血小板破坏的主要机制,抑制巨噬细胞的吞噬作用,是ITP 治疗的靶向途径之一。
2.1 Syk 抑制剂:福坦替尼
福坦替尼是一种口服的小分子脾脏酪氨酸激酶(spleen tyrosine kinase,Syk)抑制剂。 福坦替尼口服进入体内后,通过肠道碱性磷酸酶代谢形成有效成分R406,与脾脏细胞巨噬细胞的酪氨酸激酶结合,抑制抗体介导的吞噬作用[18]。
FIT1 和FIT2(福坦替尼组和安慰剂组)研究均为随机、双盲、安慰药对照、24 周的三期临床试验,主要区别为FIT1 主要在北美、澳大利亚和欧洲35个临床试验中心进行,而FIT2 只在欧洲23 个临床试验中心进行。 研究共纳入150 名慢性ITP 患者(中位时间8.5 年,中位血小板计数16×109/L),以2 ∶1随机分为福坦替尼组(100 mg 每天2 次,最高150 mg 每天2 次)和安慰剂组。 主要疗效终点是第24 周达到稳定反应的患者比例。 稳定反应的定义是在第14 ~24 周内6 次检测中至少有4 次血小板计数≥50×109/L。 结果显示:①总体反应率:福坦替尼组12 周内的总体缓解率明显高于安慰剂组(43%比14%,P<0.01),其中实验组83%缓解的患者在8 周内获得响应,中位反应时间为2 周。 ②稳定反应率:福坦替尼组稳定缓解率也高于安慰剂组(18%比2%,P<0.01)。 ③安全性:福坦替尼最常见的副作用是腹泻(31%)和高血压(28%),10%的病例观察到肝功能的损害(转氨酶的升高),总体不良事件(adverse events,AEs)安全可控[19]。 为研究其长期疗效,所有FIT1 和FIT2 的患者,可自愿进入FIT3。 所有入组FIT3 的患者均接受福坦替尼(100 mg每天2 次,最高调整至150 mg 每天2 次)。 与FIT1和FIT2 研究不同,FIT3 中稳定反应定义为:治疗12周内,血小板计数≥50×109/L,并且在接下来的3 次月访中,血小板计数≥50×109/L。 中位治疗时间为6.7 个月,在28 个月的随访后,总体反应为44%,稳定反应率为23%[20]。 尽管福坦替尼的疗效较低,但由于可以获得长期持续的反应,不失为治疗慢性ITP 的一种新选择。
2.2 BTK 抑制剂:利扎鲁替尼
除了Syk 抑制剂可以阻断血小板抗体介导的FcγR 信号传导外,布鲁顿酪氨酸激酶(Bruton tyrosine kinase,BTK)也参与抗体介导的FcγR 信号传导。 BTK 抑制剂不仅阻滞血小板在脾内的消耗,还可通过抑制B 细胞的活化和自身抗体的产生来减少血小板的破坏。 大家熟悉的一代BTK 抑制剂依鲁替尼,因为有出血的风险开始并未在ITP 患者中尝试[21]。
BTK 抑制剂利扎鲁替尼与依鲁替尼不同,由于它无抑制血小板聚集的功能,从而无出血副作用而更加适用于ITP 的治疗[22]。 2017 年完成I 期临床研究并显示出良好的安全性[23],随后Ⅰ/Ⅱ期临床试验证实其治疗慢性ITP 的可行性。 此研究[24]入组32 名慢性ITP 患者(中位疾病时间7.3 年,平均年龄50 岁,入组前对6 种药物的治疗无反应),可谓“极难治”,利扎鲁替尼剂量为400 mg 每天2 次,主要终点指标:血小板计数≥50×109/L 的患者比例。结果显示:①42%的患者血小板水平≥50×109/L,起效时间较快,一半患者在第1 周内血小板水平就上升至30×109/L。 ②42%的患者出现AEs,主要为恶心、腹泻等消化道反应,没有出现3 级的AEs,总体安全可控。 为进一步评估利扎鲁替尼的有效性和安全性,赛诺菲公司的一项多中心、随机、双盲、安慰剂对照、 平 行 组、 开 放 标 签 扩 展 的Ⅲ期 研 究(NCT04562766)正在进行,预计招募224 名慢性或持续性ITP 患者,目前已完成患者招募。
3 加速血小板抗体清除的药物
新生儿Fc 受体(neonatal Fc receptor,FcRn)是调节IgG 代谢的重要分子,它可回收正常或病理性IgG,延长IgG 的半衰期,促进IgG 的组织分布[25⁃26]。 ITP的主要病理驱动因素就是IgG 血小板抗体的产生,针对FcRn 的抑制剂可加速血小板抗体清除,可能成为ITP 治疗的新方向。 目前已经有两种药物处于临床开发后期,分别是Efgartigimod 和Rozanolixizumab。
3.1 Efgartigimod
Efgartigimod 可与FcRn 结合并降低循环中的免疫球蛋白(IgG)抗体水平。 一项随机、双盲、安慰剂对照Ⅱ期临床试验中[27],纳入38 名ITP 患者(中位年龄41 岁,中位持续时间4.8 年,基线血小板计数16×109/L),1 ∶1 ∶1 随机分配3 组,分别接受每周1次,连续4 周静脉输注安慰剂、Efgartigimod 5 mg/kg和10 mg/kg。 结果显示:①Efgartigimod 有效降低免疫球蛋白水平,与基线相比平均下降63.7%;②Efgartigimod组血小板至少两次≥50×109/L 的患者明显高于安慰剂组(46%比25%,P<0.01),并且10 天内血小板水平均≥50×109/L 的比例为38%(安慰剂0%),说明Efgartigimod 可以稳定提升血小板。
3.2 Rozanolixizumab
Rozanolixizumab 是一种针对FcRn⁃IgG 结合区域的单克隆抗体,不影响白蛋白以及其他类型的免疫球蛋白水平[28]。 在最近的一项多中心,开放标记的二期临床试验中,一共招募了66 名慢性ITP 患者(中位年龄54 岁,中位持续时间5.8 年),接受多次皮下注射Rozanolixizumab(累积剂量为15~21 mg/kg)。结果显示:①有效性:多次皮下注射组(每次剂量及使用次数:4 mg·kg-1·次-1,共5 次;7 mg·kg-1·次-1,共3 次;10 mg·kg-1·次-1,共2 次),血小板≥50×109/L 分别占35.7%、35.7%和45.5%,而单次皮下注射组(15 mg/kg 或20 mg/kg)血小板≥50×109/L分别占66.7%和54.5%,50%的患者在输注后第1周内达到血小板计数≥50×109/L[29]。 ②安全性:AEs 发生率77.3%,最常见的是头痛,但都是1 级到2 级不良反应,没有因AEs 导致停药情况[29]。
4 神经氨酸酶抑制剂
Peng J 等[30]在对一线治疗不佳的患者的观察中发现,抗GPIb/Ⅸ抗体比例明显升高,似乎这部分患者的血小板破坏机制可能与抗GPⅡb/Ⅲa 抗体以FcγR 依赖的方式不一样。 June Li 等[31]在小鼠中证明了抗GPⅠb/Ⅸ抗体可诱导血小板膜糖蛋白在唾液酸酶的作用下可发生脱糖效应,从而暴露出N⁃乙酰葡糖胺,其脱糖后即发生去唾液酸化,其被肝细胞去唾液酸糖蛋白受体(ashwell ⁃morell receptor,AMR)识别,进而被库普弗细胞及肝脏细胞清除,血小板的过度去唾液酸化可能是ITP 的另一种发病机制。 奥司他韦,一种治疗流感的抗病毒药物,不仅可以抑制病毒的唾液酸酶,同时可抑制血小板膜糖蛋白去唾液化水平,从而减少血小板在肝脏清除。 这一机制的提出,也在临床上难治性ITP 患者中得到印证[32]。 Shao L 等[33]报道一例抗GPⅠbα 抗体阳性的难治性ITP 患者在接受奥司他韦治疗后,获得了血小板的持续反应。 一项对10 例难治性ITP 患者的报道显示,奥司他韦治疗(75 mg 每天2 次至少持续5 d)联合TPO⁃RAs 或免疫抑制剂治疗,66.7%出现血小板反应[34]。
目前有两项Ⅰ/Ⅱ期临床试验正在中国及加拿大进行。 候明教授团队对96 例年龄≥18 岁的初诊ITP 患者进行了临床试验,随机分配(1 ∶1)地塞米松联合奥司他韦治疗组(地塞米松40 mg/d,共4 d,联合奥司他韦75 mg 每天2 次,共10 d)或地塞米松单药治疗组(地塞米松40 mg/d,共4 d)。 结果显示:①地塞米松联合奥司他韦治疗组较地塞米松单药治疗组患者具有更快的初始应答率(86%比66%,P=0.030),以及更长的持续缓解率(53%比30%,P=0. 032)[35]。 ②在 地 塞 米 松 组,36% 患 者 抗GPⅠb/Ⅸ抗体阳性,患者的初始反应率明显低于无抗GPⅠb/Ⅸ抗体的患者(33%比77%,P=0.009)。而对于有抗GPⅠb/Ⅸ抗体的患者,接受地塞米松+奥司他韦组和接受地塞米松组在初始反应率上有差异,但无统计学意义(71%比33%,P=0.066)。 ③二组患者的AEs 发生率分别为35%比26%,未见统计学差异。
综上所述,奥司他韦在ITP 的治疗中和其他药物针对的靶点不同,可能可以提高初治GPⅠb 抗体阳性ITP 患者的应答率。
5 去甲基化药物
地西他滨是一种去甲基化药物,广泛用于血液系统恶性疾病[36]。 近年来,多项研究发现ITP 患者外周血单核细胞DNA 甲基转移酶mRNA 表达降低,血浆S⁃腺苷同型半胱氨酸浓度升高[37],显示DNA 甲基化与ITP 的发病存在一定关系。 Zhou Hai等[38]使用低剂量地西他滨在体外培养巨核细胞,发现可明显增加成熟的多倍体巨核细胞的数量。 此外,与对照组相比,从这些巨核细胞中释放的血小板明显增加[38]。 表明低剂量地西他滨可以促进巨核细胞成熟和血小板的释放。 在ITP 小鼠模型中,低剂量地西他滨显著增加ITP 小鼠的血小板水平,同时增加小鼠脾脏CD4+T 细胞中Treg 细胞数量,降低Th1 和Th17 细胞数量[39]。 这些研究表明,低剂量地西他滨可从不同机制改善ITP 血小板的水平。
中国的一项低剂量地西他滨对难治性ITP 患者的前瞻性多中心研究显示了地西他滨的治疗效果[40]。 此研究对象为对脾切除术没有反应或不能耐受接受脾切除术的成年ITP 患者,并基线血小板计数低于30×109/L 或存在出血症状。 治疗方案为地西他滨3.5 mg/m2的静脉注射,每个周期连续3 d,共3 个周期,各周期间隔4 周。 主要终点为地西他滨治疗结束时的血小板水平,包括部分反应(血小板计数>30×109/L)、完全反应(血小板计数>100×109/L)。 研究入组了45 名患者,有8 名患者(17.78%)获得完全反应,15 名患者(33.33%)获得部分反应。 反应的中位时间为28 d。 此外,7 名复发患者接受了地西他滨的再治疗,都出现了血小板反应,包括1 例完全反应和6 例部分反应。 6 个月、12 个月和18 个月的持续反应率分别为44.44%(20/45)、31.11%(14/45)和20.0%(9/45)。 13 名(28.89%)患者出现了不良事件,无三级的不良事件。
6 联合治疗
ITP 具有复发性、异质性以及不稳定性的特点促使众多的新药的出现。 单一疗法难以维持ITP 的长期缓解,因此国内外学者提出联合治疗的观点,以期利用不同药物的结合延长患者的缓解时间并提高难治性ITP 的缓解率[41⁃42]。
联合治疗药物的选择主要从两方面考虑,一是不同机制的药物联合使用,如促血小板生成药物与免疫抑制剂的联合:促血小板生成药物通过与MPL结合,刺激造血干细胞向巨核细胞增殖分化[43],而免疫抑制剂如激素、环孢素等主要是抑制B 细胞功能,减少血小板破坏或血小板抗体产生[44];全反式维甲酸(all⁃trans⁃retinoicacid,ATRA)与免疫抑制剂的联合:近年来发现ATRA 具有免疫调节的作用,不仅可以恢复Th1/Th2 及Th17/Treg 的平衡,且可扭转ITP⁃BMSC 的功能缺陷,在不同作用靶点的药物联合治疗后可显著稳定提升血小板水平[45]。 二是不同时间窗的药物联合使用,例如RTX 的起效时间较长,平均起效时间5.5 周[46],而免疫抑制剂或rhTPO 起效时间快,但不能达到长期缓解[43],故RTX 联合免疫抑制剂或RTX 联合rhTPO 可克服利妥昔单抗较长平均反应时间的问题。
近五年来,大量的联合治疗临床研究涌现,其中一线联合包括了艾曲波帕联合大剂量地塞米松治疗新诊断成人ITP 的Revolade 研究、山东大学齐鲁医院发起的rhTPO 联合地塞米松一线治疗ITP 的Ⅲ期临床试验、北京大学人民医院血液病研究所发起的全反式维甲酸联合塞米松一线治疗ITPⅡ期临床试验等,它们都显示了联合治疗初治和长期疗效均显著优于单药治疗,且AEs 的发生率并无明显差异(具体数据见表1)。 在ITP 二线治疗的探索中,RTX 联合ATRA、RTX 联合达那唑以及RTX 联合rhTPO 方案分别较于单药RTX、单药达那唑以及单药RTX 方案,均显示了更好的疗效。 RTX 联合ATRA、RTX 联合达那唑均提高了总缓解率及持续缓解率,而RTX 联合rhTPO 虽在长期疗效上与RTX 单药对比无明显差异,但显著增加短期完全缓解率并缩短达缓解时间(具体数据见表1)。
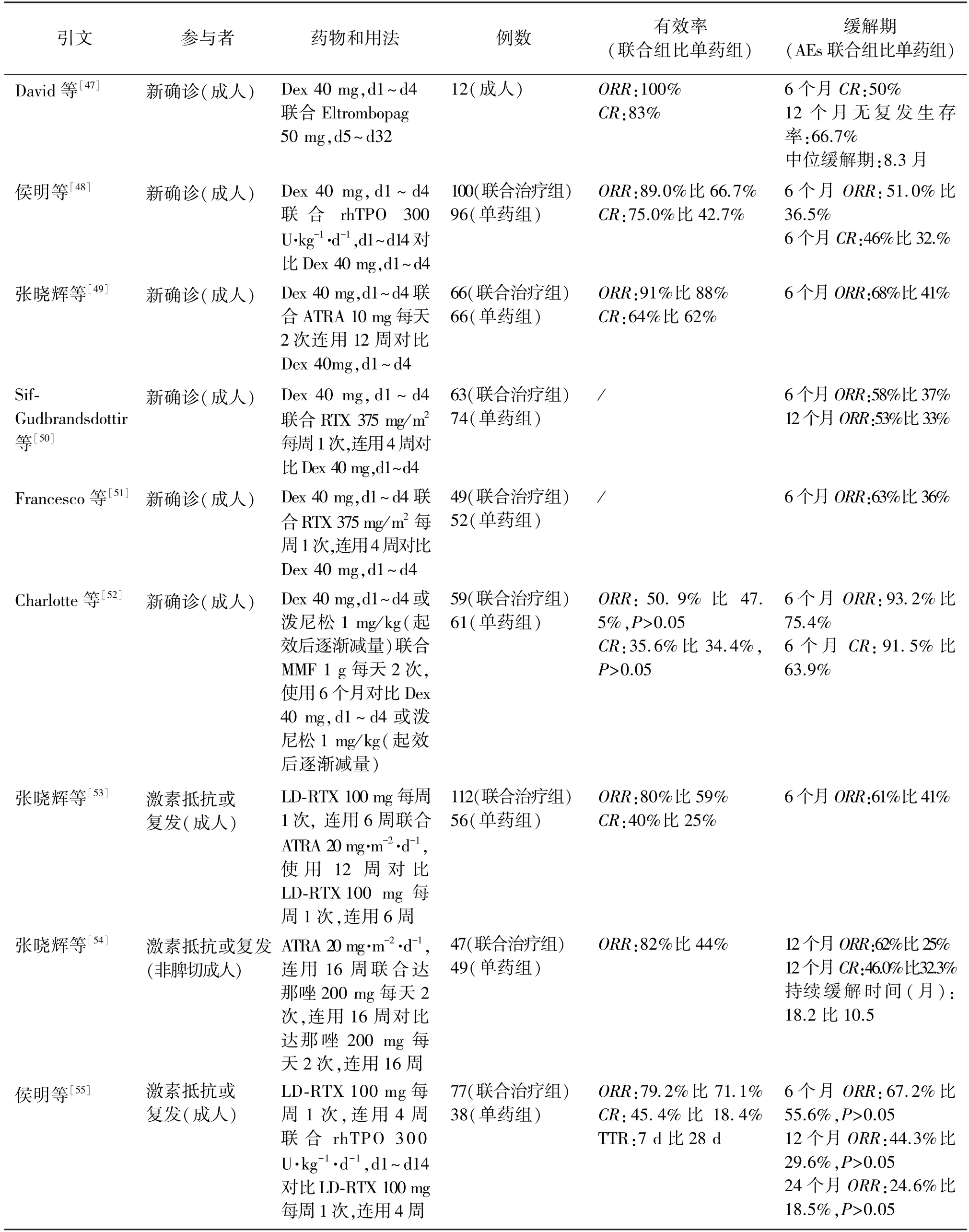
表1 ITP 的联合治疗
7 总结
近几十年来,ITP 激素作为一线治疗药物的地位没有改变。 虽然早期反应率高,但难以完全缓解或持续缓解,最终都会进展为慢性ITP,且药物不良反应多。 ITP 发病机制十分复杂,涉及免疫应答的各个环节,并非单一因素所致。 抗血小板抗体的过量产生、Treg/Th17 比例失衡、巨核细胞产板不良等均参与了ITP 的发生发展,并且ITP 患者个体性差异巨大,更加需要我们精准化的治疗。 近年来不同靶点药物的开发以及联合用药的出现,不仅为ITP精准化治疗提供了多样的选择,也为患者提供了比老式免疫抑制剂更高的持续反应的效果。 但由于以上新药仅在小规模患者人群应用、观察时间短、应用经验不足等,整体的疗效尚不理想或不明确,期待更多大宗临床研究数据。
作者贡献声明梁子杨负责论文撰写;张国扬、娜仁朵兰、马丽萍负责指导与修订
利益冲突所有作者均声明不存在利益冲突
