α-红没药醇药理作用研究进展*
2023-05-13何美幸
何美幸,韩 凌,朱 伟
(广州中医药大学第二临床医学院/广东省中医院,广东 广州 510006)
洋甘菊(Matricaria chamomiliaL.),别名母菊,是菊科(Compositate)母菊属(Matricaria)一年生草本,具有清热解毒、止咳平喘等功效,主产于我国新疆和欧洲等地。α-红没药醇(α-Bisabolol,α-Bis)是一种主要来源于洋甘菊等植物中的倍半萜醇,其被认为是洋甘菊发挥药效的主要物质基础。现代药理研究表明,α-红没药醇具有抗炎、抗肿瘤、镇痛、抗寄生虫、抗阿尔茨海默病、保护肾脏等多种药效作用,具有很大的开发价值及临床应用前景。笔者系统归纳了近年来国内外已经发表的有关研究,对α-红没药醇的生物活性进行综合阐述,为促进α-红没药醇的深度研发及综合应用提供参考。
1 α-红没药醇的一般理化性质
α-Bis化学式为C15H26O,结构式为(2R)-6-methyl-2-[(1R)-4-methylcyclohex-3-en-1-yl]hept-5-en-2-ol,为无色透明液体,几乎不溶于水而微溶于乙醇。有(-)-α-和(+)-α-两种同分异构体。新疆产的洋甘菊(Matricaria recutitaL.)经水蒸馏法提取后,通过GC-MS对洋甘菊挥发油进行成分分析,得到α-BisB(48.53%)、α-BisA(25.49%)、BisA(18.89%)的结论[1],更有学者对不同产地洋甘菊中的α-Bis质量浓度进行检测,发现德国洋甘菊中α-Bis的质量浓度为0.045 mg/mL,但在罗马洋甘菊未测出α-Bis[2]。此外,α-Bis可通过洋甘菊原材料提取分离得到,亦可通过化学合成得到[3-4]。药代动力学调研[5]发现,α-Bis是CYP2D6的强抑制剂(IC50=2.18 μmol/L),同时亦是CYP2C9的中度抑制剂(IC50=46.11 μmol/L),证明其具有优良的细胞色素P450抑制谱,可抑制人类主要药物代谢酶活性。口服α-Bis可被有效吸收,口服生物利用度为17.24%。由于其极性和脂溶性很强,也可被皮肤有效吸收,经查询相关数据库,发现其皮肤渗透系数为-4.97 cm/s,其结构式见图1。
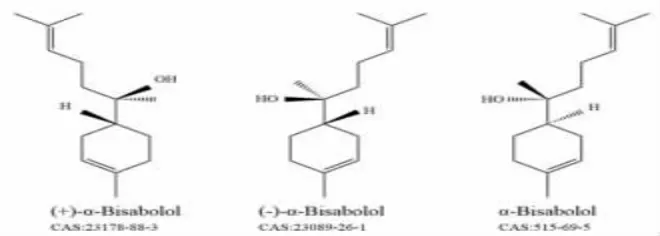
图1 α-红没药醇的化学结构式
2 α-红没药醇药理活性
2.1 抗炎 α-Bis作为一种具有一个羟基、两个双键架构的极性极强的化合物,在金黄色葡萄球菌、大肠杆菌、大肠埃希菌、白色念珠菌等多种病菌中发挥主要的抗炎作用。MUÑOZPÉREZ V M等[6]研究发现,在人妊娠子宫肌层标本的抗炎研究中,α-Bis可显著降低TNF-α和IL-1β炎症因子表达,减轻炎症水平。KHALESI Z B等[7]通过收集各个数据库中洋甘菊治疗经前期综合征的疗效,进行了系统综述,得出洋甘菊对经前期综合征的治疗是有效的,并且发现α-Bis具有良好的抗炎作用。OLIVEIRA F DE S等[8]通过对α-Bis、β环糊精及二者联用的抗菌作用的研究,发现α-Bis与诺氟沙星联合使用对金黄色葡萄球菌有协同功效,与庆大霉素合用对大肠杆菌有增效作用,证明α-Bis对庆大霉素等一些抗生素具有协同调节功效。另有研究发现,α-Bis可作为指间毛癣菌潜在的抗真菌药物和灰黄霉素的敏感性调节剂[9]。D’ALMEIDA A P L等[10]通过将α-Bis制备于脂质核纳米胶囊(LNCs)给药系统,在脂多糖诱导的急性呼吸窘迫综合征小鼠模型中,α-Bis-LNCs(α-Bis制备于LNCs给药系统)显著改善了气道高反应性和肺组织损伤的症状,极大降低了中性粒细胞浸润、MPO活力、趋化因子KC和MIP-2的表达能力,并且其明显降低了ERK1/2、JNK和p38蛋白的磷酸化水平。JAHANSHIRI Z等[11]为寻找抗真菌的化合物,发现α-Bis是麦角甾醇生物合成途径的关键酶,通过影响微粒体Δ24-甾醇甲基转移酶进而抑制烟曲霉菌Af239的生长,说明α-Bis对Af239有强烈的抑制作用。FERNANDES M Y D等[12]发现(-)-α-Bis通过减少小鼠永久性局灶性脑缺血诱导的促炎标志物来防止神经元损伤和记忆缺陷,提出(-)-α-Bis对神经保护作用可能是由于其抗炎活性。RODRIGUES F F G等[13]对菊科香草挥发油及其主要活性成分α-Bis进行了体外抑菌活性评价,结果发现,α-Bis与抗生素联用对白色念珠菌、大肠埃希菌、金黄色葡萄球菌等菌株均有协同作用,是抗菌药物和辅助治疗的潜在化合物。CAVALCANTE H A O等[14]在盲肠结扎穿刺诱导的C57BL/6小鼠全身性感染炎症模型中,(-)-α-Bis减少了腹腔白细胞募集和血液中的细菌数量,提高了小鼠肺组织MPO活性,减少了NO的产生,从而提高了动物模型的存活率。XU C等[15]利用晚期糖基化终末产物(AGEs)处理人软骨细胞,以模拟骨关节炎在体外的进展,发现(-)-α-Bis通过阻滞NF-κB、p38和JNK信号通路抑制炎症反应和ECM变性,可见(-)-α-Bis在骨关节炎治疗中的潜能。
2.2 抗肿瘤 目前用于临床治疗肿瘤的药物由于机制单一,逐渐出现耐药性,并且具有一定的毒副作用,故寻找多靶点、高效、广谱、天然、无毒的小分子化合物成为必然。α-Bis可靶向多种信号分子,具有多重机制,对子宫内膜癌、胰腺癌、胶质母细胞瘤、非小细胞肺癌等多种肿瘤细胞具有较强抑制作用。
QUINTANILHA N P等[16]研究探讨了α-Bis单体对猪口腔黏膜5-氨基乙酰丙酸渗透性的影响,发现其可以用于肿瘤光动力治疗,可提高局部口服给药后的保留率。FANG D等[17]同样基于α-Bis研究了其对子宫内膜癌的影响,结果表明,α-Bis可通过干扰癌细胞周期过程,减少MMP-9和cyclin E的表达而抑制癌细胞,还可通过诱导癌细胞凋亡起杀伤作用,机制研究表明α-Bis在放疗中是通过XIAP/caspase-3通路促进癌细胞凋亡的。α-Bis还被广泛用于胰腺癌的治疗研究,UNO M等[18]发现α-Bis可通过激活胰腺癌细胞KISS1R受体而抑制癌细胞侵袭。α-Bis通过脂筏进入细胞内,除与KISS1R受体相互作用外,还可作用于上皮-间充质转化机制,与胰腺癌周围脂肪组织和结缔组织反应,甚则通过Wnt、NF-κB和TGF-β发挥抗癌作用。在一项胶质母细胞瘤研究中,闫海斌等[19]发现α-Bis通过下调c-Met通路,可抑制胶质母细胞瘤细胞U251和U87的侵袭和迁移。WU S等[20]研究了α-Bis在体外对NSCLC细胞的细胞活力和细胞周期进程的抑制作用,结果显示,α-Bis通过诱导细胞周期阻滞、线粒体凋亡和阻滞PI3K/AKT信号通路对A549 NSCLC细胞具有选择性抗癌功效。MENDES F B等[21]研究α-Bis对多形性成胶质细胞瘤细胞脂筏中存在的腺苷酶CD73的影响,结果发现α-Bis可降低C6和U138-MG胶质瘤细胞存活率,同时增加了CD73的活性。在一项α-Bis新型衍生物对胰腺癌的抗癌功能研究[22]中,新设计合成的α-Bis衍生物对诱导胰腺癌细胞系的凋亡水平高于母体α-Bis化合物,尤其是衍生物[(2S)-6-methyl-2-(4-methylcyclohex-3-en-1-yl)hept-5-en-2-yl(Z)-3-acetoxybut-2-enoate]抑制了异种移植瘤生长,减少了胰腺癌向腹膜结节的扩散,抑制了腹膜结节中AKT的表达,与抗癌作用一致,由此表明,α-Bis衍生物通过抑制AKT有效地阻止胰腺癌的进展。张全书等[23]研究了α-Bis对肝损伤的影响,结果显示,α-Bis可以减少小鼠急性肝损伤的肝细胞凋亡数量。
2.3 镇痛 近年来,研究发现α-Bis对神经源性疼痛、慢性炎症性疼痛和术后疼痛等方面有显著改善作用。MELO L T等[24]对(-)-α-Bis化合物的镇痛作用展开了一系列深入探究。小鼠上唇或大鼠颞下颌关节注射福尔马林诱导口面疼痛模型后,(-)-α-Bis可缓解大小鼠口面部疼痛。在进一步的分子对接模拟探讨中,(-)-α-Bis与TRPA1的高结合亲和力在体内实验得到证实,其中TRPA1受体拮抗剂HC-030031以与(-)-α-Bis类似的方式结合,可在数量和质量上减轻动物疼痛。进一步动物实验研究发现,在眶下神经损伤诱导的大鼠急性三叉神经痛模型中,(-)-α-Bis减轻了大鼠的痛觉行为[25]。ORTIZ M I等[26]也发现(-)-α-Bis有类似的镇痛作用,进一步探索发现(-)-α-Bis发挥的外周镇痛作用未被阿片受体抑制剂阻断,其机制为(-)-α-Bis激活NO-cGMP-K+通路产生镇痛作用。该课题组进一步研究α-Bis和双氯芬酸对大鼠痛觉、炎症和胃损伤的药理作用,结果表明,α-Bis和双氯芬酸联用使用比单独使用双氯芬酸造成的胃损伤程度更轻,且联合使用起到更好的抗炎和镇痛作用[27]。GADOTTI V M等[28]发现,来源于大麻植物的α-Bis明显抑制了tsA-201细胞中Cav3.2通道蛋白的表达,以及小鼠背根神经节中固有T型通道蛋白的表达,表明了α-Bis通过抑制Cav3.2 T型钙通道蛋白起到广泛的镇痛作用。TEIXEIRA G F D等[29]则将α-Bis制备于纳米胶囊中以检测其对高渗盐水诱导的小鼠角膜痛觉反应,结果显示,其可显著减少小鼠的痛觉行为数量。FONTINELE L L等[30]在小鼠慢性炎症性疼痛模型中,发现(-)-α-Bis减轻了小鼠痛觉过敏,抑制了细胞因子TNF-α的释放,刺激了IL-10的释放,抑制了IBA-1在脊髓中的表达,提示(-)-α-Bis是治疗慢性疼痛的理想分子。并且该课题组在小鼠部分坐骨神经损伤引起的神经性疼痛模型中,发现(-)-α-Bis的抗痛觉过敏作用与减少活性胶质细胞的增生有关,可导致调节促炎和抗炎性细胞因子的释放,提出其可能与TRPA1的拮抗作用有关。AMORASILVA B F等[31]则将α-Bis制备成漱口水用于治疗颌面部手术术后并发症,在临床试验中发现,以α-Bis为基础的漱口水在改善口腔卫生、促进伤口愈合、减少术后疼痛方面的疗效与0.12%的洗必泰等效。
2.4 抗寄生虫 多个药理研究表明,α-Bis可通过诱导寄生虫细胞凋亡而起到抗寄生虫的作用。CORPAS-LÓPEZ V等[32]发现(-)-α-Bis软膏和口服治疗中均能降低利什曼病感染的仓鼠皮肤寄生虫载量,在2.5%的局部治疗中,病灶厚度减少到56%,比对照组锑巴葡胺具有更好的疗效。在(-)-α-Bis对利什曼病原体的进一步研究中,利用髓源性巨噬细胞评估了(-)-α-Bis在热带利什曼原虫前鞭毛体和胞内无鞭毛体的作用,并对L929成纤维细胞进行了细胞毒性研究,发现(-)-α-Bis诱导的氧化应激、线粒体去极化和磷脂酰丝氨酸外化(细胞凋亡的标志)具有时间和剂量依赖性,在超微结构分析中,处理后的寄生虫存在线粒体断裂,存在电子密集结构和染色质凝聚。结果表明,(-)-α-Bis在不干扰质膜的情况下诱导利什曼原虫的氧化应激和线粒体依赖性凋亡。同样的,该实验室基于(-)-α-Bis对自然获得的利什曼病犬进行了深入的临床试验,发现(-)-α-Bis除了可有效降低寄生虫载量,还可增加γ-干扰素的表达水平,结果优于对照药锑巴葡胺,机制为(-)-α-Bis可能通过诱导Th1免疫反应,从而改善病犬皮肤的临床症状[33]。HAJAJI S等[34]得出同样的结论,(-)-α-Bis通过激活寄生虫前鞭毛体阶段的程序性细胞死亡过程,进而引起磷脂酰丝氨酸外化和膜损伤,降低线粒体膜电位和总ATP水平。在(-)-α-Bis对克氏锥虫Y株的抗寄生虫作用中,发现(-)-α-Bis的生物效应与诱导凋亡、胞浆ROS升高和线粒体跨膜电位升高有关[35]。另一项研究[36]表明,(+)-α-Bis在巨藻叶挥发油中的含量为93.7%,对阴道毛滴虫也有显著的抑制活性(IC50=98.7 μg/mL)。HAJAJI S等[34]观察到α-Bis能诱导阿米巴原虫细胞凋亡,增加质膜的通透性,降低线粒体膜电位和ATP水平,表明α-Bis对阿米巴滋养体期有杀虫活性。BALDISSERA M D等[37]则在锥虫对α-Bis和含有α-Bis的固体脂质纳米粒(SLN-B)的体内外敏感性研究中发现,在体外,当浓度为0.5%、1%和2%时,均观察到(-)-α-Bis和SLN-B的锥虫杀灭效果,当浓度为1%和2%时,与化疗(重氮氨苯脒乙酰甘氨酸盐,D.A.)相比,表现出更快的锥虫杀灭效果。而在体内,用1.0 mL/kg浓度的(-)-α-Bis和SLN-B连续灌胃7 d的情况下,D.A. 和SLN-B联用治疗锥虫感染的小鼠,其疗效为50%,比单独使用D.A.和SLN-B的疗效(16.66%)更好,提示D.A.和SLN-B联用使用可作为提高D.A.治疗效果的替代方法。
2.5 保护肾脏 保护肾脏作用是α-Bis近几年最新发现的药理作用,这进一步扩展了α-Bis在保护肾脏领域的潜在作用。SAMPAIO T L等[38]在(-)-α-Bis对缺血-再灌注急性肾损伤(I/R)的大鼠模型中,发现(-)-α-Bis可改善I/R引起的蛋白尿和微量白蛋白尿的状况,也降低了KIM-1水平。组织学上,(-)-α-Bis减轻了I/R引起的形态学改变、血管充血和管内蛋白质沉积,还降低了肾组织中TBARS和GSH的水平。体外实验[38]证明,(-)-α-Bis能够保护I/R引起的细胞损伤。在进一步的(-)-α-Bis介导的HK2细胞I/R损伤后的肾保护机制研究中[39],发现(-)-α-Bis降低了I/R诱导的细胞损伤,保护了HK2细胞免受I/R引起的氧化损伤,这种作用与抑制细胞凋亡、减少KIM-1的释放、ROS的积累和线粒体功能障碍有关。MAGALHES E P等[40]
在(-)-α-Bis对两性霉素B(AmB)诱导的上皮肾细胞毒性的保护作用研究中,发现(-)-α-Bis预处理组细胞活力明显高于单纯使用AmBIC50组,并且能够防止AmB治疗引起的坏死和晚期凋亡。其作用机制与ROS积累的减少、跨膜线粒体电位的增加和对肾小管细胞损伤的保护有关,尤其是其抑制了KIM-1的释放。
2.6 抗阿尔茨海默病 近年来,α-Bis在阿尔茨海默病研究方向引起了新关注。研究发现,α-Bis可通过抗淀粉样变而起到抗阿尔茨海默病的作用。SHANMUGANATHAN B等[41]通过α-Bis对Aβ25-35诱导的PC12细胞神经毒性的抗淀粉样变和抗凋亡研究中,从ThT的荧光强度可发现α-Bis与Aβ25-35共孵育24 h后,Aβ聚集趋势降低。CLSM、TEM、FTIR和分子动力学模拟证实,α-Bis对Aβ纤维形成的抑制作用在培养9 d后仍然存在。抗聚集和解聚实验显示,α-Bis与Aβ25-35共给药组荧光强度大幅降低。流式细胞术表明,α-Bis能阻止PC12细胞免受Aβ25-35诱导的神经毒性和染色体损害。同时,克隆实验也证实了其保持细胞集落存活的能力。由此得出α-Bis具有抗淀粉样变和抗凋亡的作用。进一步研究褐藻裸子植物主要活性成分α-Bis作用于Neuro2a细胞及转基因秀丽隐杆线虫阿尔茨海默病(AD)模型中,体外研究展示,α-Bis修复了Aβ25-35刺激的细胞内脂质氧化和蛋白的变化,抑制了Neuro2a细胞胆碱酯酶和β分泌酶活性,减少了ROS和RNS的生成。α-Bis给药组Bax、caspase-3等凋亡蛋白表达能力降低,证明α-Bis具备抗凋亡功效。体内调研发现,α-Bis对Aβ25-35介导的AD转基因秀丽隐杆线虫蛋白质毒性发挥神经保护功能,它改变了Aβ介导的通道、寿命、大分子损害,并调低ace-1、hsp-4、Aβ的AD有关基因表达,从而抑制了Aβ的合成,表明α-Bis对Aβ介导的AD病理具有神经保护作用[42]。
2.7 其他药理作用 现代药理研究表明,α-Bis还具有抗氧化、保护心肌等药理作用,其可通过抗氧化而对心肌细胞起潜在的保护作用。调查[43]发现,在α-Bis对异丙肾上腺素刺激的大鼠心肌梗死模型中,大鼠血浆和心脏组织血清肌酸激酶和肌酸激酶-MB活力增加,脂质过氧化产物水平/浓度和非酶状况得到调整,结果表明,α-Bis具备抗脂质过氧化和抗氧化作用,对异丙肾上腺素介导的心肌梗死具有潜在的保护作用。进一步的机制研究[44]表明,α-Bis通过抑制NLRP3炎症小体活性和TLR4/NF-κB/MAPK信号通路,纠正溶酶体功能障碍和自噬通量受损,从而减轻氧化应激和炎症反应。因此,抗氧化、清除自由基和抗炎作用是其保护心脏的药理和分子机制[33]。LEONG H J等[45]则将α-Bis和苯乙基间苯二酚制备成双功能二氧化钛复合物,用表面活性剂辅助溶胶-凝胶法合成直径约1 μm的TiO2微球,用ABTS、DPPH比色法进行自由基抗氧化能力评估,得出α-Bis功能化微球具有清除ABTS(·)和DPPH(·)自由基能力的结论。JAVED H等[46]发现α-Bis在鱼藤酮诱导的帕金森病模型大鼠中,α-Bis治疗不仅可显著预防黑质和纹状体多巴胺能神经元和纤维的损伤,还可减轻氧化应激,主要体现在抑制MDA的产生和GSH的损失及增加SOD和CAT的活性方面。
3 总结与展望
综上所述,α-Bis作为洋甘菊的活性成分,安全无毒,具有多种药理作用,其中抗炎、抗肿瘤、镇痛、抗寄生虫药理作用研究广泛、论据充分,目前已被广泛应用于临床,尤其是其可通过多靶点、多途径抑制肿瘤细胞的增殖并诱导细胞凋亡。α-Bis抗阿尔茨海默病、保护肾脏和保护心肌的药理作用则是新近的科学发现,但α-Bis的作用靶点和作用机制尚未完全明确,其研究值得进一步探索,仍需加强对基础及临床的研究以证实其机制。随着现代分析技术的不断进步,今后可采用代谢组学、网络药理学、分子生物学及高通量检测技术深入开展对α-Bis抗阿尔茨海默病、保护肾脏和保护心肌等药理作用的研究,从而不断扩大α-Bis的临床应用,为开发α-Bis的临床应用提供理论依据。
