基于网络药理学探讨毒结清复方对多发性骨髓瘤的作用机制及实验验证*
2023-05-13郭一慧许家威程纬民陆海颂
雷 宇,郭一慧,许家威,程纬民,何 艾,曾 清,陆海颂
(1.广西中医药大学第一附属医院,广西 南宁 530023;2.广西中医药大学研究生院,广西 南宁 530001)
多发性骨髓瘤(multiple myeloma,MM)是一种以骨髓中单克隆浆细胞恶性增殖为特征的浆细胞疾病,其主要临床表现为骨痛、骨质破坏、肾功能不全、高钙血症及贫血[1]。MM发病率在世界范围内呈上升趋势,目前估计全球发病率为7/10万,比1975年增加143%。随着免疫调节剂、蛋白酶体抑制剂、抗体类、具有新型作用机制的靶向药物及嵌合抗原受体T细胞(CAR-T)等治疗手段的普及,患者的生存期显著延长,MM中位生存期现为7~10年[2]。由于医疗费用高昂,临床患者仍多选择多次长期诱导化疗及对症治疗,随之而来的毒副作用、易复发、疗效不理想等问题常使疗程受到中断[3-4]。我们迫切需要开发疗效确切并且毒副作用小的中药复方来减轻治疗毒副反应,从而达到改善患者预后的目的。基于中医“扶正祛邪”“标本兼治”理论开发的毒结清复方,是广西中医药大学第一附属医院根据多年治疗肿瘤的临床经验并结合当地医家治疗癌病的验方制成的院内制剂。该制剂具有化瘀毒、散癌结、益气阴、健脾肾之功效。临床研究[5-6]发现,毒结清复方可较好地改善骨髓瘤患者的骨痛症状。基础研究[7-8]发现,除治疗骨髓瘤外,毒结清复方还可以通过去甲基化来抑制肺癌小鼠体内肿瘤的增殖。因此,考虑毒结清具有多靶点、多通路抑制肿瘤细胞增殖的机制。本研究基于网络药理学及实验验证探讨毒结清复方治疗MM的机制,旨在为临床应用提供理论依据。
1 材 料
1.1 数据库与软件 (1)中药系统药理数据库和分析平台(TCMSP,http://tcmspw.com/tcmsp.php);(2)高通量中药实验和参考数据库(本草组鉴,https://www.herb.ac.cn);(3)UniProt全球蛋白资源数据库(UniProt,https://www.uniprot.org/);人类基因数据库(GeneCards,https://www.genecards.org);(4)功能蛋白结合网络数据库(String,https://www.string-db.org);(5)R语言(version 3.4.1);(6)软件Cytoscape 3.8。
1.2 实验细胞 RPMI-8226细胞株购于武汉普诺赛生命科技有限公司,于-180 ℃液氮环境下保存。
1.3 实验动物 20只SPF级SD雄性大鼠,体质量为(200±20)g,购于长沙市天勤生物技术有限公司,实验动物生产许可证号:SCXK(湘)2019-0014,饲养于广西中医药大学SPF级实验室,动物饲养环境温度为(23±2)℃,相对湿度为(50±10)%,12 h光照/12 h黑暗循环,自由摄食饮水,饲料和饮用水均高压消毒,所用大鼠实验前均适应性饲养1周。经广西中医药大学伦理委员会审核批准后开展实验,批准编号:approval NO.DW20220511-079。
1.4 药物与试剂 毒结清复方,方药组成:人参10 g,黄芪20 g,补骨脂15 g,菟丝子15 g,白术30 g,薏苡仁15 g,当归10 g,三七8 g,沉香1.5 g,川芎10 g,蟾皮5 g,土鳖虫5 g,蕲蛇10 g,佛手8 g,解毒草20 g,土茯苓30 g,八角莲20 g,白花蛇舌草20 g,八月札10 g,山慈菇10 g,蜈蚣半条。上述中药饮片均购于广西中医药大学第一附属医院,并经广西中医药大学第一附属医院药学部文隽主任药师鉴定合格。胎牛血清(批号:12B052)购自ExCell Bio公司;青链霉素混合液(批号:P1400)购自Solarbio公司;CCK8试剂(批号:BS350B)购自Biosharp公司;兔抗人β连接蛋白(β-catenin)一抗(批号:00103090)、兔抗人Wnt1一抗(批号:00095183)、兔抗人周期蛋白D1(cyclinD1)一抗(批号:10016419)均购自Proteintech公司;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH-抗)(批号:22004515)、山羊抗GAPDH兔IgG HRP标记二抗(批号:22004515)均购自Biosharp公司。
1.5 主要仪器 Mini-protean tetra蛋白垂直电泳系统(美国Bio-Rad公司);TY-201-01 M-Blot快速转膜仪(南京中科通仪科技有限公司);Multiskan FC酶标仪(赛默飞世尔科技公司);AI 600多功能成像仪(美国GE公司)。
2 方 法
2.1 网络药理学预测
2.1.1 获取毒结清复方中药物的活性成分与靶标蛋白 将毒结清复方中的“人参”“黄芪”“补骨脂”“菟丝子”“白术”“薏苡 仁”“当 归”“三 七”“沉 香”“川 芎”“蜈 蚣”“蟾 皮”“土 鳖 虫”“蕲蛇”“佛手”“解毒草”“土茯苓”“八角莲”“白花蛇舌草”“八月札”“山慈菇”输入TCMSP中,设定口服生物利用度(oral bioavailability,OB)≥30%、类药性(drug-likeness,DL)≥0.18,筛选出该方每味中药的有效成分及其对应的靶标蛋白。未收录在TCMSP的中药,利用本草组鉴数据库搜索获取中药对应成分,再将成分输入至TCMSP,根据成分对应的OB及DL值,筛选具有活性的中药成分,并获取该成分相应的靶标蛋白。利用Uniprot的Swiss-Prot子数据库对上述获得的靶标蛋白进行统一规范化注释,获取靶标蛋白对应的基因名称。
2.1.2 筛选MM疾病靶点 以“Multiple Myeloma”为关键词在GeneCards数据库搜索,得到MM疾病靶点。
2.1.3 潜在治疗靶点获取与蛋白交互网络构建及分析 在R语言环境下,将毒结清复方的靶标蛋白与MM疾病靶点基因取交集,得到交集靶点,即毒结清复方治疗MM的潜在治疗靶点,在线绘制韦恩图将交集靶点可视化。将潜在治疗靶点导入到String数据库中,将最低交互要求分数设为0.9,构建交集靶点的蛋白交互网络(PPI),使用Cytoscape插件Cytohubba插件对PPI网络计算拓扑参数[最大团中心性(maximal clique centrality, MCC)、节点度值(degree centrality, DC)、接近中心度(closeness centrality, CC)、介数中心度(betweenness centrality, BC)]值,若交集靶点的以上4个参数值均大于各参数均值,即为核心靶点。
2.1.4 核心靶点的富集分析 利用R语言中的clusterProfiler包,对核心靶点进行GO及KEGG富集分析,设置P<0.05,并根据P值大小,对结果升序排序,将前20条目结果可视化。
2.2 体外细胞实验2.2.1 细胞培养 人多发性骨髓瘤RPMI8226细胞培养于含有10%胎牛血清和1%青链霉素混合液的完全培养基中,置于37 ℃、5%CO2的恒温箱中培养,2~3 d换液,当细胞密度达到3×105~2×106个/mL,以1∶3传代。取处于对数生长期且生长状态良好的细胞用于后续实验。
通过南通地名变迁,考察南通社会的发展变迁,社会进步,从而产生对社会的认可、对社会制度的理解、对社会环境资源配置的厚重感。南通从条件恶劣转变为不受气候天灾影响,从最偏僻唯恐避之不及的边疆转变为各方打工者怀揣梦想追逐之地,从只能从事围土晾晒的制盐业发展到农工商各行业发达;从少有文明种子播撒的蛮荒之地进化为尊师重教已经内化为传统习俗的文明之所,通过历史演变激发可以民众爱家乡爱国热情。
2.2.2 血清制备 毒结清复方水煎剂的制备:将毒结清复方按照原方剂量称取,加10倍量纯水,浸泡30 min,煎煮30 min,过滤并收集原药液。剩余药渣中再加入8倍量纯水,煎煮20 min,过滤并收集滤液,此过程重复2次。合并3次滤液,浓缩至生药浓度为1.4 g/mL的毒结清复方水煎剂,4 ℃保存备用。
20只SD大鼠适应性饲养3 d,并随机分为毒结清复方组、正常组,每组10只。毒结清复方组大鼠灌胃给予2 mL 1.4 g/mL毒结清复方水煎剂;正常组大鼠灌胃2 mL PBS,2次/d,连续7 d。末次灌胃后2 h,麻醉下于无菌环境下腹主动脉采血。全血于室温静置1 h,3 000 r/min离心15 min,取出上层血清,于56 ℃水浴30 min灭活,-80 ℃冰箱贮藏,备用。使用RPMI-1640培养液配置含有20%、10%、5%含药血清的培养液,0.22 μm滤膜过滤除菌后使用。
2.2.3 CCK-8法检测RPMI-8226细胞活力 取处于对数生长期的RPMI-8226细胞,细胞浓度调整为1×105个/mL,每孔100 μL细胞液接种于96孔板中,置于37 ℃、5% CO2的恒温箱中适应性培养24 h后随机分组,每组分别加入20%、10%、5%含药血清,分别命名为高剂量组、中剂量组、低剂量组;设置对照组,加入10%空白血清。每组5个复孔。放置于37 ℃、5% CO2的恒温箱培养,分别培养12、24、36 h后取出细胞,每孔中加入CCK-8试剂10 μL,避光,37 ℃、5%CO2培养箱孵育4 h后,通过酶标仪在450 nm处检测细胞吸光度(OD)值。并通过公式计算细胞活力。细胞活力(%)=(A0-A1)/(A2-A3)×100%,其中A0代表含有细胞、含药血清和CCK-8溶液孔的OD值;A1代表无细胞,含有含药血清和CCK-8溶液孔的OD值;A2代表含有细胞、空白血清和CCK-8溶液孔的OD值;A3代表无细胞,含有空白血清和CCK-8溶液孔的OD值。
2.2.4 ELISA检测Wnt1、β-catenin、cyclin D1蛋白含量 取处于对数生长期的RPMI-8226细胞,细胞浓度调整为1×105个/mL,每孔100 μL细胞液接种于96孔板中,为避免骨髓瘤细胞自分泌IL-6对细胞增殖的干扰,首先各组中加入IL-6 1.0 ng/mL单抗中和骨髓瘤分泌的IL-6,静置中和4 h后随机分组,每组分别加入20%、10%、5%含药血清,分别命名为高剂量组、中剂量组、低剂量组,并设置对照组,加入10%空白血清。每组5个复孔。24 h后收集各组细胞上清液或细胞裂解液,使用ELISA试剂盒检测Wnt1、β-catenin、cyclin D1蛋白含量。具体操作步骤按照说明书进行。
2.2.5 Western blotting检测Wnt1、β-catenin、cyclin D1蛋白相对表达量 取处于对数生长期的RPMI-8226细胞,细胞浓度调整为3×105个/mL,每孔2 mL,细胞液接种于6孔板中,静置中和4 h后随机分组,每组分别加入20%、10%、5%含药血清,分别命名为高剂量组、中剂量组、低剂量组,并设置对照组,采用ECL化学发光显影剂于显影仪中显影。收集图片,采用Image J软件对图片处理,计算各目标蛋白条带的灰度值,后续进行统计学分析,计算Wnt1、β-catenin、cyclin D1蛋白相对表达量。
2.3 统计学方法 采用SPSS 23.0软件进行统计分析,计量资料以“均数±标准差”(±s)表示,多样本比较采用单因素方差分析和SNK-q检验,两样本比较采用成组t检验,P<0.05为差异有统计学意义。
3 结 果
3.1 网络药理学预测结果

图1 毒结清复方有效成分与多发性骨髓瘤疾病靶点韦恩图
3.1.2 PPI网络及核心靶点 将药物-疾病交集靶点导入String数据库,以高可信度选项构建蛋白互作(PPI)网络。(见图2)利用多个拓扑参数比单用Degree参数更能客观地反映节点的重要性,故本研究利用Cytoscape插件Cytohubba算PPI网络拓扑参数,得到MCC、DC、CC、BC参数值。各参数值均数分别为7 003.02、9.74、62.42、298.67。以靶点拓扑参数大于均数为筛选规则,从PPI网络中筛选得到13个核心靶点。(见表1)

图2 蛋白互作网络(PPI)
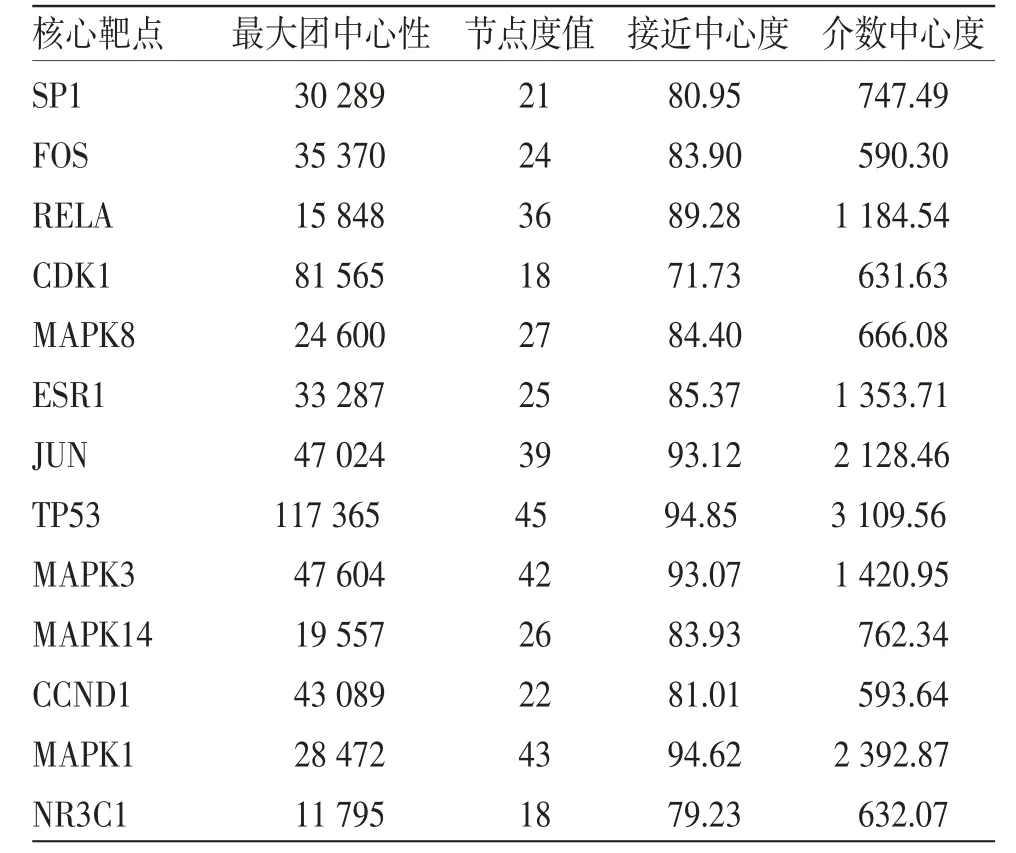
表1 PPI 网络核心靶点
3.1.3 交集靶点富集分析 在R语言环境下利用clusterProfiler包,导入148个交集靶点进行富集分析,得到KEGG富集结果155条,根据校正P值及Count数,以气泡图形式可视化前20条。(见图3)其中包括低氧诱导因子1信号通路(HIF-1 signaling pathway)、EGFR酪氨酸激酶抑制剂耐药性(EGFR tyrosine kinase inhibitor resistance)、IL-17信号通路(IL-17 signaling pathway)、PI3K-Akt信号通路(PI3K-Akt signaling pathway)、细胞衰老(Cellular senescence)等与MM疾病进展与治疗效果密切相关的通路。结合Pubmed、Google Scholar检索查阅文献发现,除了可视化的20条通路外,其余135条结果中包含有Ras信号通路(Ras signaling pathway)、NF-κB信号通路(NF-κB signaling pathway)、JAK-STAT信号通路(JAK-STAT signaling pathway)、mTOR信号通路(mTOR signaling pathway)、Wnt信号通路(Wnt signaling pathway)等与MM疾病密切相关的通路,表明毒结清复方可能通过多条通路起到治疗MM的作用。在基础实验过程中发现,Wnt信号通路在参与骨髓瘤的增殖和骨破坏中起非常重要的作用[9-10]。目前研究中发现该通路的作用机制和效应远比可视化图排位重要得多,故认为毒结清复方可能通过Wnt信号通路起到治疗MM的作用,后续实验研究也围绕Wnt信号通路开展实验验证。

图3 交集靶点KEGG 富集分析
GO富集分析得到生物过程1 682条,分子功能98条,细胞成分36条,分别以气泡图可视化前20条。(见图4)生物过程主要包括内毒素应答(response to lipopolysaccharide)、对细菌源分子的应答(response to molecule of bacterial origin)、对营养水平的应答(response to nutrient levels)、对氧水平的应答反应(response to oxygen levels)、氧化应激反应(response to oxidative stress)、对抗生素的应答反应(response to antibiotic)、缺氧应激反应(response to hypoxia)、对低氧水平的应答(response to decreased oxygen levels)等条目,这些条目主要与体内氧水平及细菌感染相关。分子功能主要包括DNA结合转录因子结合(DNA-binding transcription factor binding)、蛋白丝氨酸/苏氨酸激酶活性(protein serine/threonine kinase activity)、信号分子(receptor ligand activity)、信号受体激活物的活性(signaling receptor activator activity)、RNA聚合酶Ⅱ特异性DNA结合转录因子结合(RNA polymerase Ⅱ-specific DNA-binding transcription factor binding)等。细胞成分主要包括细胞膜(membrane region)、染色质(nuclear chromatin)、转录因子复合体(transcription regulator complex)等。

图4 交集靶点GO 富集分析
3.1.4 构建“中药-有效成分-靶点-通路”网络 利用上述过程得到的中药及中药有效成分、交集靶点和KEGG富集分析结果构建“中药-有效成分-靶点-通路”网络。(见图5)

图5“中药-有效成分-靶点-通路”网络图
3.2 体外实验研究
3.2.1 毒结清复方对RPMI-8226细胞活力的影响 与对照组比较,低、中、高剂量组RPMI-8226细胞12、24、36 h的OD值均明显降低(P<0.05),且存在剂量依赖性,即高剂量组RPMI-8226细胞12、24、36 h的OD值均低于中剂量组(P<0.05),中剂量组RPMI-8226细胞12、24、36 h的OD值均低于低剂量组(P<0.05)。(见图6)
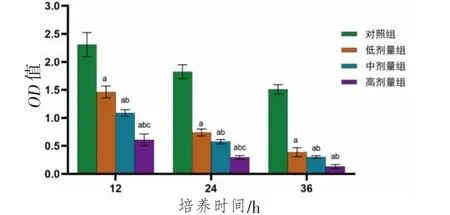
图6 各组RPMI-8226 细胞OD 值比较 (±s,n=5)
3.2.2 各组RPMI-8226细胞Wnt1、β-catenin、cyclin D1蛋白含量比较 与对照组比较,低、中、高剂量组RPMI-8226细胞Wnt1、β-catenin、cyclin D1蛋白含量均明显降低(P<0.05),且呈剂量依赖性;高剂量组RPMI-8226细胞Wnt1、β-catenin、cyclin D1蛋白含量均明显低于中剂量组(P<0.05);中剂量组RPMI-8226细胞β-catenin、cyclin D1蛋白含量均明显低于低剂量组(P<0.05),Wnt1蛋白含量与低剂量组比较,差异无统计学意义(P>0.05)。(见表2)
表2 各组RPMI-8226 细胞Wnt1、β-catenin、cyclin D1蛋白含量比较 (±s,pg/mL)
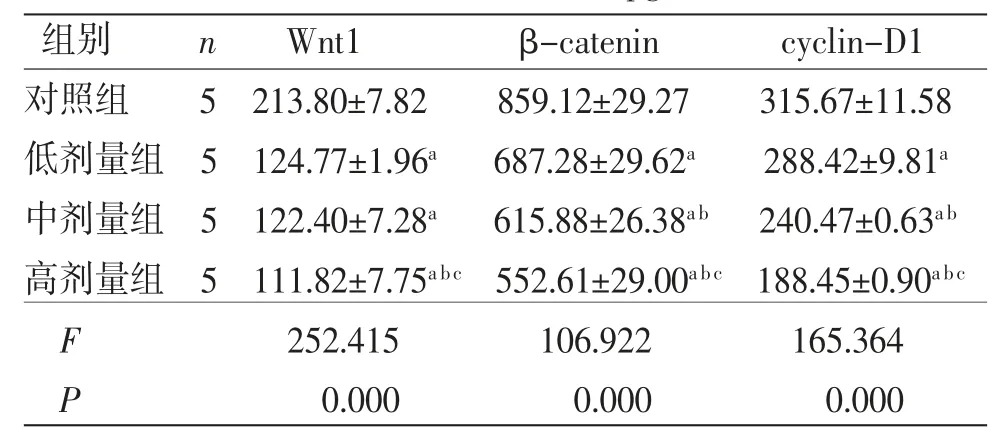
表2 各组RPMI-8226 细胞Wnt1、β-catenin、cyclin D1蛋白含量比较 (±s,pg/mL)
注:与对照组比较,aP<0.05;与低剂量组比较,bP<0.05;与中剂量组比较,cP<0.05
组别 n Wnt1 β-catenin cyclin-D1对照组 5 213.80±7.82 859.12±29.27 315.67±11.58低剂量组 5 124.77±1.96a 687.28±29.62a 288.42±9.81a中剂量组 5 122.40±7.28a 615.88±26.38a b 240.47±0.63a b高剂量组 5 111.82±7.75a bc 552.61±29.00a bc 188.45±0.90a bc F 252.415 106.922 165.364 P 0.000 0.000 0.000
3.2.3 各组RPMI-8226细胞Wnt1、β-catenin、cyclin D1蛋白相对量比较 与对照组比较,低、中、高剂量组RPMI-8226细胞β-catenin蛋白相对表达量均明显降低(P<0.05),且高剂量组RPMI-8226细胞β-catenin蛋白相对表达量明显低于低剂量组(P<0.05)。与对照组比较,中、高剂量组RPMI-8226细胞Wnt1、cyclin D1蛋白相对表达量均明显降低(P<0.05),高剂量组RPMI-8226细胞Wnt1、cyclin D1蛋白相对表达量均明显低于低剂量组(P<0.05);高剂量组RPMI-8226细胞Wnt1蛋白相对表达量明显低于中剂量组(P<0.05)。(见图7、表3)
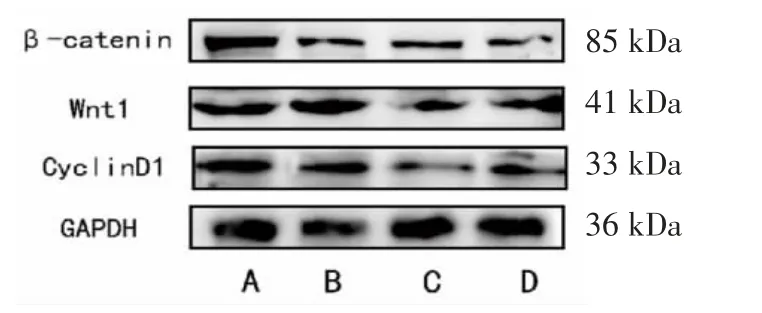
图7 各组RPMI-8226 细胞Wnt1、β-catenin、cyclin D1 蛋白表达Western blotting 图
表3 各组RPMI-8226 细胞Wnt1、β-catenin、cyclin D1 蛋白相对表达量比较 (±s)

表3 各组RPMI-8226 细胞Wnt1、β-catenin、cyclin D1 蛋白相对表达量比较 (±s)
注:与对照组比较,aP<0.05;与低剂量组比较,bP<0.05;与中剂量组比较,cP<0.05
组别 n β-catenin Wnt1 cyclinD1对照组 3 1.00±0.09 1.00±0.11 1.00±0.02低剂量组 3 0.62±0.13a 0.94±0.07 0.94±0.06中剂量组 3 0.49±0.04a 0.69±0.09a b 0.78±0.05a高剂量组 3 0.39±0.04a b 0 .48±0.12a b c 0.71±0.09a b F 29.061 17.576 141.100 P 0.000 0.001 0.001
4 讨 论
中医学根据MM临床症状,将其归属于“骨痹”“骨蚀”“虚劳”的范畴,认为本病乃本虚标实之证,以肝、脾、肾三脏亏损为本,痰、湿、毒蕴、血瘀为标[9]。近代许多医家应用中药、中成药治疗MM及相关外周神经并发症取得了良好的疗效[10-12]。中医血液学专家应用补肾通络、祛瘀消瘤法治疗骨髓瘤髓外病变取得明显疗效,对于髓外病变,施以马钱子、黄鼠骨粉联合中药内服可达到缩小局部软组织肿瘤的效果[13-15]。
本研究通过网络药理学方法,利用KEGG富集分析发现毒结清复方对MM的治疗作用可能是通过调控Wnt1、NF-κB、PI3K/AKT、AP-1和MAPK等多通路起到治疗MM疾病的作用[16-17]。Wnt通路及其下游sclerostin蛋白在骨髓瘤肿瘤增殖和骨破坏发挥重要作用,因此,本研究重点探讨该通路及其相关蛋白表达。
Cyclin D1蛋白是Wnt信号通路下游的转录蛋白。Wnt信号通路是高度保守的信号转导通路,在正常情况下,其不存在Wnt配体,β-catenin主要被糖原合成酶激酶3(GSK3)和酪蛋白激酶1α(CK1α)磷酸化,并被E3泛素蛋白连接酶泛素化后降解。当Wnt/β-bcatenin信号通路异常激活时,大量的Wnt蛋白与其受体结合,抑制GSK-3b活性及β-catenin降解,导致β-catenin在细胞质中的积累。当β-catenin浓度达到一定水平时,其可转移至细胞核中,调节Wnt靶基因如癌基因Myc、Cyclin D1的表达[18]。Wnt/β-catenin信号通路及下游CCND1转录蛋白通过调节MM细胞的分化、增殖、凋亡和迁移参与MM的发病机制。GUO B L等[19]研究发现在MM患者体内过表达miR-744-5p可以靶向癌症相关蛋白SOX12而抑制Wnt/βcatenin信号通路,进而抑制MM细胞增殖、侵袭、迁移。多个临床前MM模型研究发现,阻断Wnt信号抑制剂(DKK1、SFRP-2、sclerostin)可增加成骨细胞的形成,减少溶骨性病变[17,20-21]。Wnt信号通路一方面参与MM细胞的增殖、迁移,另一方面在骨生长、发育过程中发挥着重要的作用[22-23]。本研究发现cyclinD1只有在高剂量干预下才与对照组有差异,这表明要克服增殖旺盛的细胞需要高剂量毒结清复方干预才能实现。
本研究结果表明,毒结清复方可降低RPMI-8226细胞活力,抑制其增殖,并且抑制作用和时间呈浓度依赖,同时发现毒结清含药血清可以抑制骨髓瘤细胞株RPMI-8226细胞wnt/β-bcatenin信号通路中Wnt1、β-catenin、cyclin D1蛋白浓度。因此推测在Wnt经典信号通路中,毒结清是通过降低β-catenin蛋白浓度,从而减少转移入细胞核中的β-catenin数量,使β-catenin的数量减少从而导致cyclin D1蛋白转录减少。cyclin D1转录减少就会导致肿瘤细胞更多停留在G0期,肿瘤细胞繁殖减慢,从而达到减少肿瘤负荷的目的。毒结清复方中槲皮素为主要抗骨髓瘤成分,类似柚皮素抗骨髓瘤增殖的实验在多通路中也有验证。徐亚文等[24]研究发现槲皮素在骨髓瘤细胞株中通过诱导细胞凋亡、促进细胞周期阻滞而发挥抗肿瘤作用。杨军岭等[25]研究发现槲皮素能够通过抑制NF-κB信号通路而降低骨髓瘤细胞的侵袭和迁移能力。据此本研究推测:毒结清复方通过多靶点、多通路对骨髓瘤细胞增殖发挥抑制作用,从而达到治疗目的。
IL-6可促进MM细胞生长,引起机体免疫紊乱及病理损伤,使机体肿瘤负荷持续增加,贫血和骨病持续加重。骨硬化蛋白(sclerostin)是一种来源于骨细胞的分泌蛋白,它可以通过抑制Wnt/β-catenin通路来抑制骨的形成,同时受到多种细胞因子及mRNA等多因素调控。β2-微球蛋白(β2-MG)与MM细胞的克隆及增殖活性相关,能直接反映患者体内的肿瘤负荷。毒结清复方联合化疗可降低MM患者体内血钙、sclerostin、白细胞介素-6(IL-6)、C反应蛋白(CRP)及β2-MG水平,从而有效缓解MM患者骨痛症状,抑制肿瘤进展[6,26-27]。本研究推测毒结清在对MM细胞的抑制作用过程中是多方面、多通路的抑制作用,而Wnt1/β-catenin是一条重要的通路。
综上所述,本研究基于网络药理学对毒结清复方与MM疾病靶点间复杂的网状关系进行研究,预测药物主要活性成分、作用靶点及相关通路,最后通过体外细胞实验初步验证网络药理学的预测。下一步我们将通过提取患者体内肿瘤细胞对毒结清复方治疗MM的作用进行进一步确证,以期得到治疗骨髓瘤有效的机制探讨。
