“九蒸九制”对黄精滋味品质及多糖结构变化的影响*
2023-05-13刘心洁刘亚鹏陈文迪陈雪莉俞年军吴振东
刘心洁,周 安,刘亚鹏,陈文迪,陈雪莉,俞年军,吴振东,梁 娟,4
(1.安徽中医药大学药学院,安徽 合肥 230012;2.安徽中医药大学科研技术中心,安徽 合肥 230038;3.安徽省青阳县九华中药材科技有限公司,安徽 池州 242800;4.药物制剂技术与应用安徽省重点实验室,安徽 合肥 230012)
九华黄精基原植物为百合科黄精属多花黄精(Polygonatum cyrtonemaHua.),是一种药食同源类中药[1],在中国具有两千多年的食用历史。多花黄精具有补气、养阴、健脾、润肺、补肾等功效[2-4]。现代药理研究也表明,多花黄精在调节糖脂代谢[5]、抗氧化[6]、增强免疫[7]、改善心血管功能等方面表现出良好的功效。产地为安徽池州的多花黄精为中国国家地理标志产品,又称九华黄精,因其多糖含量高[8-9]、适口性强而深受欢迎,显示了广阔的市场前景。但由于生黄精对咽喉具有一定的刺激性和微小毒性,故市场上黄精类产品药用或食用前多以炮制法加工处理[10],以减少毒性,改善其感官品质。然而作为即食食品,黄精滋味品质尚无统一标准,其加工过程滋味品质变化与成分变化间的相关性也不明确,限制了黄精类产品及相关行业的发展。
黄精的炮制过程会影响色泽、滋味等与食品相关的质量评价指标[11]。赵丽蓉等[12]通过电子舌技术建立了多花黄精“味觉”定量表征分析方法,较好地区分出了不同产地和不同加工方法的多花黄精。黄精多糖是黄精的主要活性成分。多年来研究者们致力于探究黄精炮制前后多糖的性质和功能变化,如WANG J等[13]研究得出蒸制黄精的多糖对贫血模型小鼠具有造血作用;SUN T T等[14]对黄精酒制前后的多糖结构和免疫活性进行了比较研究,证实经酒制后多糖的理化性质发生显著变化且酒制黄精多糖的免疫活性增强;LI Q Y等[15]探究了“九蒸九制”过程中黄精的多糖结构特征及抗氧化活性变化,结果表明蒸制过程对黄精多糖的结构及活性产生重要影响。但是“九蒸九制”过程中黄精滋味特征等感官品质的变化规律及其与多糖结构的相关性尚缺乏研究。课题组前期探究了多花黄精炮制前后的多糖变化,发现生品的多糖含量达(44.53%±0.34)%,经“九蒸九制”后多糖含量下降至(18.02%±0.86)%,相对分子量也随之增大[16],但并未对“九蒸九制”过程中的多糖含量与蒸制次数变化之间的规律进行深入研究。基于此,本研究以九华黄精为研究对象,探究了生品黄精在“九蒸九制”过程中,滋味品质与多糖结构变化的规律,并对滋味品质与多糖结构变化之间的相关性进行研究,分析蒸制过程多糖结构变化可能对黄精滋味品质产生的影响,旨在为黄精类食品和保健品研发提供参考。
1 仪器与材料
1.1 仪器 JP-060S型超声波清洗机(深圳市洁盟清洗设备有限公司);ALPHA1-2LD型真空冷冻干燥机(德国Christ公司);1100型高效液相色谱仪,配备示差折光检测器(美国Agilent公司);TSK gel G3000PWXL色谱柱(7.8 mm×300 mm,7 μm)(日本东曹株式会社);UV-2550型紫外分光光度计(日本岛津公司);Nicolet 5700红外光谱仪(美国赛默飞公司);TS-5000Z味觉分析系统(日本Insent公司)。
1.2 药材与试剂 九华黄精生品药材由九华中药材科技有限公司提供,安徽中医药大学俞年军教授鉴定为百合科黄精属植物多花黄精(Polygonatum cyrtonemaHua.)的干燥根茎。半乳糖醛酸(批号:B21894,纯度≥98%)、间羟基联苯(批号:B27433,纯度≥98%)、无水葡萄糖(批号:B21882,纯度≥98%)均购自上海源叶生物科技有限公司;葡聚糖系列标准品(批号:110833-202109)购于美国Sigma-Aldrich公司;其他试剂均购于国药化学试剂有限公司。
2 方 法
2.1 黄精炮制品的制备 参照林雨等[17]的制备方法并做少量修改,取新鲜九华黄精根茎,清洗,去须根,去表面泥沙,切厚片,于60 ℃烘箱中干燥。取200 g干燥生黄精隔水蒸制7 h,取出,置于干燥箱中65 ℃干燥6 h,即得“一蒸一制”炮制品,标记为PCH1,继续连续8次重复上述步骤。分别得到炮制品标记为PCH2、PCH3、PCH4、PCH5、PCH6、PCH7、PCH8、PCH9,其中生黄精标记为PCH0。
2.2 电子舌检测 取“2.1”项下制备的黄精样品PCH0~PCH9,粉碎至粒径为2~3 mm的颗粒,托盘天平各称取5 g置于烧杯中,分别加入200 mL沸水(纯净水),封口膜封口,于烧杯中浸泡30 min,超声(温度:55 ℃,功率:300 W)15 min,经滤纸过滤,滤液冷却至室温检测。Reference(参比唾液):30 mmol/L氯化钾+0.3 mmol/L酒石酸;负极清洗液:100 mmol/L盐酸+30%乙醇;正极清洗液:10 mmol/L氢氧化钾+100 mmol/L氯化钾+30%乙醇。采用TS-5000Z味觉分析系统,加载鲜、咸、酸、苦、涩、甜6种传感器电极。每组样品平行重复测定5次,对后3次采集到的数据进行味觉特征分析。采用Origin 2018软件绘制雷达图、主成分分析图和聚类分析图。
2.3 黄精多糖的提取 参照陶涛等[18]的研究方法,并做了少量修改。取待测样品(PCH0~PCH9),粉碎至粒径为2~3 mm颗粒,称取各黄精颗粒50 g于锥形瓶中,按料液比1∶15(g:mL)加入蒸馏水,超声(温度:55 ℃,功率:300 W)提取40 min,收集滤液,减压浓缩至1/4体积。采用Sevage法脱蛋白,离心后静置分层,重复3次,于50 ℃真空旋转蒸发去除残留的Sevage有机溶剂,向浓缩液中加入4倍体积无水乙醇,4 ℃静置过夜,4 000 r/min离心10 min,弃上清液,获得的沉淀经冷冻干燥制得黄精多糖冻干粉。
2.4 多糖含量测定 采用蒽酮-硫酸法[19]进行多糖含量的测定。将葡萄糖配制成0.00、2.50、5.00、7.50、10.00、12.50 mg/mL标准溶液,按蒽酮-硫酸法步骤操作,于582 nm处测定不同浓度葡萄糖的吸光度,以葡萄糖质量浓度为横坐标,吸光度为纵坐标,建立回归方程为Y=0.006 5X+0.010 8(r=0.999 1)。称取剪碎后的各黄精样品1 g,按照“2.3”项下多糖的提取方法得多糖提取液,经脱蛋白处理后加蒸馏水定容至100 mL,精密量取0.3 mL,按照上述葡萄糖标准溶液的测定方法,测定各样品吸光度,代入回归方程,按公式(1)计算多糖含量。
2.5 糖醛酸含量测定 采用间羟基联苯法[20]进行糖醛酸含量的测定。将半乳糖醛酸配制成0.00、0.02、0.04、0.06、0.08、0.10 mg/mL标准溶液,按间羟基联苯法步骤操作,于520 nm处测定不同浓度半乳糖醛酸标准品的吸光度,以半乳糖醛酸质量浓度为横坐标,吸光度为纵坐标,建立回归方程为Y=6.8414X+0.005 4(r=0.999 6)。精密称取“2.3”项下制备的黄精多糖冻干粉10 mg,配制成1 mg/mL的多糖溶液,精密量取0.2 mL的多糖溶液,按照上述半乳糖醛酸标准溶液的测定方法,测定各样品吸光度,代入回归方程,按公式(2)计算糖醛酸含量。
2.6 多糖相对分子量测定 参考LIANG J等[21]的研究方法。色谱条件:采用DEAC901030 示差折光检测器,TSK gel G3000PWXL色谱柱(7.8 mm×300 mm,7 μm),流动相为超纯水,流速为0.5 mL/min,柱温为35 ℃,进样量为10 μL。利用不同相对分子量的葡聚糖标准品进行高效凝胶渗透色谱(HPGPC)分析,以保留时间为横坐标,lgMw为纵坐标绘制标准曲线,求得:Y=-0.279 6X+5.179 6(r=0.994 2)。精密称取黄精多糖冻干粉10 mg,加入超纯水溶解,配制成1 mg/mL的溶液,0.22 μm无机相滤膜过滤,进行HPGPC检测,代入标准曲线中计算样品多糖分子量。
2.7 红外光谱分析 分别取PCH0~PCH9样品的多糖粉末1 mg与适量KBr粉末混合研磨,压片机压片,在4 000~500 cm-1的范围内进行红外光谱扫描。
2.8 统计学方法 所有样品均进行3次平行试验,计量资料以“均数±标准差”表示。采用Excel 2016作标准曲线,利用GraphPad Prism软件进行单因素方差分析、相关分析(Pearson法),使用Origin 2018 64Bit作图。
3 结 果
3.1 蒸制次数对黄精外观品质的影响 生品黄精和经不同蒸制次数的炮制品黄精见图1。不同样品之间色泽存在显著差异,生品黄精表面深黄色,经炮制后,“一蒸一制”和“二蒸二制”炮制品黄精表面呈红棕色,“三蒸三制”至“五蒸五制”炮制品黄精表面颜色则呈现棕褐色,而“六蒸六制”至“九蒸九制”炮制品黄精表面颜色呈黑褐色。即随着蒸制次数的增加,黄精炮制品的色泽逐渐加深。

图1 不同蒸制次数黄精的外观图
3.2 基于电子舌技术分析蒸制次数对黄精滋味特征的影响
3.2.1 不同蒸制次数黄精的滋味雷达图分析 黄精样品的味觉指标雷达图见图2a,包括酸味、涩味、苦味、咸味、甜味、鲜味、丰富性、涩味回味和苦味回味9个指标。以参比溶液的输出值称为无味点,本试验参比溶液由氯化钾和酒石酸组成,故酸味的无味点为-13,咸味无味点为-6,样品的味觉值低于无味点时可认定样品无该味道。由图2a可知,PCH0~PCH9的丰富性、涩味回味和苦味回味均接近于无味点,因此可基于有效味觉指标建立新的雷达图(见图2b),包括酸味、涩味、苦味、咸味、甜味和鲜味。由图2b可知,在蒸制过程中各黄精样品味觉值在多项指标中差异显著。随着蒸制次数的增加,黄精的甜味、酸味、涩味增加,而鲜味和咸味则减小。

图2 不同蒸制次数黄精的味觉(a)和有效味觉指标(b)雷达图
3.2.2 不同蒸制次数黄精的滋味主成分分析 基于所有味觉指标对不同蒸制次数的10个黄精样本采集到的共30个数据进行PCA处理(见图3a),图中PC1和PC2的累积方差贡献率为99.03%。这说明PC1和PC2包含的信息量足够反映样品的整体信息特征,可将不同蒸制次数的黄精在PCA图中区分开来。10个黄精样品明显地分散在前两个主成分构成的二维坐标的4个象限内,且PCH0~PCH9分别构成一个独立的组群,相互之间几乎没有重叠,表示分析的重复性合格。由于PC1的贡献率大于PC2,说明不同蒸制次数的黄精滋味差异主要由第一主成分决定。图3a中样品PCH3、PCH4和PCH5相距较近,说明这3种蒸制次数的黄精滋味特征相似。以味觉指标平均值对10个样品进行再次聚类(见图3b),当欧式距离为3时,10个样品分为5类,分别为PCH0、PCH1~PCH2、PCH3~PCH5、PCH6~PCH7、PCH8~PCH9。同一类的样品滋味特征相近,这与主成分分析的结果基本相符。

图3 不同蒸制次数黄精的电子舌主成分分析图(a)和聚类分析图(b)
黄精滋味的主成分贡献率显示了各味觉变量对主成分的贡献率,绝对值越大对主成分的贡献率也就越大。由表1可知,酸味、鲜味和涩味对第一主成分的贡献率较大,咸味、涩味和甜味对第二主成分的贡献率较大。由于PC1贡献率大于PC2,可认为“九蒸九制”工艺主要对黄精的酸味、鲜味和涩味产生较大影响,但对滋味产生影响的具体机制有待进一步深入研究。
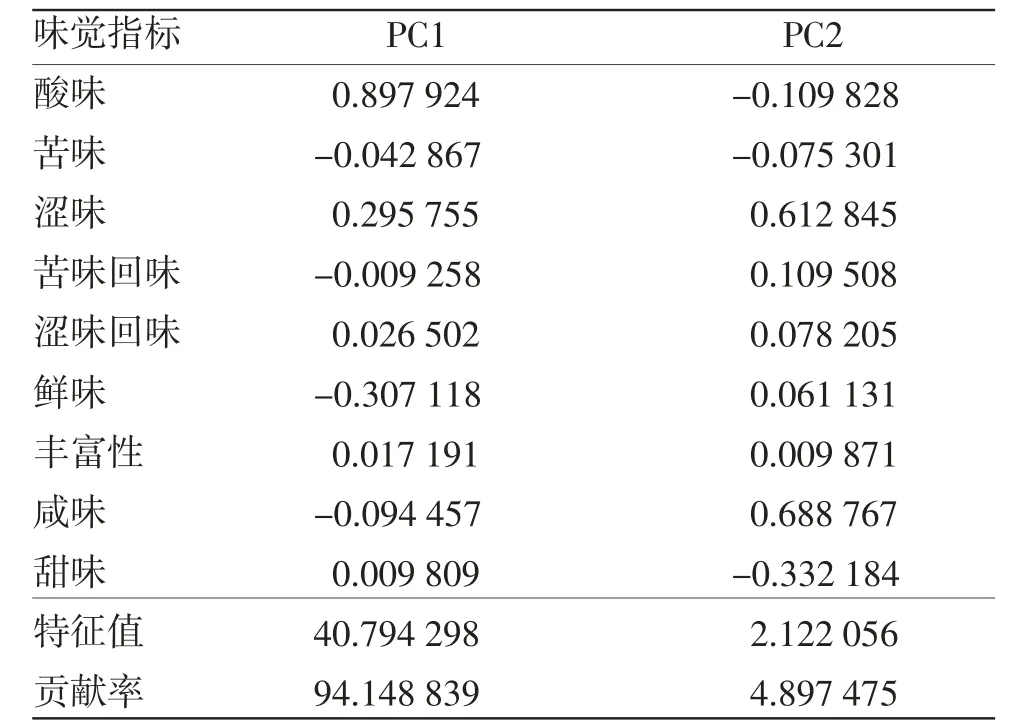
表1 黄精电子舌数据的主成分贡献表
3.3 蒸制次数对黄精多糖及糖醛酸含量的影响
3.3.1 多糖含量分析 根据回归方程计算出样品PCH0~PCH9的多糖含量,结果显示生品黄精多糖的含量最高,达到(47.84±0.34)%。PCH0~PCH3多糖含量明显降低,PCH3~PCH7多糖含量没有显著变化,PCH7之后多糖含量又显著降低。即随着蒸制次数的增加,多糖含量总体呈降低趋势。(见表2)
表2 不同蒸制次数的黄精样品多糖含量 (±s)
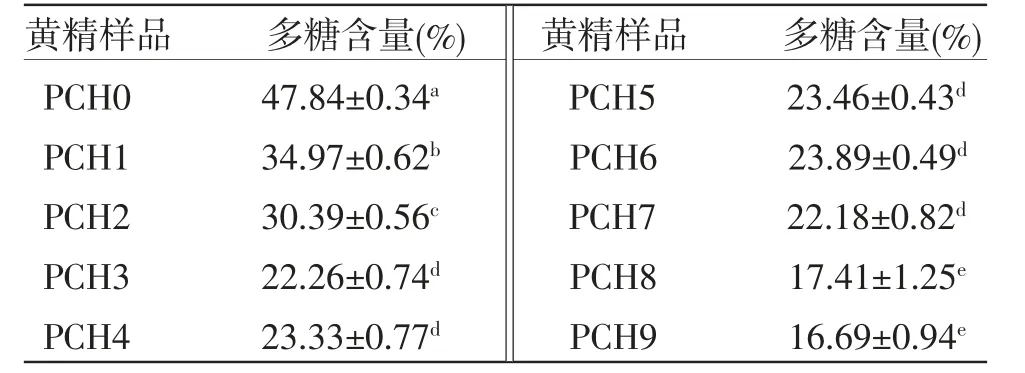
表2 不同蒸制次数的黄精样品多糖含量 (±s)
注:样品间不同字母表示差异有统计学意义(P<0.05)
黄精样品 多糖含量(%) 黄精样品 多糖含量(%)PCH0 47.84±0.34a PCH5 23.46±0.43d PCH1 34.97±0.62b PCH6 23.89±0.49d PCH2 30.39±0.56c PCH7 22.18±0.82d PCH3 22.26±0.74d PCH8 17.41±1.25e PCH4 23.33±0.77d PCH9 16.69±0.94e
3.3.2 糖醛酸含量分析 已有研究[22-23]表明,多糖的单糖组成对其生物活性的大小有影响,其中糖醛酸含量与多糖的生物活性密切相关。根据回归方程得样品PCH0~PCH9糖醛酸含量。结果显示生品黄精的糖醛酸含量最高,为(12.61±0.73)%。从“九蒸九制”过程总体来看,PCH0~PCH2糖醛酸含量明显降低,而从PCH2~PCH9,随着蒸制次数的增加,糖醛酸含量没有发生显著变化。总体来说,生品黄精经“九蒸九制”后糖醛酸含量呈降低趋势,但“二蒸二制”之后糖醛酸含量的变化不具有显著性。(见表3)
表3 不同蒸制次数的黄精样品糖醛酸含量 (±s)
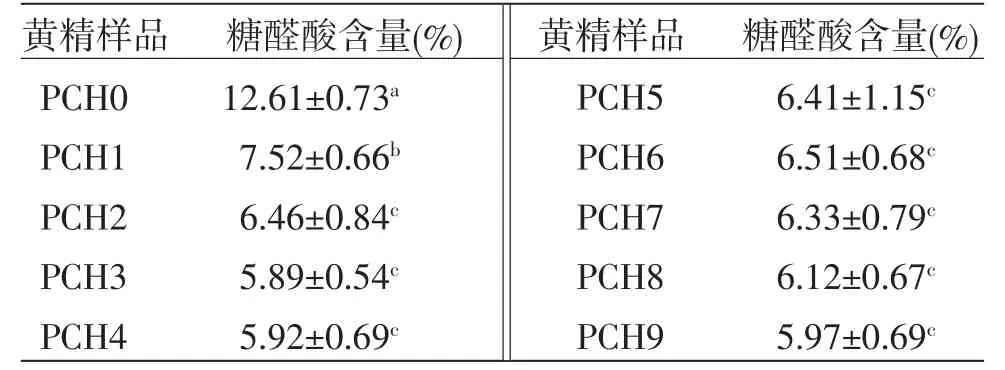
表3 不同蒸制次数的黄精样品糖醛酸含量 (±s)
注:样品间不同字母表示差异有统计学意义(P<0.05)
黄精样品 糖醛酸含量(%) 黄精样品 糖醛酸含量(%)PCH0 12.61±0.73a PCH5 6.41±1.15c PCH1 7.52±0.66b PCH6 6.51±0.68c PCH2 6.46±0.84c PCH7 6.33±0.79c PCH3 5.89±0.54c PCH8 6.12±0.67c PCH4 5.92±0.69c PCH9 5.97±0.69c
3.3.3 黄精滋味特征与多糖、糖醛酸含量相关分析 采用GraphPad Prism做电子舌各味觉指标与多糖含量和糖醛酸含量之间的相关分析(Pearson法)。结果显示苦味、鲜味与多糖含量(P<0.01)和糖醛酸含量(P<0.05)均呈显著正相关关系,尤其鲜味相关系数达到0.885,说明黄精苦味和鲜味的减小与多糖和糖醛酸含量的降低有显著的相关性。咸味与多糖含量呈正相关关系,与糖醛酸含量呈负相关关系;而甜味与多糖含量呈负相关关系,与糖醛酸含量呈正相关关系。此外,酸味和涩味与多糖含量(P<0.001)及糖醛酸含量(P<0.05)均呈显著负相关关系,说明酸味和涩味这两种味觉指标的增加与多糖和糖醛酸含量的降低也有显著相关性。(见表4)

表4 相关分析结果
3.4 蒸制次数对黄精多糖分子量排布的影响 采用凝胶渗透色谱法测定不同蒸制次数的黄精多糖分子量排布。由图4可知,生品黄精(PCH0)多糖主要相对分子量为5 kDa。经炮制后,黄精多糖相对分子量排布发生显著变化,共产生6个不同分子量的多糖,与生品黄精比较,1、2、3号峰相对分子量均增大,且1、3号峰的峰面积随着炮制次数的增加而增加。(见表5)4号峰随着炮制次数的增加保留时间右移且峰面积逐渐减小,说明该峰对应的多糖相对分子量在不断减小,且该相对分子量多糖的含量也在逐渐降低。而新产生的5、6号色谱峰对应的多糖分子量小于生品黄精的多糖分子量,其中6号色谱峰的峰面积逐渐增加,说明对应的这部分分子量的多糖含量也随着炮制次数的增加而呈增加趋势。
表5 黄精多糖相对分子量及峰面积 (±s)
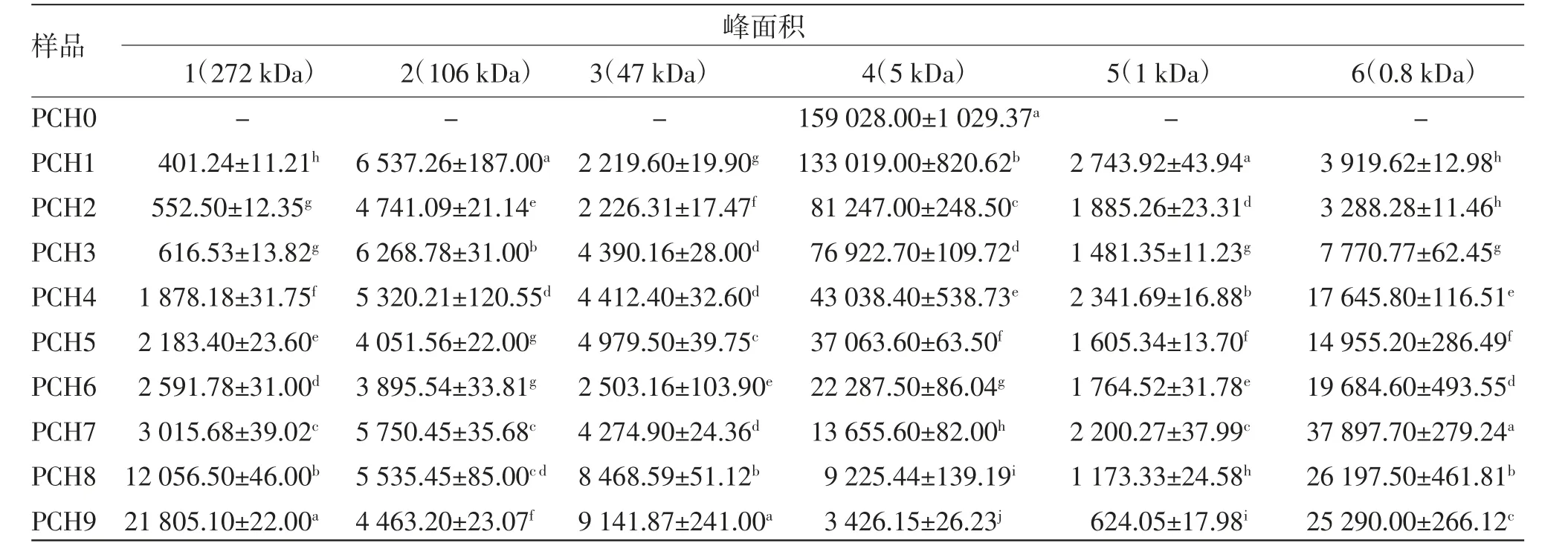
表5 黄精多糖相对分子量及峰面积 (±s)
注:同一列数据后不同字母表示差异有统计学意义(P<0.05),且字母顺序按照峰面积值从大到小的顺序排列
峰面积1(272 kDa) 2(106 kDa) 3(47 kDa) 4(5 kDa) 5(1 kDa) 6(0.8 kDa)PCH0 - - - 159 028.00±1 029.37a - -PCH1 401.24±11.21h 6 537.26±187.00a 2 219.60±19.90g 133 019.00±820.62b 2 743.92±43.94a 3 919.62±12.98h PCH2 552.50±12.35g 4 741.09±21.14e 2 226.31±17.47f 81 247.00±248.50c 1 885.26±23.31d 3 288.28±11.46h PCH3 616.53±13.82g 6 268.78±31.00b 4 390.16±28.00d 76 922.70±109.72d 1 481.35±11.23g 7 770.77±62.45g PCH4 1 878.18±31.75f 5 320.21±120.55d 4 412.40±32.60d 43 038.40±538.73e 2 341.69±16.88b 17 645.80±116.51e PCH5 2 183.40±23.60e 4 051.56±22.00g 4 979.50±39.75c 37 063.60±63.50f 1 605.34±13.70f 14 955.20±286.49f PCH6 2 591.78±31.00d 3 895.54±33.81g 2 503.16±103.90e 22 287.50±86.04g 1 764.52±31.78e 19 684.60±493.55d PCH7 3 015.68±39.02c 5 750.45±35.68c 4 274.90±24.36d 13 655.60±82.00h 2 200.27±37.99c 37 897.70±279.24a PCH8 12 056.50±46.00b 5 535.45±85.00c d 8 468.59±51.12b 9 225.44±139.19i 1 173.33±24.58h 26 197.50±461.81b PCH9 21 805.10±22.00a 4 463.20±23.07f 9 141.87±241.00a 3 426.15±26.23j 624.05±17.98i 25 290.00±266.12c样品
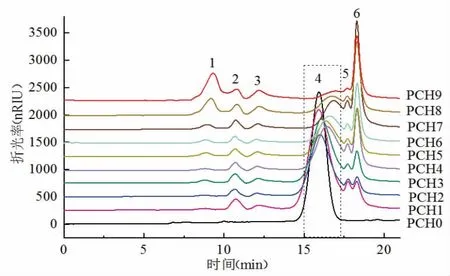
图4 不同蒸制次数黄精多糖的HPGPC 谱图
3.5 蒸制次数对黄精多糖红外结构的影响 不同蒸制次数的黄精多糖光谱见图5。PCH0~PCH9均在3 411.00 cm-1附近具有较强的宽吸收峰,表明存在O-H或分子间氢键的伸缩振动;在2930.61cm-1附近的弱吸收峰为C-H伸缩振动;在1 623.10 cm-1和1 396.93 cm-1处的特征吸收峰为羧基的C=O键的对称和不对称伸缩振动;位于1 122.42 cm-1、1 044.84 cm-1和1 245.95 cm-1的峰代表吡喃糖环上C-O-C糖苷键的伸缩振动;931.46 cm-1和863.43 cm-1的吸收峰代表了α-糖苷键和β-糖苷键的存在。不同蒸制次数的黄精多糖光谱具有相似的特征吸收,表明蒸制过程对取代基没有明显的影响。
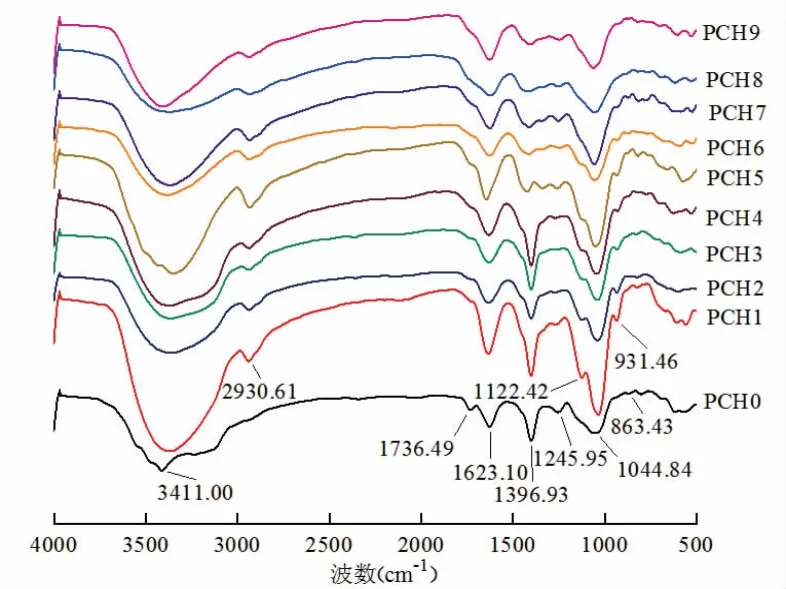
图5 不同蒸制次数黄精多糖的红外光谱图
4 讨 论
本研究中多糖及糖醛酸含量均随着蒸制次数的增加而降低,可能是由于炮制过程中持续的高温环境导致多糖部分水解成单糖和低聚糖,同时高温环境下多糖作为反应物与氨基酸、多肽或蛋白质发生美拉德反应而含量降低[24]。而糖醛酸含量的降低一方面可能是在炮制过程中伴随着多糖的流失造成的;另一方面可能是由于炮制过程中持续的高温环境使糖醛酸自身羧基发生降解或酯化[25],从而导致其含量降低。随着炮制次数的增加和蒸制时间的延长,黄精的色泽逐渐加深至黑色,这可能是因为在炮制过程中发生了复杂的美拉德反应产生类黑素[26]这一类新的有色化合物。
基于电子舌技术对味觉指标进行比较发现,不同蒸制次数的黄精主要在酸味、鲜味和涩味这3个指标上存在较大差异,且不同蒸制次数的黄精样品之间的滋味差异显著。随着蒸制次数的增加,酸味、涩味和甜味增加,而鲜味和咸味减小。CHENG X L等[27]利用电子舌技术探究生品黄精至“九蒸九制”10个不同黄精炮制品的味觉差异,其中酸味、涩味和鲜味变化与本研究的味觉变化结果基本一致。本研究中甜味的增加可能是由于黄精炮制过程中多糖或糖醛酸的降解,变成具有甜味的单糖,从而使得黄精炮制品甜味增加。而鲜味值逐渐减小,这可能与蒸制过程中氨基酸、有机酸这两种鲜味呈味物质的减少有关[28]。此外,5-羟甲基糠醛(5-HMF)是碳水化合物在美拉德反应中脱水和降解的反应产物,与色泽的加深和焦香气味的产生密切相关[29]。因此,黄精色泽与甜味、鲜味的变化可能与5-HMF、多糖、糖醛酸、氨基酸及有机酸这些物质的改变有关。
结合黄精炮制后色泽加深,推测经炮制后新产生的1、2、3号色谱峰对应的多糖可能是因为炮制过程中,黄精多糖成分与氨基酸、肽或蛋白质等在高温条件下发生美拉德反应,形成了大分子共聚物[30]。美拉德产物由多种挥发性和非挥发性化合物组成,如醛类、酯类和有机酸类。炮制温度不断升高,导致有机酸不断增加,pH值降低,使得黄精酸味呈增加趋势。这也进一步解释了蒸制导致黄精酸味增加的原因。本研究表明,5 kDa多糖的分子量在“九蒸九制”过程中明显减小且其含量也在降低。这可能是由于黄精炮制过程中随着温度的升高,这部分多糖糖苷键断裂而导致分子量减小[31],产生具有甜味的单糖从而使甜味增加,也进一步说明了电子舌试验结果中甜度增加的原因。6号峰对应的多糖峰面积随着蒸制次数的增加而增加,推测可能是炮制过程中一些小分子多糖聚合,或4号峰(5 kDa)的大分子多糖糖苷键断裂成这部分多糖。
本研究结果表明,在炮制过程中多糖是影响黄精滋味品质变化的一个重要因素,故监测这一关键呈味物质的变化可为研发更受市场欢迎的黄精功能食品提供新思路。
