帕金森病伴抑郁患者肠道菌群变化及其代谢功能分析
2023-05-12任腾竹李桂花梁肖玉郭琳玲刘新通
任腾竹, 李桂花, 梁肖玉, 郭琳玲, 刘新通
帕金森病(Parkinson′s disease,PD)是临床常见的神经变性疾病,其中抑郁为PD最常见的非运动症状之一。肠道菌群及其代谢产物与PD和抑郁症的发生、发展具有关联性。对散发PD患者的尸检发现,α-突触核蛋白(α-synuclein,α-syn)最早出现在肠道神经系统和迷走神经运动背核,提示PD发病可能起源于胃肠道[1]。迷走神经是脑-肠轴神经解剖的基础,可将肠道的各种信号传递至大脑,影响5-羟色胺(5-hydroxytryptamine,5-HT)、γ-氨基丁酸(γ-aminobutyric acid,GABA)的释放,实现对脑部高级活动、精神行为、认知功能的调控,提示肠道菌群可能通过神经内分泌等途径参与抑郁症的发病过程[2]。目前,国内PD伴抑郁(Parkinson′s disease and depression,DPD)患者肠道菌群特征的研究报道尚鲜见。鉴此,本研究通过高通量测序技术对受试者肠道菌群进行分析,旨在探究DPD患者的特征性肠道菌群及差异代谢通路,以进一步明确DPD的发病机制,为DPD的无创性诊断和治疗提供新的证据。
1 对象与方法
1.1研究对象 选择2021年6月至2022年10月广东省第二人民医院神经内科收治的原发性PD患者95例,均符合2015年国际运动障碍协会(Movement Disorder Society,MDS)制订的原发性PD的诊断标准[3]。根据第4版《精神障碍诊断与统计手册》中关于抑郁障碍的诊断标准[4]分为DPD组(48例)和帕金森不伴抑郁组(NDPD组,47例)。DPD组汉密顿抑郁量表(Hamilton Depression Scale,HAMD)评分≥7分。选入PD患者的健康配偶43名作为对照组,符合中华医学会老年医学学会建议的健康人标准[5]。排除标准:(1)因血管性、药物、中毒、外伤等原因所致的PD患者;(2)原发性震颤、进行性核上性麻痹、多系统萎缩、皮质基底节变性等帕金森叠加综合征患者;(3)有脑卒中、痴呆、其他精神疾病及其他中枢神经系统变性患者。研究对象均来自广东省及周边地区,饮食结构相似,均衡饮食(无素食主义者),无种族差异。本研究获医院医学伦理委员会批准(2021-KZ-049-03),所有研究对象签署知情同意书。
1.2量表评分 所有受试者完成日常生活活动能力(Activity of Daily Living,ADL)量表评分及简易智力状态检查(Mini-mental State Examination,MMSE),需具有日常生活自理能力且无认知功能障碍(MMSE评分要求:教育年限<6年者,≥19分;教育年限为7~12年者,≥22分;教育年限超过12年者,≥24分)[6]。PD患者完成MDS统一帕金森病评分量表的第3部分(MDS Unified-Parkinson Disease Rating Scale-Ⅲ,MDS-UPDRS-Ⅲ)评分,Hoehn-Yahr分级量表(Hoehn and Yahr scale,H-Y)评分和PD患者生活质量问卷(the 39-Item Parkinson′s Disease Questionnaire,PDQ-39)评分。
1.3粪便标本采集、PCR扩增及高通量测序 采集研究对象新鲜、中后段、内部粪便,避免厕所污水及马桶上微生物的污染,收集于含有保存液的、专用的无菌微生物DNA采集保存管中。样本采集量≥2 g,采集完成24 h内放入-80 ℃冰箱冻存备检。本研究采用细菌16SrDNA V3-V4区特异性引物进行PCR扩增,PCR产物采用凝胶回收试剂盒进行纯化。纯化的PCR产物通过PCR的方法添加测序需要的接头和barcode,产物采用凝胶回收试剂盒进行纯化。纯化的PCR产物采用qPCR进行定量后按照等摩尔比进行混合,完成文库构建,应用Illumina MiSeq高通量测序平台进行测序。PCR扩增及高通量测序由微基生物科技(上海)有限公司完成。
1.4生物信息学分析 使用Mothur软件在97%相似水平下对所有序列进行可操作分类单元(operational taxonomic units,OTUs)归类。α及β多样性分析是基于OTUs的计数统计。α多样性是指一个特定区域或生态系统内的多样性,是反映丰富度和均匀度的综合指标。β多样性是指沿环境梯度不同生境群落之间物种组成的差异性。α和β多样性分析使用Mothur、QIIME和R软件等进行分析。以Bray-Curtis距离矩阵和UniFrac分析来展示不同样本之间的β多样性差异。其中weighted考虑物种的丰度,unweighted没有对物种丰度进行加权处理。组间多样性差异的显著性由ANOSIM检验来确定,检验水准α=0.05。在获知组间主要差异物种的基础上,利用Lefse(LDA effect size)软件进行线性判别分析(linear discriminant analysis,LDA),对数据降维和评估显著差异物种的影响力(LDA分值>2)。通过拷贝数对OTUs表进行归一化,并使用KEGG数据库进行比对,对菌群代谢功能进行PICRUSt2代谢功能分析。通过Kruskal-Wallis检验方法得到对照组、DPD组和NDPD组间KEGG第三层级的、显著差异的代谢途径。在此基础上对三组相对丰度均值求和后,对相对丰度最高的前20个代谢通路进行排序。
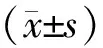
2 结果
2.1三组一般临床资料比较 三组体质量指数(body mass index,BMI)、MMSE评分、HAMD评分比较差异有统计学意义(P<0.05)。见表1。

表1 三组一般临床资料比较
2.2三组肠道菌群多样性比较 与对照组相比,DPD组和NDPD组的菌群α多样性显著升高(P<0.05)。见图1ⓐ。基于Bray-Curtis距离矩阵的β多样性分析结果显示,DPD组和NDPD组在属水平上的肠道菌群构成差异有统计学意义(ANOSIM test:R=0.111,P=0.022)。见图1ⓑ。基于UniFrac分析的Weighted-UniFrac β多样性分析结果显示,DPD组和NDPD组的肠道菌群构成存在显著差异(ANOSIM test:R=0.084,P=0.036)。见图1ⓒ。结果提示三组间肠道菌群的菌种丰度及构成存在差异。
2.3三组肠道菌群构成比及菌属差异比较 DPD组放线菌门(Actinobacteria)、互养菌门(Synergistetes)丰度较对照组和NDPD组增加,与对照组比较差异有统计学意义(P=0.006;P=0.018),但与NDPD组比较差异无统计学意义(P=0.466;P=0.987)。见图1ⓓ。进一步的LDA结果显示,放线菌门、互养菌门为DPD组门水平的差异性菌群。红蝽菌目(Coriobacteriales)、互养菌目(Synergistales)为DPD组目水平的差异性菌群;理研菌科(Rikenellaceae)、红蝽菌科(Coriobacteriaceae)、互养菌科(Synergistaceae)为DPD组科水平的差异性菌群。DPD组差异菌属包括:另枝菌属(Alistipes)、Anaerotruncus属、Dielma属、霍尔德曼氏菌属(Holdemania)、芽胞杆菌属(Cloacibacillus)、柯林斯氏菌属(Collinsella)。见图1ⓔ,表2。NDPD组差异菌属包括:瘤胃菌属(Ruminococcus);Adlercreutzia属;Christensenella属、Barnesiella属、Coprococcus属、Butyricimonas属、Anaerofilum属、Odoribacter属、Fusicatenibacter属、乳杆菌属(Lactobacillus)。见图1ⓔ。

ⓐ三组α多样性指数比较;ⓑ在OTU水平上,三组基于Bray-Curtis距离矩阵的β多样性分析结果;ⓒ在OTU水平上,三组基于Weighted-UniFrac的β多样性分析结果;ⓓ三组在门水平上的菌群相对丰度;ⓔ三组特征性肠道菌群LDA值分布的直方图
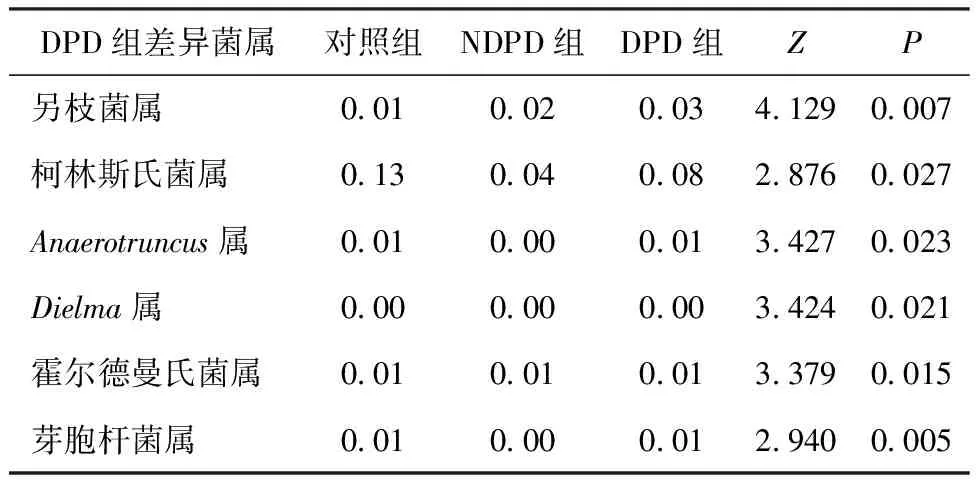
表2 DPD组差异性菌属在三组间的相对丰度比较结果
2.4DPD组差异性菌属相对丰度与抑郁评分的相关性分析结果 Spearman秩相关性分析结果显示,另枝菌属、Anaerotruncus属、Dielma属、霍尔德曼氏菌属、芽胞杆菌属、柯林斯氏菌属的相对丰度与HAMD评分呈正相关。见表3。

表3 DPD组差异性菌属相对丰度与HAMD评分的Spearman秩相关性分析结果
2.5DPD患者差异性肠道菌群的功能分析结果 通过PICRUSt2分析DPD患者差异性肠道菌群的代谢功能,通过Kruskal-Wallis检验方法获得第三层级排名前20的显著差异通路。结果显示,DPD组差异性肠道菌群的显著代谢通路包括:光合生物中的碳固定(DPD组 vs NDPD组,P=0.005;DPD组 vs 对照组,P=0.033;NDPD组 vs 对照组,P=0.534)和抗坏血酸抵抗(DPD组 vs NDPD组,P=0.019;DPD组 vs 对照组,P=0.431;NDPD组 vs 对照组,P=0.098)。NDPD组显著代谢通路包括:细菌双组分调节系统、丙酮酸盐代谢、细菌的聚量效应、泛酸和辅酶A生物合成、缬氨酸生物合成、亮氨酸和异亮氨酸生物合成、万古霉素抵抗、细菌趋药性、胰高血糖素信号通路、凋亡通路、流体剪切应力与动脉粥样硬化代谢通路和AMPK代谢通路。对照组显著代谢通路包括:果糖和甘露糖代谢、脂多糖生物合成、叶酸生物合成、戊糖和葡萄糖醛酸内酯相互转化、维生素B6代谢通路、生物碱代谢通路。见图2。

图2 显著差异通路结果图(top 20,*P<0.05)
3 讨论
3.1PD患者的DPD发病率高达50%,多发生于PD的早期阶段,对患者生活、认知和社会功能造成严重影响[7]。研究发现肠道细菌及其代谢产物可启动天然免疫应答,增强α-syn的炎症作用,并诱导α-syn的聚集和错误折叠,导致多巴胺(dopamine,DA)神经元凋亡[8]。DPD的发生可能与PD本身发病机制相关,DPD患者黑质致密部中DA神经元的丢失约是NDPD患者的7倍[9]。鼠李糖乳杆菌可升高应激小鼠海马区等情绪相关脑区的GABA受体亚单位的表达水平,进而减轻应激相关的抑郁样行为,表明肠道菌群对神经递质的调控可能与抑郁症相关[10]。单胺神经系统退行性病变导致DPD发病是目前较为公认的观点,但与原发性抑郁相比,DPD更多表现为焦虑不安、易怒、悲伤、对未来感到悲观、自杀念头,而负罪感、自责、失败感及自杀率较低。肠道菌群参与PD及抑郁症的发病机制已有研究证实,然而目前针对DPD的病因学研究尚无明确定论,且临床实践发现经药物治疗后仍有部分患者的抑郁症状未得到有效缓解,并存在不同程度的副作用。
3.2随着生物信息学技术在神经科学领域的发展,通过高通量测序技术探究DPD患者特征性肠道菌群,为寻找DPD肠道生物标志物、阐明发病机制及早期诊断和精准治疗提供了理论依据。本研究探讨了DPD患者特征性肠道菌群,α多样性分析结果发现PD患者肠道菌群的物种多样性较健康者增加,这与既往研究一致[11]。此外,本研究证实了DPD和NDPD组之间,尤其是在属水平上,β多样性指数存在显著差异。结果表明DPD患者的肠道菌群成分结构与NDPD患者和健康人群存在差异。
3.3本研究结果显示,在门水平上,与对照组相比,DPD组放线菌门丰度显著增加,而拟杆菌门丰度显著减少,这与此前有关PD[12]及抑郁症[13-14]患者特征性肠道菌群的研究结论相同。本研究结果显示,DPD患者红蝽菌科的柯林斯氏菌属丰度均显著增多。红蝽菌科容易定植于黏膜表面[15],在应激反应小鼠模型盲肠中显著增加,与活性氧的产生呈正相关,其致病性可能与肠道屏障和代谢功能障碍有关。丹毒丝菌科(Erysipelotrichaceae)的霍尔德曼氏菌属在抑郁症伴高血压患者肠道菌群中丰度增加,并与患者的焦虑、压力水平呈正相关[16]。丹毒丝菌科产丁酸菌属与许多代谢疾病相关[17-18],这可能与其释放的脂多糖介导的炎症反应有关,提示该菌可能在维持免疫平衡中发挥一定作用。本研究发现DPD组丹毒丝菌科中霍尔德曼氏菌属、Dielma属增加,与上述研究结论一致。但也有报道称PD患者中丹毒丝菌科相对丰度减少[19]。提示Dielma属和霍尔德曼氏菌属可能为DPD患者的特征性肠道菌群标志物。此外,本研究分析得出互养菌门、芽胞杆菌属在DPD患者肠道菌群显著增加。癫痫焦虑伴抑郁患者肠道菌群芽胞杆菌属丰度增高,且随着癫痫发作严重程度加重不断升高[20]。互养菌目在系统性红斑狼疮患者肠道中丰度增加,提示该菌与免疫炎症相关[21]。
3.4本研究结果表明,另枝菌属在DPD患者中显著升高,与先前PD[11]及抑郁症[13]相关研究一致。血清素是色氨酸转化后的产物,另枝菌属的增加会降低血清素的利用率,而血清素减少与抑郁症发生相关[22]。然而,另枝菌属丰度增加也可能有抗抑郁作用。肠道菌群的代谢产物短链脂肪酸(short chain fat acids,SCFAs)可以保持肠道上皮的完整性,调节免疫应答反应和免疫调节功能,降低DNA氧化损伤,降低人体炎症水平和增强胃肠道运动机能[23]。另枝菌属是SCFAs的主要生产者,另枝菌属丰度降低会导致SCFAs减少,加剧神经免疫炎症反应[24]。另枝菌属可表达谷氨酸脱羧酶,可将谷氨酸代谢为GABA。另枝菌属丰度增加则GABA神经元活性增强,从而提升GABA神经递质水平达到抗抑郁效果[25]。
3.5PICRUSt2能够帮助研究者理解微生物功能的改变。本研究发现,DPD组特征性肠道菌群与光合生物中的碳固定和抗坏血酸抵抗这两条代谢通路相关。一项蛋白组学研究结果指出,蛋白酰化显著富集在以碳代谢为特征的代谢通路中[26]。蛋白质乙酰化已被证实广泛参与枯草芽胞杆菌属的多种生化过程,包括趋化作用、营养代谢、应激反应和毒素合成,从而调节细胞代谢[27]。抗坏血酸作为一种还原性维生素在中枢神经系统中参与抗氧化、酶辅助及神经调制等过程,临床试验和动物实验研究均表明抗坏血酸具有抗抑郁作用[28]。抗坏血酸代谢途径显著富集于精神分裂症患者的肠道菌群,且精神分裂症患者肠道菌群中柯林斯氏菌属相对丰度显著高于健康对照组[29]。以上结果提示,DPD患者芽胞杆菌及柯林斯氏菌属可能通过蛋白质乙酰化、抗坏血酸抵抗代谢途径参与多种生物合成、代谢过程,而其与DPD的发生、发展是否具有相关性仍有待进一步研究。
3.6近期有研究证实菌群α多样性与体脂率呈负相关,即体脂率越高,菌群α多样性越低;瘤胃球菌与体脂率的相关性最强[30]。本研究中DPD组BMI较另外两组显著增高,而DPD组α多样性显著增高,但瘤胃球菌并非DPD组差异性菌属。本研究团队的前期研究发现紫单胞菌科为PD伴认知功能障碍特征性菌属[31],而对照组紫单胞菌科丰度较其他两组并无显著增高。因此认为,BMI及认知功能评分虽存在组间差异,但对本文特征性菌群结果的影响不大。
3.7本研究纳入了PD组的健康配偶作为对照组,他们拥有相似的生活环境和饮食习惯,具有较好的匹配性。但是,本研究也存在一定的局限性:(1)研究样本均来自广东省,限制了研究结果的广泛适用性;(2)粪便采样及分析仅限于单病程阶段。在下一步的研究中,研究团队将招募更多患者,进行亚组分析(地区、饮食结构、病程等),并对本文得出的差异菌群展开验证实验,探究显著差异代谢通路在DPD患者肠道中的相关菌群及其作用机制,为DPD的诊断和治疗提供新的线索和理论依据。
综上所述,肠道菌群结构、特征性差异菌属及其代谢通路的变化可能与DPD的发生、发展有关,值得进一步探索。
