基于3D APTw影像组学模型预测脑胶质瘤IDH突变状态及WHO分级的研究
2023-05-12秦倩,高翾,张岚,汪晶
秦 倩, 高 翾, 张 岚, 汪 晶
脑胶质瘤是最常见的脑内原发性恶性肿瘤。2021年世界卫生组织(World Health Organization,WHO)中枢神经系统分类标准将分子分型指标纳入了脑胶质瘤分类诊断标准,如异柠檬酸脱氢酶(isocitrate dehydrogenase,IDH)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、端粒酶逆转录酶(telomerase reverse transcriptase,TERT)等,据此将脑胶质瘤分为了1~4级[1]。相关研究表明,不同分子分型的脑胶质瘤患者的预后有显著差异[2-3]。Parsons等[4-5]发现,IDH突变型脑胶质瘤的侵袭性相对较低,对放化疗敏感,总体生存期较IDH野生型长。脑胶质瘤的分级也与患者的预后密切相关,脑胶质瘤级别越高,患者的生存时间越短[6],因此对脑胶质瘤患者进行准确的IDH突变状态预测和WHO分级有助于评估预后。目前,病理活检是诊断胶质瘤分子生物学特征的主要依据,但其属于有创操作且实验结果受到肿瘤异质性的影响。酰胺质子转移加权(amide proton transfer-weighted imaging,APTw)成像是一种新型MRI技术,可以反映内源性游离蛋白质及多肽的浓度[7],为探索细胞的分子代谢提供了一种潜在方法。影像组学可以更大程度地分析、利用影像图像中的信息[6,8]。目前基于2021年脑胶质瘤新分类标准和3D APTw序列的影像组学研究较少。Han等[9]采用的是基于2D APTw的影像组学模型预测脑胶质瘤IDH突变状态且样本量较少(59例),其曲线下面积(area under the curve,AUC)值为0.700~0.892。本研究中脑胶质瘤的诊断标准按照2021版WHO中枢神经系统肿瘤分类,采用基于3D APTw成像的影像组学方法构建预测模型,探讨其在预测脑胶质瘤IDH突变状态及WHO分级中的应用价值。
1 资料与方法
1.1临床资料 回顾性分析我院2021年4月至2022年9月经手术病理证实且完成术前APTw成像评估的98例脑胶质瘤患者。纳入标准:(1)经手术病理证实为脑胶质瘤,且行IDH免疫组织化学分析和相关基因测序;(2)术前MRI检查包括T1加权像(T1 weighted image,T1WI)、液体衰减反转恢复序列(fluid attenuated inversion recovery,FLAIR)、T1增强扫描(contrast examination-T1 weighted image,CE-T1WI)、3D-APTw成像序列;(3)MR检查前均未进行手术、放化疗及其他抗肿瘤药物治疗。排除标准:(1)合并脑出血、脑梗死等脑内相关病症者;(2)图像质量不佳影响病灶观察,不能用于图像分析的病例。本研究获医院伦理委员会批准[2021伦理字(0984)号]。
1.2MRI检查方法 所有患者于术前使用3.0 T(飞利浦Ingenia CX)MR扫描仪配合32通道头线圈行头颅MRI扫描检查。扫描序列包括T1WI、FLAIR、CE-T1WI、3D-APTw序列。FLAIR:重复时间(repetition time,TR)4 800 ms,回波时间(echo time,TE)300 ms,矩阵252×252,视野(field of view,FOV)250 mm×250 mm,层厚2 mm;T1WI及CE-T1WI:TR 8.2 ms,TE 3.7 ms,矩阵256×256,FOV 240 mm×240 mm,层厚 1 mm;3D-APTw序列:TR 5 925 ms,TE 8.3 ms,FOV 230 mm×200 mm,空间分辨率1.8×1.8×6 mm3,回波链长度174,信号平均次数(number of average,NSA)1,饱和功率2 μT,饱和持续时间2 s。
1.3病灶分割 在ITK-SNAP软件(3.8.0版本)上,参考CE-T1WI、T2-FLAIR影像图像确定病灶的强化区、坏死区及瘤周水肿区,手动勾画相应区域轮廓,并在APTw图像上完成上述三类区域的分割。
1.4影像组学特征提取与选择 对APTw图像上提取病灶的强化区、坏死区及瘤周水肿区三类区域,分别按照成强化区和整个病灶(强化区、坏死区及瘤周水肿区)提取图像特征。首先在原始APTw图像基础上,分别进行Wavelet、LoG、Square、SquareRoot、Logarithm、Exponential、Gradient、LocalBinaryPattern2D及LocalBinaryPattern3D处理,然后在原始APTw图像及衍生图像上,提取First Order、Shape、Gray Level Co-occurrence Matrix、Gray Level Size Zone Matrix、Gray Level Run Length Matrix、Neighbouring Gray Tone Difference Matrix、Gray Level Dependence Matrix特征,总共提取到1 476个图像特征(见图1)。所有图像特征利用开源软件包pyradiomics(https://pyradiomics.readthedocs.io/en/latest/index.html)完成。对提取到的影像组学特征,按照预测脑胶质瘤IDH突变状态、WHO分级的任务,利用Least Absolute Shrinkage and Selection Operator(LASSO)方法,分别对已有的影像组学特征进行特征选择,以除去冗余特征。

图1 基于APTw序列进行机器学习的研究流程图
1.5分类器模型的构建和性能评估 本研究构建了脑胶质瘤IDH突变状态、WHO分级的预测模型。所采用的分类器包括XGBoost、Random Forest、Logistic Regression和Support Vector Machine。对每个分类器,分别训练并评估其对每幅图像的预测能力。采用五折交叉验证训练并评估模型。采用受试者工作特征(receiver operating characteristic,ROC)曲线评估所构建模型的效能。分类器模型使用Python语言及开源软件包scikit-learn(https://scikit-learn.org/)完成。

2 结果
2.1脑胶质瘤患者的IDH突变状态及WHO分级情况 本研究共纳入98例脑胶质瘤患者,其中IDH突变型43例,IDH野生型55例,两组患者年龄比较差异有统计学意义(P<0.05),性别比较差异无统计学意义(P>0.05)。WHO 2/3级32例,WHO 4级66例,两组患者年龄、IDH突变状态差异有统计学意义(P<0.05),性别比较差异无统计学意义(P>0.05)。见表1,2。
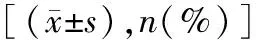
表1 98例脑胶质瘤患者的IDH突变状态

表2 98例脑胶质瘤患者的WHO分级情况
2.2分类器预测脑胶质瘤IDH突变状态的效能 当以整个病灶对应的酰胺质子转移(amide proton transfer,APT)区域来构建影像组学模型时,通过LASSO算法,从所有影像组学特征中保留17个特征。当以强化灶对应的APT区域来构建影像组学模型时,通过LASSO算法,从所有影像组学特征中保留19个特征。对筛选出的影像组学特征分别构建XGBoost、Random Forest、Logistic Regression及Support Vector Machine预测模型。以分子病理的结果为金标准,采用ROC曲线评估模型的预测效能(见图2)。当以整个病灶对应的APT区域来构建影像组学模型时,这4种机器学习模型的AUC值分别为0.778、0.800、0.797、0.792;当以强化灶对应的APT区域来构建影像组学模型时,这4种机器学习模型的AUC值分别为0.819、0.776、0.766、0.654。
ⓐⓑ以整个病灶对应的APT区域构建4种机器学习模型的ROC曲线及效能参数;ⓒⓓ以强化灶对应的APT区域构建4种机器学习模型的ROC曲线及效能参数
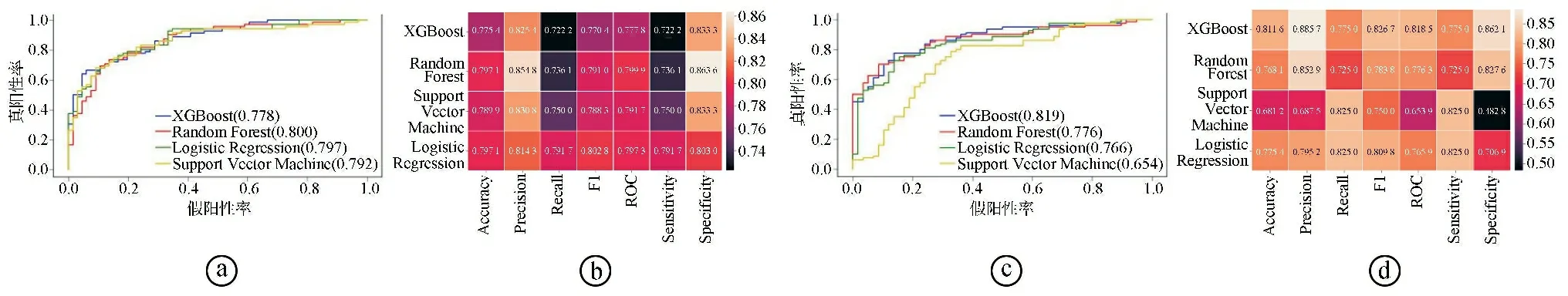
2.3分类器预测脑胶质瘤WHO分级的效能 以2021年第5版WHO中枢神经系统肿瘤分类为标准的病理结果为金标准,当以全瘤加瘤周水肿对应的APT区域来构建影像组学模型时,通过LASSO算法,从所有影像组学特征中保留7个特征。当以强化灶对应的APT区域来构建影像组学模型时,通过LASSO算法,从所有影像组学特征中保留14个特征。对筛选出的影像组学特征分别构建XGBoost、Random Forest、Logistic Regression及Support Vector Machine预测模型。采用ROC曲线评估模型的预测效能(见图3)。当以整个病灶对应的APT区域来构建影像组学模型时,这4种机器学习模型的AUC值分别为0.806、0.810、0.814、0.720;当以强化灶对应的APT区域来构建影像组学模型时,这4种机器学习模型的AUC值分别为0.810、0.803、0.817、0.783。
ⓐⓑ以整个病灶对应的APT区域构建4种机器学习模型的ROC曲线及效能参数;ⓒⓓ以强化灶对应的APT区域构建4种机器学习模型的ROC曲线及效能参数
3 讨论
3.1目前基于2021年脑胶质瘤新分类标准和3D APTw序列来预测脑胶质瘤IDH突变状态及WHO分级的影像组学研究较少且模型预测效能未知。本研究以2021年WHO中枢神经系统肿瘤分类方法为标准,探讨了基于3D APTw成像的影像组学模型预测脑胶质瘤IDH突变状态及WHO分级的价值,分别从整个病灶和强化灶中提取影像组学特征,采用XGBoost、Random Forest、Logistic Regression及Support Vector Machine 4种机器学习算法构建预测模型。结果表明,在预测脑胶质瘤IDH突变状态时,采用XGBoost机器学习算法以强化灶构建的影像组学模型预测效能最佳,其AUC值为0.819;在预测脑胶质瘤WHO分级时,4种机器学习模型诊断效能相似,基于全瘤及瘤周水肿与强化灶的影像组学模型预测效能也基本相似。
3.2术前准确识别脑胶质瘤的IDH突变状态和WHO分级对患者的临床诊疗具有十分重要的意义,它与患者的治疗方案选择及预后判断密切相关。2021年WHO中枢神经系统分类标准将IDH分子分型指标纳入了脑胶质瘤分类诊断标准。IDH作为三羧酸循环的限速酶,能够催化异柠檬酸生成α-酮戊二酸(α-ketoglutaric acid,α-KG)和还原性辅酶Ⅱ(nicotinamide adenine dinucleotide phosphate,NADPH)。有研究发现IDH突变可导致肿瘤代谢物D-2-羟基戊二酸的产生,进而抑制肿瘤细胞增殖[10]。与IDH野生型相比,IDH突变型脑胶质瘤生长速度较慢,在经过放化疗后总体生存期和无进展生存期更长[11]。低级别胶质瘤(low-grade gliomas,LGG)恶性程度较低,中位生存期为8~10年;高级别胶质瘤(high-grade gliomas,HGG)侵袭性强,恶性程度更高,预后更差[12]。由于不同IDH分子分型和WHO分级的治疗方案及预后有显著差异,因此术前无创性预测脑胶质瘤IDH突变状态及WHO分级具有重要的临床价值。
3.3基于2016版WHO中枢神经系统肿瘤分类标准,近年来许多研究将MRI与影像组学结合建立机器学习模型来预测脑胶质瘤IDH分子分型及WHO分级。Arita等[13]基于299例脑胶质瘤患者的T1WI、T2WI、T2-FLAIR及CE-T1WI序列构建了IDH突变状态预测模型,预测准确度为0.83。Zhang等[14]基于73例患者的T2WI、T2-FLAIR、CE-T1WI序列,运用Support Vector Machine机器学习算法构建了IDH突变预测模型,发现基于T2WI序列的预测模型效能最好,其AUC值为0.83。Huang等[15]利用59例患者的MRI图像构建机器学习模型,发现基于CE-T1WI序列的影像组学模型能较好地预测脑胶质瘤IDH突变状态和WHO分级,AUC值分别为0.90、0.91,基于T2WI序列的影像组学模型预测O6-甲基鸟嘌呤-DNA-甲基转移酶(O6-methylguanine-DNA-methyltransferase,MGMT)甲基化状态的AUC值为0.86。Ditmer等[16]采用基于94例患者的T2-FLAIR序列及CE-T1WI序列的影像组学模型来预测脑胶质瘤WHO分级,研究发现基于CE-T1WI序列的预测模型效能最佳,其AUC值为0.90。上述研究表明基于常规MRI成像的影像组学模型在脑胶质瘤术前诊断中具有重要价值。
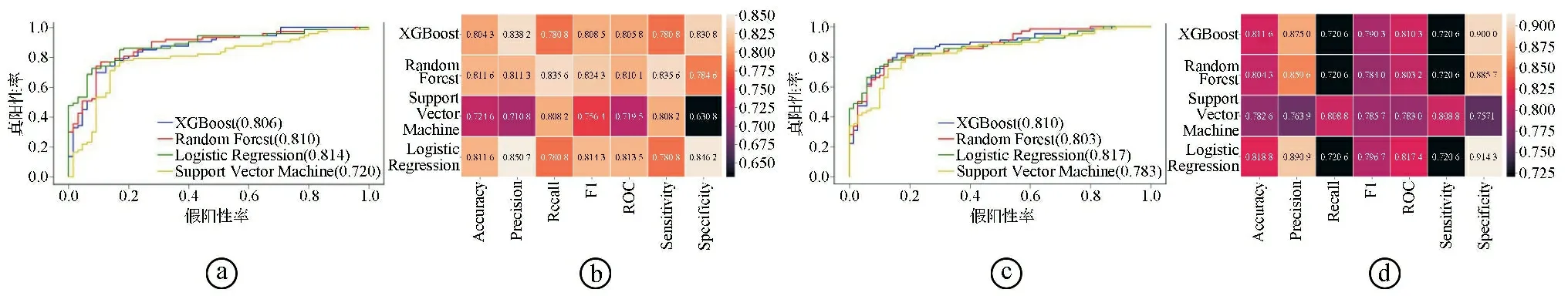
3.4但是常规MRI序列主要提供肿瘤的形态学信息,隐藏在影像图像中的特征数据有限,构建的预测模型对术前病变的诊断准确性及分级存在不足。目前,脑胶质瘤的影像组学研究主要集中在MRI常规序列[17]。APTw成像是一种基于化学交换饱和转移(chemical exchange saturation transfer,CEST)显像技术的功能MRI成像序列,利用特定的饱和脉冲,使酰胺质子中的氢质子充分预饱和,并与周围自由水中的氢质子发生化学交换,通过测量氢质子交换前后的信号变化差值,能够半定量检测组织内酸碱度及内源性游离蛋白质和多肽的浓度,提供体内分子代谢信息[18]。APT效应与体内酰胺质子浓度及pH值呈正相关,细胞代谢越活跃,其内蛋白质含量增多,APT值越高。肿瘤在分子水平上的改变往往早于形态学变化,因此可以采用APTw成像获取分子水平信息,为肿瘤的临床治疗决策提供重要依据。Choi等[19]通过分析46例脑胶质瘤患者的APTw成像,发现胶质瘤分级越高APT信号越高[Ⅱ级为(0.84±0.60)%,Ⅲ级为(1.55±0.87)%,Ⅳ级为(2.53±0.70)%],APT信号在Ⅱ、Ⅲ、Ⅳ级之间的差异有统计学意义(P<0.001)。多项研究也表明,HGG细胞代谢旺盛,所产生的游离蛋白质及多肽浓度更高,因此HGG的APT信号强度增加,高于LGG[20]。Jiang等[21]通过对27例脑胶质瘤患者的APT图像进行统计分析,结果发现IDH野生型胶质瘤的APT信号强度明显高于IDH突变型胶质瘤,其中APTwmax的预测效能最佳,AUC值为0.89。Joo等[22]也发现不同IDH分子分型脑胶质瘤的APTw差异有统计学意义(P<0.001)。多项研究指出胶质瘤术前APTw信号可以作为其预后的独立预测因子,APTw信号增加反映了肿瘤细胞增殖活跃及侵袭性的增加[23-24]。上述研究表明将APT信号加入预测模型能显著提高模型的预测效能。
3.5笔者研究发现基于APTw成像的影像组学模型能更好地定量提取每幅图像上信号强度的差异性,并提供更准确的图像生物标志物来预测脑胶质瘤分子生物学信息。Zhuo等[25]基于APTw序列采用Support Vector Machine机器学习算法构建影像组学模型,发现它能很好地预测H3K27M突变状态,准确度为0.88,灵敏度为0.92,特异度为0.80。Han等[9]研究了基于APTw序列的影像组学方法对脑胶质瘤IDH突变状态的预测效能,AUC值为0.700~0.892,但其采用的是基于2D APTw的影像组学模型。本研究基于2021年脑胶质瘤新分类标准,采用了3D APTw成像的影像组学方法。从多种机器学习得到的结果显示,所运用的各种机器学习方法在3D APTw图像的基础上对脑胶质瘤WHO级别的预测都可以达到相对较高的水平,但是对于IDH基因突变状态采用XGBoost机器学习算法以强化灶构建的影像组学模型预测效能最佳。因此,基于APTw成像的影像组学模型有助于术前评估脑胶质瘤的IDH突变状态及WHO分级。在今后的研究中引入更有力的分析方法,比如深度学习,有可能进一步提高预测效能。
3.6本研究存在的局限性:(1)单中心数据。所有数据来自本院,应与其他研究中心合作进行外部验证,以提高预测模型的普适性;(2)样本量较少。纳入研究的患者数量相对较少,可能存在患者WHO分级及IDH突变状态比例不平衡的问题,应进一步增加病例数提高模型的预测效能;(3)回顾性研究。本研究缺乏前瞻性,存在选择偏倚的问题。
本研究构建并验证了基于3D APTw成像的影像组学预测模型,构建的模型可以在术前有效预测脑胶质瘤的IDH突变状态及WHO分级。这种无创性预测技术能为患者的术前诊断、个性化治疗方案制定、预后评估提供重要信息,在未来的临床诊疗工作中具有广阔的应用前景。
