帕妥珠单抗联合曲妥珠单抗和多西他赛治疗三阳性乳腺癌的效果及近期预后观察
2023-05-11叶华斌陈凯旋
叶华斌,陈凯旋,叶 颖
(赣州市肿瘤医院,江西 341000)
乳腺癌居女性恶性肿瘤首位,近几年其发病率呈逐年增加且年轻化的趋势[1]。三阳性乳腺癌(TPBC)是以雌激素受体(ER)、孕激素受体(PR)、人表皮生长因子受体2(HER2)均呈阳性表达的乳腺癌,虽然占比较低,但恶性程度很高[2]。在TPBC 的治疗中,新辅助化疗因其能达到与接受标准术后化疗相似的疗效而受临床医师广泛青睐,被更多患者选择。多西他赛(DTX)、卡铂是乳腺癌化疗常用的一线药物,对乳腺癌细胞的生长繁殖有明显的抑制作用。研究表明,DTX 联合卡铂治疗HER2 阳性乳腺癌疗效可观[3]。但相关临床研究相显示,TPBC 患者即使接受化疗后,其预后仍较其他类型乳腺癌差[4]。因此,寻求安全、有效的TPBC 治疗方案致力于改善患者预后成为近年来乳腺癌研究的一大热点。帕妥珠单抗和曲妥珠单抗是治疗乳腺癌的分子靶向药物,可显著改善HER2 阳性乳腺癌患者的无病生存期和总生存期,在胃癌、非小细胞肺癌等疾病中的治疗中也同样安全有效[5]。目前,关于上述3 种药物联合治疗TPBC 未见报道。本研究选取80 例TPBC 患者,观察帕妥珠单抗联合曲妥珠单抗、DTX 治疗TPBC 的疗效及对患者近期预后的影响,旨在为临床治疗TPBC 提供借鉴,现报道如下。
1 资料与方法
1.1 一般资料 选取2019 年1 月—2021 年1 月本院收治的80 例TPBC 患者。纳入标准:①符合《2018年中国临床肿瘤学会乳腺癌治疗指南》[6](《指南》)中乳腺癌有关诊断,且经病理学、免疫组织化学检查证实为TPBC;②病理分期明确,初治时无转移;③预计生存期≥3 个月;④单侧乳腺癌;⑤规律治疗,签订知情同意书。排除标准:①合并其他恶性肿瘤;②治疗前伴肿瘤转移;③对本研究药物过敏;④心、肺、肝、肾严重障碍;⑤认知异常或严重精神疾病。80 例患者采用随机数字表法分为对照组(n=40)和联合组(n=40),两组基本资料均衡可比(P>0.05),见表1。本研究经医院伦理委员会审批通过。
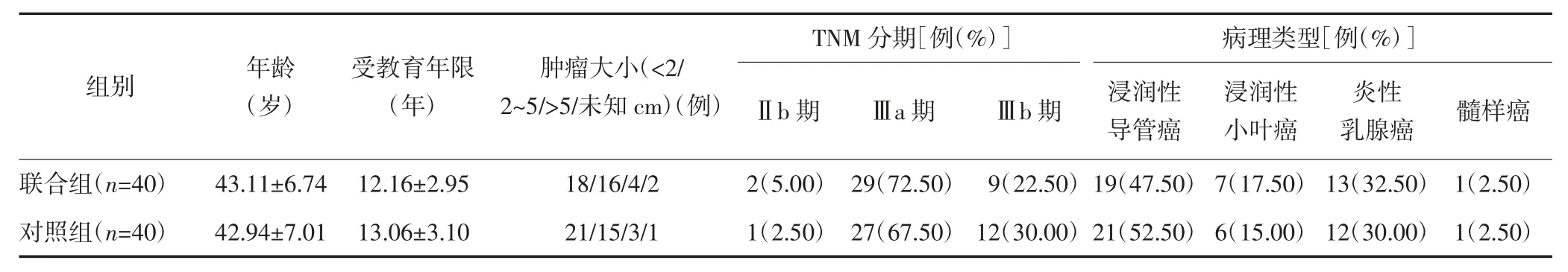
表1 两组基本资料比较
1.2 方法 参考《指南》,两组患者均予补充营养、止吐等基础治疗。对照组给予DTX+卡铂+曲妥珠单抗靶向治疗,DTX 75 mg/m2,静脉滴注d1,卡铂剂量mg=(血药浓度-时间曲线下的面积)AUC×(血肌酐清除率+25),AUC 取6,静脉滴注d1,曲妥珠单抗首剂8 mg/kg,静脉滴注d1,之后6 mg/kg,每周1 次。联合组在对照组的基础上加用帕妥珠单抗,首次840 mg,之后420 mg/次,静脉滴注d1,3 周1 次。两组3 周为1周期,均连续治疗6 个周期。化疗结束后所有患者均接受手术治疗。
1.3 观察指标
1.3.1 疗效评价 病灶全部消失,维持至少4 周为完全缓解(CR);病灶最长径总和减少≥30%,维持至少4 周为部分缓解(PR);病灶最长径总和减少<30%,变化介于PR 和PD 之间为病情稳定(SD);病灶最长径总和增加≥20%,甚至出现新病灶为疾病进展(PD)。以CR 和PR 计算总有效率[7]。
1.3.2 实验室指标测定 治疗前、疗程结束后检测糖类抗原125(CA125)、糖类抗原153(CA153)、癌胚抗原(CEA)水平,检测总T 淋巴细胞(CD3+)、辅助性T淋巴细胞(Th,CD3+CD4+)、抑制性T 淋巴细胞(Ts,CD3+CD8+)及自然杀伤(NK,CD16+CD56+)细胞表达。
1.3.3 不良反应 每周期治疗前后查血常规、肝肾功能,根据美国国家癌症研究所通用的毒性标准(NCICTC)v4.0 分级标准评价不良反应。不良反应主要包括恶心呕吐、肝肾功能损害、手足综合征、贫血、骨髓抑制。
1.3.4 近期预后 记录两组化疗后手术病理完全缓解(PCR)以及Miller- Payne 分级情况。两组术后行病理学检查,由本院2 位专家进行评估。参考文献[7],PCR 定义为乳房和腋下(ypT0/N0)无侵入性肿瘤。Miller-Payne 分级:1 级:肿瘤细胞数量总体上无减少;2 级:肿瘤细胞减少不超过30%;3 级:肿瘤细胞减少30%~90%;4 级:肿瘤细胞减少>90%;5 级:肿瘤瘤床部位切片未见浸润性癌细胞,但可存在导管原位癌。
1.4 统计学方法 数据分析使用SPSS 20.0 软件。血清CA125、CA153、CEA、T 淋巴细胞、Th、Ts 及NK 细胞以x±s 表示,两组间比较采用t 检验;疗效、不良反应、术后病理PCR、Miller-Payne 分级情况以例数和率(%)表示,组间比较采用χ2或连续性矫正χ2检验;等级资料采用秩和(Z)检验;检验水准α=0.05。
2 结果
2.1 两组临床疗效比较 治疗6 个周期后,联合组总有效率为67.50%,较对照组的45.00%更高(P<0.05)。见表2。
2.2 两组治疗前后血清肿瘤标志物比较 治疗前,两组CA125、CA153 和CEA 比较无统计学差异(P>0.05);疗程结束后,两组血清CA125、CA153 和CEA 均较同组治疗前明显降低(P<0.05),且联合组低于对照组(P<0.05)。见表3。
2.3 两组治疗前后免疫功能比较 治疗前,两组总T 淋巴细胞、Th、Ts 及NK 细胞比较均无统计学差异(P>0.05);联合组疗程结束后总T 淋巴细胞、Th、Ts及NK 细胞均有所升高,但与治疗前相比差异无统计学意义(P>0.05);对照组疗程结束后总T 淋巴细胞、NK 细胞与治疗前相比较无明显差异(P>0.05),而Th明显降低,Ts 明显升高(P<0.05);联合组疗程结束后Th 高于对照组,Ts 低于对照组(P<0.05)。见表4。

表2 两组疗效比较 例(%)
表3 两组治疗前后血清肿瘤标志物比较(±s)

表3 两组治疗前后血清肿瘤标志物比较(±s)
与治疗前同组比较,*P<0.05;与治疗后对照组比较,△P<0.05
时间 组别 CA125(U/ml) CA153(U/ml) CEA(ng/ml)治疗前 联合组 70.14±4.35 66.55±3.47 17.32±3.22对照组 70.80±4.56 65.04±3.68 17.68±3.09疗程结束后 联合组 41.24±3.21*△ 42.89±4.16*△ 7.32±1.58*△对照组 46.58±3.10* 47.58±5.03* 9.17±2.61*
表4 两组治疗前后免疫相关指标比较(±s)%
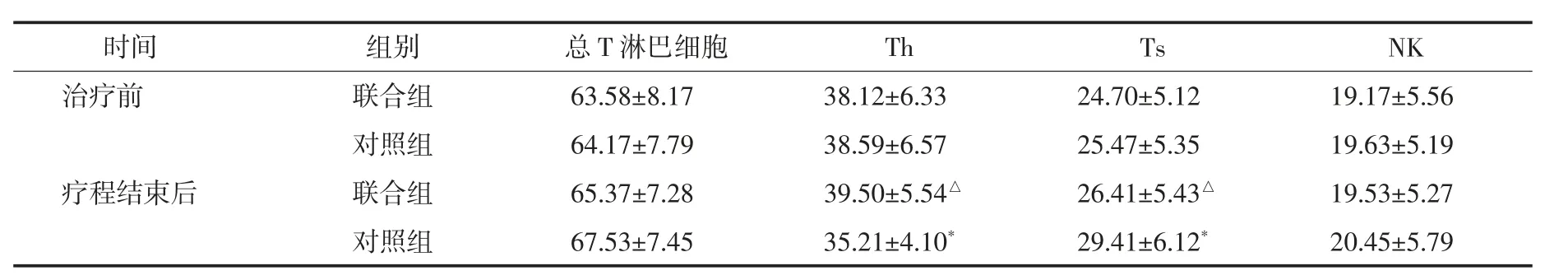
表4 两组治疗前后免疫相关指标比较(±s)%
与治疗前同组比较,*P<0.05;与治疗后对照组比较,△P<0.05
时间 组别 总T 淋巴细胞 Th治疗前 联合组 63.58±8.17 38.12±6.33对照组 64.17±7.79 38.59±6.57疗程结束后 联合组 65.37±7.28 39.50±5.54△NK 19.17±5.56 19.63±5.19 19.53±5.27对照组 67.53±7.45 35.21±4.10* 29.41±6.12* 20.45±5.79 Ts 24.70±5.12 25.47±5.35 26.41±5.43△
2.4 两组不良反应比较 两组患者均未见4 度及以上不良反应,治疗期间出现不良反应者,经对症处理好转。联合组恶心、呕吐、手足综合征、贫血总发生率较对照组更低(P<0.05)。见表5。
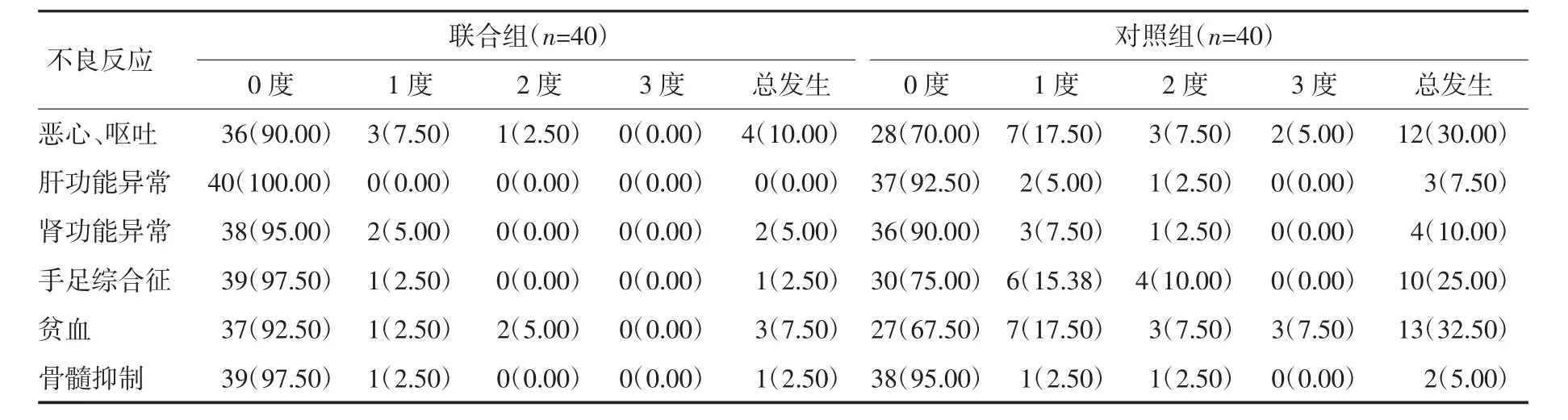
表5 两组不良反应比较 例(%)
2.5 两组近期预后比较 两组均顺利完成手术。联合组术后病理PCR 和Miller- Payne 分级3~4 级占比明显高于对照组(P<0.05)。见表6。
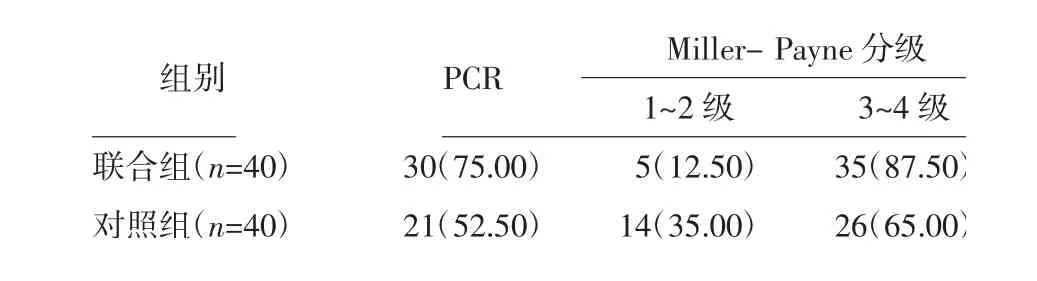
表6 两组术后病理PCR 和Miller-Payne 分级情况比较 例(%)
3 讨论
据流行病学统计,TPBC 占全部乳腺癌的10%~15%,尤其以45~75 岁中老年女性患者多见,此类患者多为浸润性导管癌,往往伴脉管系统或神经浸润,肿瘤较大,淋巴结转移率高[8]。目前的研究表明,TPBC对化疗、靶向治疗、内分泌治疗均敏感,采用上述方法治疗患者均能获益,但因个体化差异,患者预后仍很难达到期望的结果。新辅助化疗是乳腺癌治疗的重要组成部分,近年来接受新辅助化疗的患者比例显著增加,但各种化疗方案都存在不同程度的弊端,如疗效不佳、毒副反应明显等。DTX 为新一代紫杉烷类药物,其具有抗血管新生、放疗增敏等与紫杉醇相似的作用,并且在肿瘤细胞内的聚积浓度更高,滞留时间也相对更长,目前在乳腺癌、胃癌、非小细胞肺癌等领域已获得肯定的效果。DDP 是现阶段乳腺癌的常用化疗药物,以其为基础的联合化疗应用较广。研究表明,DTX 与DDP 联用能增加反应率和无肿瘤生存率[9]。近几年随着曲妥珠单抗、帕妥珠单抗的应用,乳腺癌患者尤其是HER2 阳性乳腺癌患者的预后得到明显改善。帕妥珠单抗和曲妥珠单抗均为定向单克隆抗体药物,前者主要通过与二聚化结构域结合,扰乱HER家族其他复合物形成,进而抑制HER2 表达;而后者可通过阻断HER2 介导的信号转导通路,降低细胞膜中HER2 蛋白浓度,达到抗血管生成的作用,诱导细胞凋亡[10]。鉴于帕妥珠单抗和曲妥珠单抗在乳腺癌的治疗中具有同样良好效果,本次研究将二者与DTX联合用于治疗TPBC 患者,结果显示,联合组近期总有效率(67.50%)高于对照组(45.00%),提示帕妥珠单抗联合曲妥珠单抗、DTX 可提升TPBC 疗效,与Hatschek[11]等的研究一致。
最新研究发现,血清肿瘤标志物(CA125、CA153、CEA)的表达及其改变对乳腺癌的发生、发展、诊断、预后判断有重要意义[12]。本研究显示,治疗前,两组血清CA125、CA153 和CEA 水平均较高,说明血清肿瘤标志物在TPBC 患者血清中均呈高表达。疗程结束后,两组血清CA125、CA153 和CEA 明显降低,且联合组低于对照组,可见帕妥珠单抗联合曲妥珠单抗、DTX 有助于进一步正向调节血清肿瘤标志物水平。考虑原因可能是:帕妥珠单抗联合曲妥珠单抗、DTX能协同增强细胞毒性作用,通过减少肿瘤细胞的血管生成抑制肿瘤细胞的恶性增殖,促进肿瘤细胞凋亡,缩小肿瘤体积,进而降低血清CA125、CA153 和CEA表达。值得注意的是,肿瘤可诱导机体免疫系统产生免疫应答反应,且较多研究已证实,乳腺癌患者多存在细胞免疫功能低下现象[13-14]。而化疗为全身性用药,在破坏肿瘤细胞的同时也会对正常细胞产生毒副作用,进一步导致免疫功能下降[15]。本研究显示,联合组疗程结束后总T 淋巴细胞、Th、Ts 及NK 细胞均与治疗前相比无显著差异;对照组疗程结束后总T 淋巴细胞和NK 细胞与治疗前相比无显著性差异,但Th明显降低,Ts 明显升高,差异有统计学意义,且联合组治疗期间恶心、呕吐、手足综合征、贫血等不良反应发生率均低于对照组。提示帕妥珠单抗联合曲妥珠单抗、DTX 对患者免疫功能影响小,并能有效减少化疗相关不良反应。另外,本研究显示,两组随访术后病理PCR 和Miller-Payne 分级3~4 级占比明显高于对照组,提示帕妥珠单抗联合曲妥珠单抗、DTX 能有效提升新辅助疗效,改善TPBC 患者预后。国外学者Squires 等[16]的研究报告称,曲妥珠单抗联合帕妥珠单抗化疗病理PCR 为45.8%,与单独使用曲妥珠单抗化疗的29.0%比较有明显的差异(P=0.014)。本研究与基本吻合,充分说明了曲妥珠单抗联合帕妥珠单抗双靶治疗优于曲妥珠单抗单靶点治疗,对于提升病理PCR 方面具有明显优势。
综上所述,帕妥珠单抗联合曲妥珠单抗、DTX 可有效降低TPBC 患者血清中肿瘤标志物表达,提高近期疗效,对患者免疫功能影响小且不良反应少,但并未改善患者近期预后。
