鸡球虫病疫苗研发新思考
2023-05-11汤新明龚玉姣史芳芸
秦 梅 汤新明 龚玉姣 史芳芸 王 思 索 勋*
(1.中国农业大学 科学技术发展研究院/中国农业大学学报编辑部,北京 100193;2.中国农业科学院 北京畜牧兽医研究所,北京 100193;3.中国农业大学 动物医学院,北京 100193)
球虫病是世界范围内畜禽的主要传染病之一,是由艾美耳属球虫(Eimeria)中的一种或多种寄生原虫感染引起的疾病,具有较高的发病率和死亡率。在畜牧生产中,以鸡球虫病危害最甚,每年给养鸡业带来超过100亿英镑的损失[1]。抗球虫药的大规模使用可有效控制球虫病的暴发和流行,保障养鸡业的发展。然而,耐药虫株的出现、药物残留和食品安全等问题越来越引起人们的关注,高效球虫病疫苗将成为球虫病防控的主力。目前,商品化的鸡球虫病疫苗主要为活卵囊疫苗[2-3],该疫苗可激发宿主产生高效且持久的保护性免疫应答[4-11]。但是由于活卵囊疫苗存在一定致病性、货架期短和生产成本高等缺点[12],亚单位或基因工程疫苗继而成为球虫病疫苗研究领域的热点。研究表明,重组蛋白、DNA疫苗或活载体疫苗等均能激发宿主产生一定的免疫应答,却达不到活卵囊疫苗的免疫保护效果。高效保护记忆性免疫应答是球虫病病原感染宿主和球虫病疫苗设计的基础。球虫活卵囊疫苗与球虫重组蛋白疫苗、DNA疫苗、活载体疫苗激发免疫应答的本质区别是什么?如何激发宿主产生高效保护记忆性免疫应答?这一科学问题的深入思考及解析对球虫病疫苗的研发具有很重要的指导意义。因此,本研究重点从免疫学角度解析球虫感染后产生保护性记忆免疫应答的机制并提出在新型球虫疫苗设计中诱导产生保护记忆性免疫应答的可行策略及评价疫苗效果的新思路,为开发高效的球虫病疫苗提供科学依据。
1 球虫感染的获得性免疫应答
1.1 体液免疫应答
艾美耳球虫感染激发宿主产生球虫特异的IgM、IgG和IgA抗体[13-14],其在保护性免疫应答中的作用尚存在争议。有研究表明,抗体在宿主抗球虫感染中作用很小[9,15-16],如切除法氏囊的鸡群可以抵抗小剂量50或500个柔嫩艾美耳球虫感染[17]。也有研究认为抗体在免疫保护中起着很重要的作用[18-21],如鸡群通过口服、静脉注射或皮下注射免疫活卵囊球虫疫苗后,在高峰期激发产生的IgG 抗体可以提供97%的免疫保护[22],将免疫过活卵囊球虫疫苗鸡群的卵黄抗体转移给未免疫过的鸡群后可以产生100%免疫保护[10,23]。
艾美耳球虫编码约8 600个蛋白质,基因组大小约为50~60 Mb[2,24]。免疫蛋白质组学研究显示,在656个蛋白质中,有101个蛋白质被柔嫩艾美耳球虫感染鸡群的特异性血清识别[24],表明艾美耳球虫感染后激发的体液免疫应答具有复杂性。以上数据揭示抗体在球虫感染中也发挥重要作用,但不能确定是直接作用还是间接作用,有关特异性抗体是否介导球虫抗原交叉递呈尚需要进一步研究,解析这一现象,将对免疫学领域乃至生物学领域有关免疫功能或更大的生物学功能冗余和叠加机制有更加深入的理解,是具有重要科学价值的研究方向。
1.2 细胞免疫应答
T细胞介导的细胞免疫应答在宿主抗球虫感染中占主导地位。研究发现,CD4+αβ T细胞在初次感染中起着重要的作用,但对再次感染的记忆免疫应答作用不是很明显[16,25]。然而,蠕型艾美耳球虫(E.vermiformis)感染MHC II CD4+T细胞缺陷的小鼠可激发产生95%的免疫保护[16,25]。
CD8+T 细胞的细胞毒性(CTL)途径在球虫感染中发挥重要作用。CD8+CTLs通过释放溶胞颗粒物—颗粒酶蛋白酶、穿孔素和抗菌肽颗粒溶素杀灭人类胞内病原如克氏锥虫(Trypanosomacruzi)、刚地弓形虫(Toxoplasmagondii)和利什曼原虫(Leishmania)等[26]。CD8+T细胞在抵抗球虫初次感染中的作用不是必需的,但在再次感染中更重要[11,23]。研究表明,鸡感染柔嫩艾美耳球虫后,盲肠组织中的穿孔素、颗粒酶A和FasL mRNA 表达量在初次感染后10 d和再次感染后的1~4 d均显著增加[27-28]。
除了IFN-γ介导的Th1细胞反应是鸡球虫病的主要免疫反应,Th17和调节性T细胞(Treg)在鸡球虫病的肠道内稳态方面也发挥着重要作用[5]。IL-17是Th17细胞免疫应答的标志,在球虫感染中具有促炎作用,但作用机制尚不清楚。鸡的CD4+CD25+T细胞被认为是Treg细胞,可通过产生大量的IL-10、TGF-β、CTLA-4和LAG-3抑制激活的免疫细胞[29]。研究表明,Treg细胞对艾美耳球虫感染后激发产生的保护性免疫反应的调节很关键,其分泌的IL-10在鸡球虫感染中发挥着重要作用[5]。Treg细胞还可通过抑制诱导组织发生炎性反应的Th17细胞减轻艾美耳球虫感染导致的肠道病理变化[5]。
艾美耳球虫感染宿主后激发产生的免疫应答是多方面的,尤其在再次感染中,多种效应机制协同发挥作用,有效控制艾美耳球虫的入侵、发育、复制和逃避,共同降低疾病的严重程度[16,23,30]。因此,设计或开发一种可产生多种协同效应的保护性免疫应答的高效抗球虫病疫苗至为关键。
2 球虫感染的高效保护性免疫应答的效应机制
免疫反应的最主要特征是识别自身和非自身,以及免疫记忆。无论是细胞免疫还是体液免疫,免疫记忆是任何疫苗研发工作的基础[31]。免疫记忆也是疫苗产生高效保护性免疫应答的基础。多项研究表明,被球虫感染过的鸡群可以在短时间内产生高效免疫反应,抑制球虫的早期发育[32-35],并进一步揭示出球虫病活卵囊疫苗的肠道保护性免疫应答机制[4-5,11,36-37]。不同类型球虫病疫苗激发产生的保护性免疫应答机制模拟图如图1所示。
2.1 多种效应因子共同协作参与保护性记忆免疫应答
在球虫感染中,与未感染的宿主相比,被球虫感染过的宿主在短时间内即可迅速产生大量的免疫效应因子[15,23,38-40],有利于抑制球虫子孢子的早期发育[41-42]。早期研究表明,鸡群再次感染巨型艾美耳球虫与初次感染巨型艾美耳球虫相比,在再次感染的早期,外周血中的中性粒细胞、淋巴细胞和单核细胞数量显著增多,这些先天性免疫细胞在抵抗球虫再次感染的早期发挥重要作用[43]。
细胞因子在激发和维持记忆性T细胞的免疫功能过程中也发挥着至关重要的作用[31]。如 IFN-γ 通过IL-15维持记忆性CD8+T细胞免疫应答,CD4+T细胞需要IL-12的刺激分化为功能性Th1型细胞[31]。在未感染的宿主早期阶段,只有NK细胞、ILC1(Group 1 innate lymphoid cell)、巨噬细胞或树突状细胞分泌一定量的IFN-γ,远远不足以抑制初次感染球虫后子孢子进入裂殖生殖。在艾美耳球虫初次感染中,IFN-γ是调节Th1型保护性免疫应答过程中很重要的免疫效应因子[5]。IL-17A 在球虫感染中上调表达,参与球虫子孢子和裂殖体的成熟和迁移,IL-17A中和抗体处理鸡群后,裂殖体体积缩小4.3倍,裂殖子的数量减少11倍[44]。
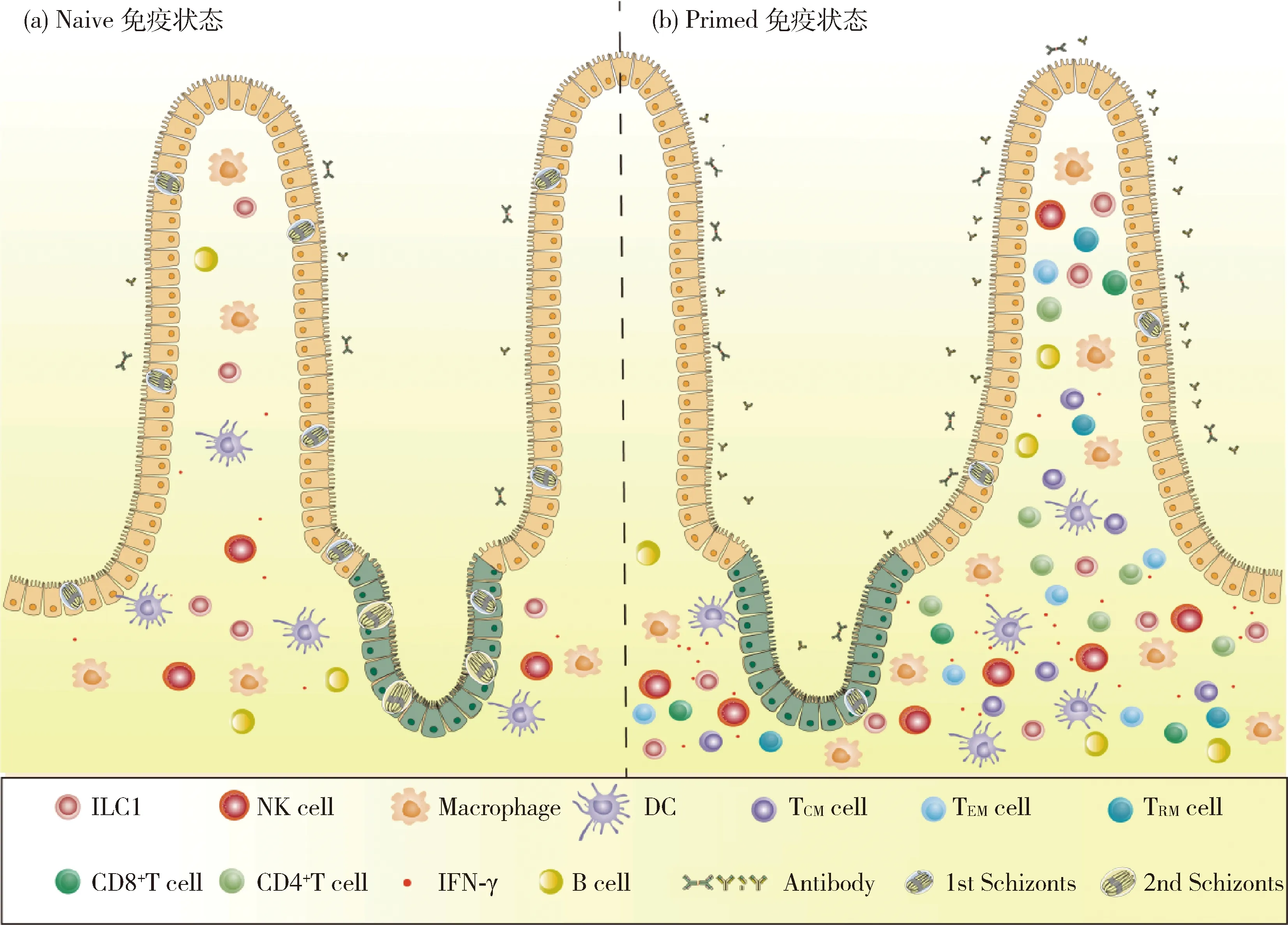
(a)Naive免疫状态:亚单位疫苗和DNA疫苗免疫鸡群后,肠道对鸡球虫的再次感染需经较长时间产生保护性免疫应答,参与免疫反应的免疫因子包括NK细胞、ILC1、巨噬细胞、树突状细胞和IFN-γ等,不足以抑制球虫子孢子入侵肠道后进入第一代裂殖生殖。(b)Primed免疫状态:活卵囊疫苗免疫后的鸡群诱导产生的记忆保护性免疫应答可抑制球虫子孢子的早期发育。鸡球虫特异性抗体可以在先天性免疫效应细胞和补体的作用下中和、调理和溶解入侵宿主细胞前的球虫子孢子;子孢子抗原激活肠道DC细胞,招募在肠道微环境中长期存在的组织常驻记忆细胞(TRM)、循环的效应记忆细胞(TEM)和中心记忆性T细胞(TCM),均以更快的方式参与艾美耳球虫的早期防御中,记忆性T细胞会迅速产生IFN-γ,初次免疫产生的CD4+T细胞会更好地维持记忆性CD8+T细胞,这样多种效应免疫因子协调作用,共同抑制球虫子孢子在肠道上皮或隐窝中发育成第一代裂殖体,进而抵抗球虫的再次感染,产生完全保护。(a) In naive chickens,after immunizing chickens with subunit vaccine and DNA vaccine,intestinal reinfection of chicken coccidia requires a long time to generate protective immune response.Limited involvers,including NK cells,ILC1,macrophages,dendritic cells and IFN-γ,cannot suppress the schizogony of numerous sporozoites,thus may first generation of schizonts are present.(b) In primed chickens,the memory protective immune response induced by chickens immunized with live oocysts vaccine can inhibit the early development of sporozoites.First,the specific antibody of chicken coccidia can neutralize,opsonize and lysis the sporozoites before invading host cells with the help of innate immune effector cells and complements.Second and most importantly,the sporozoite antigen activates intestinal D cells,recruits tissue resident memory cells (TRM),circulating effector memory cells (TEM) and central memory T cells (TCM) that exits in the intestinal microenvironment for a long time,and all participate in the early defense of Eimeria in a faster manner.The memory T cells will rapidly produce IFN-γ.The CD4+T cells produced by the initial immunization will better maintain the memory CD8+T cells.Such multiple effective immune factors work in concert to jointly inhibit the development of the first generation schizonts of sporozoites in the intestinal epithelium or crypt,thus resisting the reinfection of coccidia and generating complete protection.图1 不同种类的球虫病疫苗激发产生的保护性免疫应答机制模拟图Fig.1 Diagram of protective immune responses to anticoccidial infection after immunization with different type of coccidian vaccines
在肠道微环境中长期存在的组织常驻记忆细胞(Tissue-resident memory T cells,TRM)在遇到同源抗原或病原时可迅速增殖[45-46]。循环的效应记忆细胞(Effector memory T cells,TEM)被招募至发生炎性反应的组织中。中心记忆性T细胞(Central memory T cells,TCM)会迅速参与艾美耳球虫的早期防御。通过静脉注射CD4或CD8单克隆抗体处理的小鼠初次感染E.vermiformis后,对再次感染时激发产生的记忆性免疫应答几乎没有影响[23],这表明相对于TEM和TCM细胞,更有利于产生保护性免疫应答的TRM很难被注射的抗体完全清除,少量的TRM可以迅速增殖抵抗球虫的再次感染[47]。CD4+T细胞对记忆性CD8 T细胞的产生和维持具有重要作用[48-49]。E.pragensis初次感染小鼠时,与用CD8单克隆抗体处理小鼠相比,CD4单克隆抗体处理的小鼠对再次感染极度敏感[23]。αβ T 细胞在球虫初次感染和再次感染中均起重要作用。用TGD(Targeted gene disruption)处理的小鼠对镰形艾美耳球虫(E.falciformis)的初次感染和再次感染极度敏感[16,50]。与αβ T细胞相同,γδ T细胞具有长时间记忆能力,并能迅速扩增和产生IFN-γ[51]。此外,γδ T细胞不受MHC限制,更有助于抵抗艾美耳球虫感染。研究表明,抗原量和细胞因子是调节T细胞记忆应答产生、维持和发挥效应功能过程中的两大关键因素,还有助于记忆性T细胞向效应记忆细胞的转换[31]。
2.2 抑制球虫早期发育是产生保护性记忆免疫应答的重要特征
球虫早期内源性发育对产生保护性记忆免疫应答至关重要[52]。在球虫早期发育中,子孢子完全保护性抗原被免疫细胞递呈出来,这类早期抗原是研发亚单位或重组疫苗的靶标抗原。球虫特异性抗体在先天性免疫效应细胞和补体的作用下中和、调理和溶解入侵宿主细胞的球虫子孢子[13,34,53-54],球虫特异性的抗体可以将入侵肠道的球虫子孢子数量减少50%[34-35]。当次级淋巴器官中的一些记忆性B细胞遇到相同抗原后,可迅速分化为高亲和力的浆细胞,迅速增强清除病原的效率和效果,而不需要像初次感染时经历长时间的体细胞超突变和亲和力成熟,降低免疫应答的效果[55]。这也证实了球虫特异性抗体在球虫感染中具有减少子孢子数量且发挥记忆保护性应答的作用。
在球虫子孢子发育的早期阶段,除布氏艾美耳球虫和早熟艾美耳球虫子孢子在入侵处发育外,其他5种艾美耳球虫子孢子则转移到隐窝上皮处发育。细胞记忆性免疫应答可抑制球虫子孢子从肠道上皮细胞到肠隐窝细胞的移行。初次感染巨型艾美耳球虫的鸡群会阻止60%的球虫子孢子自肠道固有层上皮内细胞或巨噬细胞转运到肠隐窝细胞发育为第一代裂殖体[56]。球虫的寄生部位不同也会产生不同的记忆性免疫反应。巨型艾美耳球虫的寄生部位小肠除了含有淋巴滤泡还有Peyer’s 结。小肠这种独特的微环境与大肠相比会形成一群更高效的记忆性免疫细胞。无论子孢子从肠上皮细胞到隐窝的移行是否受到抑制,初次感染过的宿主都会抑制裂殖生殖。球虫再次感染48或60 h后,只有少数子孢子发育成第一代裂殖体,而且大多数子孢子在初次感染的宿主体内发育达不到滋养体阶段[32,35-56]。
3 当前球虫疫苗的研发现状与存在问题
目前获得许可的疫苗如灭活疫苗、重组亚单位疫苗、DNA疫苗等绝大多数均以激发宿主产生体液免疫应答为主,共同点是相对安全,但是激发宿主产生细胞免疫应答的能力较低。这些疫苗与球虫病活卵囊疫苗相比,在激发保护性记忆免疫应答方面存在本质区别,因而限制了其在预防以细胞免疫应答为主的病原引发疾病中的广泛应用。
3.1 球虫病活卵囊疫苗
首个球虫病活卵囊疫苗(Coccivac®;Schering-Plough,Union,NJ)于20世纪50年代初在美国上市[57]。研发原理是基于鸡群在初次感染后激发产生保护性记忆免疫应答并可经再次感染免疫保护力大大增强[58]。目前在全球范围内,商业化生产的至少有10种不同的活卵囊球虫病疫苗,区别在于艾美耳球虫的种类(野生虫株或减弱虫株)、疫苗中虫株的组合和免疫途径。减毒球虫病活卵囊疫苗免疫鸡群不仅可以产生持久性抗原,还可以诱导MHCI类抗原呈递且刺激CD8+T细胞保护性免疫反应,对鸡群的生产性能影响较小。其缺点是货架期短,生产成本较高。出于疫苗安全性、成本及免疫范围的考虑,目前亚单位疫苗、DNA疫苗和活载体疫苗替代球虫病活卵囊疫苗是研究的重要方向。
3.2 亚单位疫苗
球虫病亚单位疫苗CoxAbic®是纯化的亲和配子体抗原(Affinity-purified gametocyte antigens,APGA,含有Gam56、Gam82和其他大豆凝集素结合蛋白)和弗氏佐剂乳化而成,通过肌肉注射免疫蛋鸡。产生针对APGA特异性的母源抗体转移给子代,减轻球虫感染子代后的危害,接种该疫苗的子代卵囊排出可减少45%~80%[59]。保护性母源抗体可在母体内维持至少4个月,在子代体内最高可达3周[60]。
研究表明,分别融合表达Toll样受体5配体或鞭毛素FliC和柔嫩艾美耳球虫IMP1(EtIMPI)的重组亚单位疫苗经2次免疫鸡群,其可诱导产生较强的分泌IFN-γ的T细胞记忆性免疫应答,并减少88%的球虫卵囊排出[61]。但是,此项研究检测的是免疫后鸡群外周血中T细胞免疫应答,至于肠道上皮细胞是否可产生保护性记忆免疫应答完全阻止球虫卵囊的排出尚不清楚。另外,大肠杆菌表达的重组抗原破坏了原有的蛋白结构和蛋白的亲和性。因此,很多重组的球虫亚单位疫苗并没有完全激发宿主产生保护性免疫应答,降低了疫苗的保护效率,这与缺少球虫特异性的肠道CD8+TRM细胞密切相关[62]。
3.3 DNA疫苗
编码艾美耳球虫抗原的DNA疫苗也是球虫病疫苗研究的热点,其优势在于可以同时激发体液和细胞免疫应答,通过融合免疫佐剂增强抗原的免疫原性或将DNA疫苗与其他疫苗联合免疫是DNA疫苗中常用的策略。如编码巨型艾美耳球虫ROMs的DNA疫苗可以激发宿主产生较强的体液和细胞免疫应答,不仅显著提高脾脏中CD4+/CD3+和CD8+/CD3+淋巴细胞的数量,还可提高IFN-γ、IL-2 和IL-17的表达量,并减少76%的卵囊排出[63]。很多真核表达载体、球虫的免疫性抗原和免疫辅助分子的不同组合在DNA疫苗基础研究中取得了一些进展。含有非甲基化CpG基序的短ODN已被证明是哺乳动物模型中可激发先天性免疫应答和适应性免疫应答的免疫保护剂[64]。如在载体骨架中加入CpG基序可以通过Toll样受体9的配体激活DC细胞,诱导细胞毒性T细胞和分泌IFN-γ的T细胞分化,可减少42%~76%球虫卵囊排出[65]。在球虫病DNA疫苗研发中,高效的免疫佐剂表达同一抗原的异源性的Prime-Boost免疫策略以及将记忆性T细胞招募至肠道部位产生高效的记忆性免疫应答的策略[66],均是DNA疫苗在设计中需要重点考虑的。
3.4 病毒和细菌载体疫苗
基于病毒、细菌和真菌为载体表达球虫抗原的活载体疫苗研究已取得了很大进展,但均未商业化。表达柔嫩艾美耳球虫棒状体蛋白的鸡痘病毒活载体疫苗皮下免疫后只是激发宿主产生部分保护,降低39.6%~41.7%的卵囊排出[67]。表达源于柔嫩艾美耳球虫TLR激动剂的转基因腺病毒活载体疫苗激发宿主产生高效的先天性免疫应答和很强的肠道CD8+TRM细胞免疫应答[43],提示腺病毒载体可能是球虫疫苗研发中很有潜力的候选载体。鸡痘病毒载体和腺病毒载体最大的区别是后者可以在宿主肠道内复制,与球虫感染的部位相同,可以获得持续性抗原,建立更好的肠道记忆性免疫应答,疫苗激发保护性免疫应答的部位是疫苗设计中的关键因素之一。表达柔嫩艾美耳球虫5401抗原的沙门氏菌载体疫苗通过口服免疫可诱发一定水平的体液和细胞免疫应答,并减少48.4%~57.5%球虫卵囊的排出[68]。融合表达柔嫩艾美耳球虫AMA1、IMPI和MIC3的重组酿酒酵母菌疫苗口服免疫鸡群后可显著降低盲肠中球虫基因组的拷贝数[69-70]。因此,在病毒或细菌载体球虫疫苗设计中,高效递送系统的选择是首要的,高效的递送系统可在肠道中激发CD8+TRM高效保护性记忆免疫应答[71]。
3.5 球虫载体疫苗
鉴于球虫病疫苗设计中产生高效保护记忆性免疫应答部位的考虑,重组艾美耳球虫技术的发展为基于活卵囊为载体的疫苗控制肠道病原微生物提供了一个非常有价值的模型[2,72-75]。重组艾美耳球虫作为疫苗载体的研究在技术和设计策略上已取得了突破性进展[76-77],其作为疫苗载体表达并运送异源抗原的免疫保护性抗原具有多重优势:1)艾美耳球虫具有自限性感染与严格的宿主特异性,基于活卵囊为载体的疫苗将具有很高的生物安全性[78];2)艾美耳球虫是一种真核生物,基因组较大,可携带较大容量的异源抗原基因,具有通过翻译后修饰维持异源抗原天然结构和免疫原性的能力[79-81];3)抗原的递呈途径与天然抗原一致;4)经口免疫省时省力,对鸡群应激小。
在柔嫩艾美耳球虫子孢子表面表达刚地弓形虫表面抗原1(TgSAG1)可以抵抗T.gondiiRH株的感染[82]。表达巨型艾美耳球虫IMP1蛋白或AMA1蛋白的转基因柔嫩艾美耳球虫可以抵抗鸡群巨型艾美耳球虫的感染[73,83-85]。通过基因修饰可提高中低免疫原性艾美耳球虫(如毒害艾美耳球虫和柔嫩艾美耳球虫)的免疫原性及降低其致病性,为开发新型球虫疫苗提供了新思路。研究表明,由柔嫩艾美耳球虫载体表达的分子佐剂如鸡IL-2[86],融合表达鸡免疫球蛋白Fc片段和其C端锚定的糖基磷酸酯酰肌醇(Glycosyl phosphatidy linositol,GPI)[87]也增强了鸡群对野生艾美耳球虫感染的抵抗作用。以上研究表明,艾美耳球虫经基因修饰作为一种新的球虫疫苗载体具有可行性。
综上,目前很多处于研究阶段的球虫病疫苗不能诱导产生肠道高效的TRM细胞记忆性免疫应答,因而不能提供更高效的免疫保护。在疫苗设计中不仅要考虑抗原量和疫苗组分,还要考虑激发免疫应答的部位和疫苗评价时间点。因为在肠道相关淋巴样组织(Gut-associated lymphoid tissue,GALT)中只有初次遇到球虫抗原的淋巴细胞表达肠道归巢分子,才会更有利于对肠道TRM细胞记忆性免疫应答的形成[88]。因此,通过皮下或肌肉途径免疫的候选球虫疫苗不会诱导产生归巢的淋巴细胞,即使疫苗诱导产生了很强的系统性体液和细胞免疫应答,肠道对球虫的再次感染没有记忆性,是难以完全抵抗球虫感染的。优化现有球虫病疫苗的设计思路以提升宿主肠道内产生高效的记忆性免疫应答为目标的策略值得优先考虑。抑制球虫早期发育是产生保护性记忆免疫应答的重要特征,评价候选球虫病疫苗的时间点也是需要重点考虑的。
4 球虫疫苗设计策略
4.1 关注产生高效保护性记忆免疫应答的水平阈值
目前大多数疫苗需要对宿主进行多次免疫以诱导产生足够的抗体介导保护性免疫,在以细胞免疫为主的疾病动物模型中,若要激发产生保护性记忆免疫应答,需要效应性T细胞或CD8+T细胞数量的阈值[31]。如在啮齿动物疟疾中,需要达到每百万个脾细胞中约400个分泌IFN-γ的特异性CD8+T细胞的阈值水平才可阻止子孢子的感染[89]。保护性免疫应答还包含记忆性CD8+T细胞的数量和质量的阈值,保护性免疫应答水平与记忆性CD8+T细胞数量之间的关系已被确认[90-92],记忆性CD8+T细胞的质和量决定记忆性CD8+T细胞介导的免疫保护水平[92]。研究发现,若将肝脏中李斯特菌数量降低100倍需要记忆性CD8+T细胞数量达到10 000个[91];若将脉络炎脑膜病毒滴度显著降低需要记忆性CD8+T细胞数量达到85 000个[93];肝期疟原虫感染产生长期免疫需要记忆性CD8+T细胞的数量是细菌或病毒病原体感染产生长期免疫保护的100~1 000倍[90]。
在新型球虫病疫苗的设计中,由于球虫基因组的复杂性,约6 000~10 000个蛋白质编码基因,很难预测刺激高效免疫反应的真正保护性抗原[94],因此,首先要寻找球虫早期发育阶段的优质免疫抗原,然后要考虑产生高效保护性记忆免疫应答的鸡群免疫状态,均与免疫系统识别抗原的质和量紧密相关。亚单位疫苗、活载体疫苗或DNA疫苗免疫鸡群后,免疫系统仅能识别特定的1个或几个球虫抗原,抵抗球虫再次感染的能力极弱,此时鸡群处于“Naive”状态,达不到产生保护性免疫应答的阈值。鸡活卵囊疫苗免疫鸡群后,其免疫系统能够快速高效地识别球虫抗原,高效抵抗球虫的再次感染,此时鸡群处于“Primed”状态,可达到产生保护性免疫应答的阈值,具体阈值水平的数值尚需进一步研究。这2种状态对鸡群产生高效保护性记忆免疫应答水平至关重要。
4.2 关注产生高效保护性记忆免疫应答的主要部位
肠道是激发产生高效保护性记忆免疫应答的部位,肠道DC细胞的激活是肠道T细胞归巢的必要条件[88],可激发宿主产生肠道CD8+TRM细胞免疫应答。在疫苗设计中需要建立肠道DC细胞和T淋巴细胞之间的免疫突触,用抗原传输系统将抗原靶向肠道DC细胞。在建立肠道DC细胞和T淋巴细胞间的连接突触时,方法和途径也有很多,如DC细胞表面的不同受体,CCR5受体,CXC4趋化因子受体(CXCR4)或C型凝集素受体都可以与HIV囊膜蛋白gp120结合,还可以结合DC细胞内吞受体(如DEC205和Clec9A)特异性单克隆抗体[95]。一项疟疾疫苗研究表明,利用重组腺病毒将抗原肽通过DC细胞表面受体Clec9A的单克隆抗体靶向肝脏中的疟疾特异性TRM,通过这种策略将在脾脏中的抗原肽迁移至肝脏中形成抗原肽特异性的TRM[96]。这种策略在其他疾病疫苗研发中应用较多。在新型球虫疫苗的研发中,用抗原传递系统如病毒、细菌、球虫活载体或抗体介导[97]、纳米颗粒释放[98]和将抗原靶向DC细胞为开发球虫新疫苗提供了巨大潜力。在疫苗设计中有3个关键点:一是抗原肽的选择;二是如何将抗原肽引入肠道DC细胞,被识别并进行处理;三是被DC细胞识别并处理过的抗原肽能否刺激产生特异性的T细胞免疫应答。交互抗原肽的选择和抗原肽与DC细胞之间的交互方式是最关键的,这就需要进一步探究球虫在感染过程中抗原被DC细胞递呈途径,DC细胞又如何将抗原递呈给肠道T细胞的,只有解析清楚这些途径,才能为球虫疫苗研发提供新的思路。
球虫激发宿主产生保护性免疫应答的机制是高效球虫病疫苗设计和研发的理论依据,新型球虫病疫苗应能在肠道激发质优量足的对早期感染有记忆性的保护性免疫应答,这样才可以在球虫感染早期阻断子孢子以及第一代裂殖生殖的发育,进而阻断第二代和/或第三代大量裂殖生殖的完成,阻止后期裂殖生殖对肠道的严重破坏,实现基于免疫学理论的球虫病的科学防控。
5 球虫病疫苗评价标准
评估球虫病疫苗或药物效果的指标众多,包括死亡率、体重损失、饲料转化率、病变积分、红细胞压积、血清或血浆类胡萝卜素和卵囊生成等。最常见的指标是前四项,其他指标不同研究者取舍不同[29,99-102]。研制中的球虫病疫苗有活卵囊疫苗、亚单位疫苗、DNA疫苗和载体疫苗四大类,评价标准一般设计为免疫一周或两周后的体液免疫、细胞免疫和黏膜免疫水平,以及免疫攻虫的卵囊排出量。依据球虫产生高效保护性记忆免疫应答的机制,本研究提出评价体系应最终以抵抗球虫早期感染阶段的免疫保护力为主来评价。免疫后的攻虫剂量视疫苗类型不同而不同,如产生较弱免疫水平的重组蛋白疫苗可降低攻虫剂量。
在球虫感染宿主后产生保护性免疫应答的多种效应机制中,对第一代裂殖生殖的抑制是记忆性免疫应答抵抗球虫感染最重要的特征。本研究提出球虫感染后子孢子发育成第一代裂殖体的数量应作为有效记忆性免疫应答的指标,其评估具体时间可以根据鸡球虫种类的不同而定。如针对柔嫩艾美耳球虫感染的疫苗,可以以球虫感染后第3天第一代裂殖体的数量作为评价未来艾美耳球虫疫苗的标准。从长远来看,新型球虫病疫苗需要生产更简单,但必需要达到与活卵囊疫苗相当的免疫效力。这种疫苗评价标准的优势在于大大节省饲养成本和空间,也很大程度上减少了攻虫后野毒虫株产生的卵囊对设施的污染。
6 结 论
新型球虫病疫苗的突破将取决于3个方面:1)保护性记忆免疫应答水平的阈值;2)高效保护性记忆免疫应答的部位,不仅选择可激发肠道免疫系统的球虫早期抗原,还要考虑诱导肠道保护性记忆免疫应答的可能途径;3)评价球虫免疫效果的时间点以是否在球虫感染早期抑制子孢子发育为第一代裂殖体为主。