血红素加氧酶1基因在小鼠肾足细胞中的表达及抗炎作用*
2023-05-10唐明秋赵宝清
唐明秋,宋 熠,倪 萍,赵宝清
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北科技学院糖尿病心脑血管病变湖北省重点实验室;3.湖北科技学院医学部医药研究院;4.湖北科技学院医学部临床医学院)
血红素加氧酶1(heme oxygenase 1,HO-1)是机体血红素代谢过程中重要的限速酶之一,是一种抗氧化酶和细胞保护酶,共有288个氨基酸。在全身组织内广泛分布,肾脏、心脏、肝脏中表达较多[1]。血红素在HO-1的作用下,由NADPH提供氢质子,消耗O2形成开链四吡咯并且释放出Fe2+,同时形成代谢产物胆绿素(biliverdin,BV)和CO,胆绿素被胆绿素还原酶还原成胆红素。HO-1的抗氧化功能部分与其阻止游离血红素参与氧化反应有关[2-3]。
CO是一种重要的气体信使分子,参与氧化应激、缺血再灌注损伤等病理过程,发挥舒张血管、抗氧化损伤等重要作用[4-6]。糖尿病肾病(diabetic nephropathy,DN)是糖尿病的临床常见并发症之一,终末期糖尿病累及的肾脏病变逐渐成为慢性肾功能衰竭主要病因之一[7]。研究发现[8-9],DN是由多种炎症因子介导的代谢性疾病,高糖、脂代谢紊乱、氧化应激、炎症反应等多种因素贯穿DN的整个过程。构建HO-1真核双表达载体并转染MPC5细胞,检测HO-1表达效果及对相关炎性因子的影响,为继续探索HO-1在脂代谢紊乱条件下保护细胞的机制奠定实验基础,同时也为糖尿病肾脏损伤的基因治疗提供新思路。
1 材料与方法
1.1 主要试剂
人胚胎肾细胞HEK293t、小鼠肾足细胞MPC5(北纳创联生物科技有限公司);pCDNA3.1-t2a:egfp载体、引物和测序(擎科生物科技有限公司)完成;大肠杆菌菌株E.Coli BL21(DE3)为本实验室保存;限制性内切酶、DNA聚合酶、dNTPs、T4 DNA Ligase、6×DNA Loading、DNA Marker等PCR相关试剂(Fermentas公司);2×Es Taq Master Mix、质粒提取和DNA纯化试剂盒(康为世纪生物有限公司);胎牛血清、1640培养基、胰蛋白酶(Gibco公司);细胞培养相关耗材(Corning公司);RIPA细胞裂解液(碧云天生物技术有限公司);总RNA提取、总蛋白提取和定量、反转录及实时定量PCR试剂盒、ECL 蛋白检测试剂盒(Servicebio公司);DNA超滤管、PVDF膜(Millipore公司);兔抗小鼠HO-1抗体、兔抗小鼠IL-1β抗体、兔抗小鼠IL-18抗体、兔抗小鼠β肌动蛋白(β-actin)抗体和HRP标记的山羊抗兔IgG(ABclonal公司)。
1.2 细胞培养
HEK 293t细胞置于10%胎牛血清的DMEM培养基培养中生长,MPC5细胞置于10%胎牛血清的1640培养基培养中生长,均在37℃、5%CO2培养箱中进行培养和传代。
1.3 目的片段扩增
Trizol试剂提取总RNA,按说明书操作。每份样品中取1μg RNA进行反转录合成cDNA,然后取1μL cDNA进行PCR扩增。扩增引物如下。
HO-1-Forward:GTAAAGCTTGCCACCATGATGGAAAGACCACAGCCAGAC,
HO-1-Reverse:GCGGATATCCATAGCATAGA-GCCCCACTGC。
PCR反应的扩增程序:预变性94℃、300s,94℃、30s,64℃、30s,72℃、30s,循环5次;94℃、30s,62℃、30s,72℃、30s,循环5次;以此类推,退火温度每次降低2℃,每个温度进行2次循环,直到退火温度降低至52℃;72℃延伸300s。
1.4 真核表达载体的构建
用限制性内切酶Hind Ⅲ和EcoR V将目的片段和载体进行混合酶切,37℃消化1h后置于80℃灭活10min,然后用超滤管进行目的片段和载体的回收。酶切体系为:1200ng/μL目的片段23μL,100ng/μL载体1μL,10×Buffer 5μL,5U/μL Hind Ⅲ 1μL,5U/μL EcoR V 1μL。
限流超滤管法(single-tube restriction based ultrafiltration,STRU-Cloning):取干净无污染的超滤管,加入500L的TE Buffer洗脱液进行平衡,室温离心6min,转速为5000r/min。经过灭活处理的样品加入TE Buffer洗脱液至500L,移至于超滤管中进行纯化处理,相同的条件下离心1次。然后加入无菌水至500L离心,重复3次,待管内液体剩余20~30L,取出5L跑琼脂糖凝胶电泳检测,当目的片段和载体都可以观察到明显的条带时,说明回收成功。检测完成后,将混合酶切回收产物置于16℃连接1h。连接体系为:混合回收产物7L,T4 Buffer 1L,T4 ligase 1L,PEG4000 1L。
将连接产物转化到BL21感受态细胞后,冰水浴30min,在42℃的恒温水浴锅中热激90s,在37℃、转速150r/min的摇床中孵育45min之后进行涂板,置于37℃的恒温隔水式培养箱中过夜培养。
1.5 载体的验证
挑取单菌落进行菌液PCR验证。将阳性克隆体摇菌后进行无内毒素质粒抽提,用Hind Ⅲ和EcoR V对质粒进行双酶切验证。酶切体系为:质粒2μL,ddwater 8.7μL,10×Buffer 1μL,5U/μL Hind Ⅲ 0.15μL,5U/μL EcoR V 0.15μL。电泳结果正确后送去公司测序。菌液PCR引物:HO-1-Forward:ATGGAAAGACCACAGCCAGAC,HO-1-Reverse:CATAGCATAGAGCCCCACTGC。
1.6 MPC5中表达鉴定
当细胞覆盖率达到70%进行转染实验,将质粒和Lipofectamine®2000以1∶3的比例在Opti-MEM中静置15min,然后将混合物均匀加入培养皿中。6h后换液,36h后达到表达高峰期。将细胞置于荧光显微镜下观察eGFP表达情况;Western blot检测HO-1表达情况以及在棕榈酸(palmitic acid,PA)模拟高脂条件下对炎性因子表达影响,高脂浓度为0.02mmol/L。
2 结 果
2.1 目的片段的扩增及混合酶切
以HEK293t细胞为mRNA来源扩增目的片段,将PCR产物进行1%琼脂糖凝胶电泳回收。结果如图1,目的片段大小为861bp,条带明亮清晰,回收后进行下一步实验。
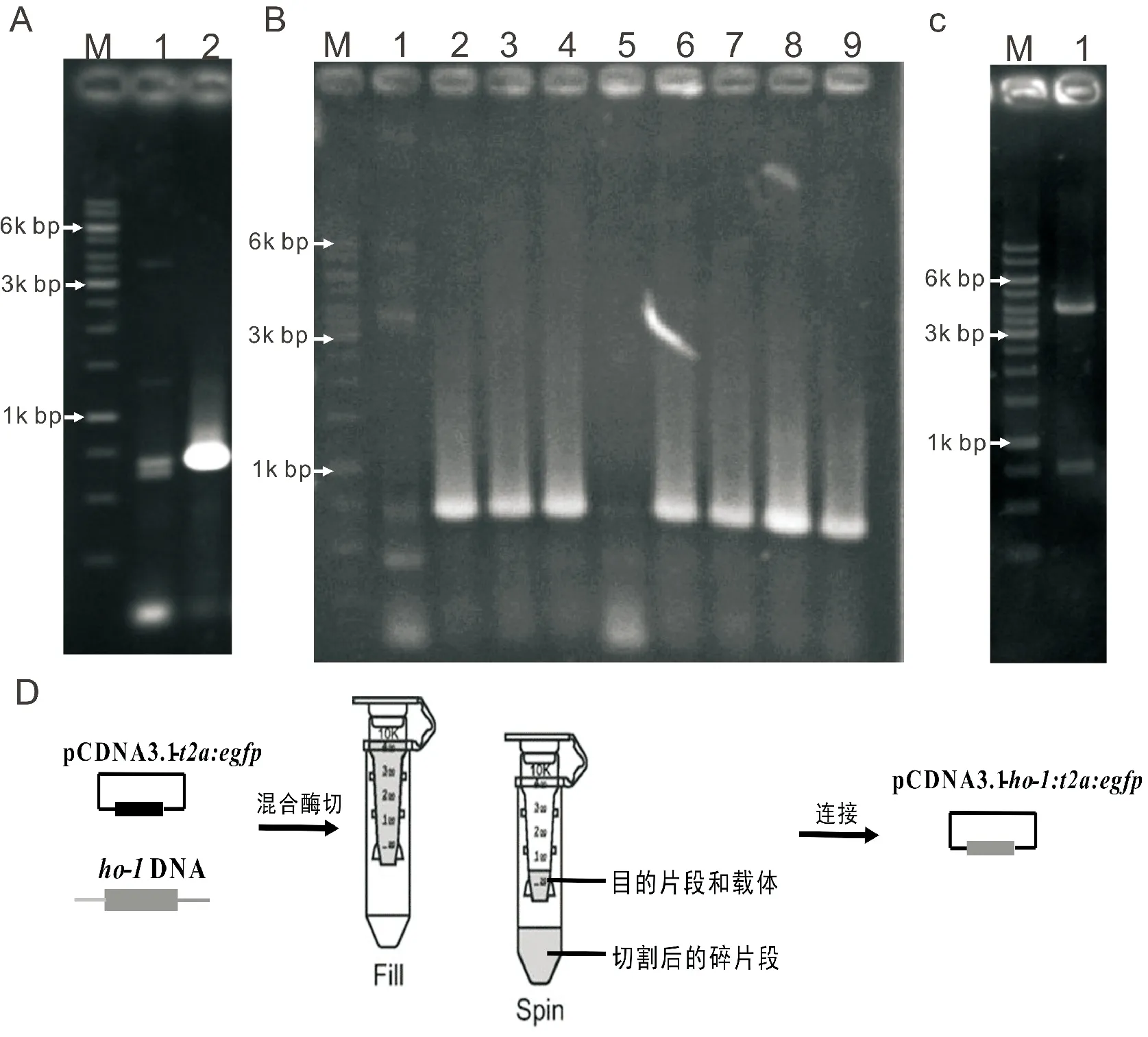
A.HO-1基因扩增产物电泳结果,泳道1为空载;B.菌液PCR电泳结果,泳道1为空载;C.质粒双酶切电泳结果,M均为DNA Marker;D.限流超滤管法回收酶切产物示意图图1 凝胶电泳结果
以内切酶Hind Ⅲ和EcoR V对载体进行混合酶切,用10kDa超滤管进行回收。该超滤管可以截留分子量大于10kDa的片段,故离心后管内液体中只剩余载体大片段和目的片段,达到分离纯化DNA片段的目的,且方便省时。回收产物进行连接后,转入BL21感受态细胞中过夜生长,挑选单菌落进行检测。
2.2 载体检测
将单菌落挑至LB培养基中,摇菌4h后进行菌液PCR检测。取阳性样品接种于50mL培养基中进行摇菌,抽提无内毒素质粒进行双酶切验证。如图1所示,酶切结果正确后取质粒15μL测序验证,其余备用。
2.3 荧光鉴定质粒转染
T2A是一种来自Thosea asigna virus可以自行剪切的短肽(EGRGSLLTCGDVEENPGP),通过核糖体跳过短肽C端的甘氨酸和脯氨酸的肽键合成,使短肽和下游产物分离,可以在真核生物细胞的同一条mRNA上分别表达多种目的蛋白(如图2D)。故pCDNA3.1-ho-1:t2a:egfp是一个双表达载体,可以在小鼠肾足细胞中分别表达HO-1和eGFP蛋白。通过荧光显微镜观测细胞内eGFP的表达情况,对质粒的转染效果进行验证,同时也不会影响HO-1基因表达以及蛋白正常生物功能。如图2所示,荧光照片表明构建的双表达质粒可以用于MPC5细胞的转染以及后续过表达实验。
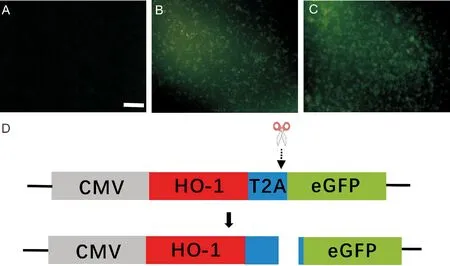
A.空白对照组;B.转染pCDNA3.1-t2a:egfp组;C.转染pCDNA3.1-ho-1:t2a:egfp组;D.T2A剪切双表达示意图(标尺:50μm)图2 荧光显微镜检测HO-1基因过表达情况
2.4 Western blot检测HO-1过表达及抗炎作用
Western blot结果显示见图3,HO-1蛋白条带清晰,分子量为33kDa。并且在PA造模条件下,HO-1过表达可以降低炎性因子IL-18、IL-1β的表达,减少脂代谢紊乱模型中的细胞损伤。揭示HO-1可能作为治疗糖尿病肾脏损伤的重要靶点之一。
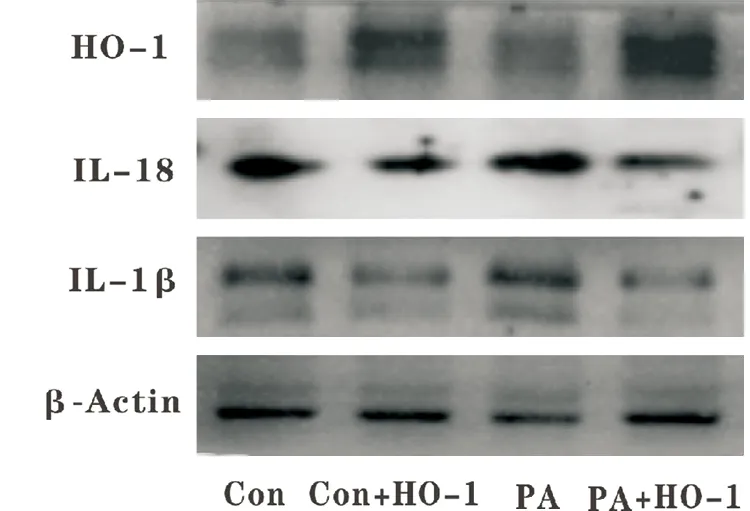
+HO-1:转染pCDNA3.1-ho-1:t2a:egfp图3 Western blot检测HO-1基因过表达情况以及在PA条件下对炎性因子表达的影响
3 讨 论
HO-1是血红素代谢过程中的重要限速酶,能将血红素催化为胆绿素、CO和Fe2+[10]。胆绿素及其代谢产物胆红素具有重要的抗氧化应激、抗炎功能,可以有效清除过氧化物、内毒素和过氧亚硝酸盐等带来的细胞损伤[11-12]。CO是体内重要的气体信使[13],越来越多的研究表明内源性CO在抗炎、抗凋亡以及微循环中发挥重要作用[14]。
研究表明[14],DN是一种慢性炎症性疾病,由大量细胞因子及多种炎症性因子所导致。在DN的组织病变过程中,IL-1β由足细胞产生,对足细胞的损伤和修复产生作用,IL-18作为前体炎性因子在DN的进程中表达增多,激活了单核巨噬细胞,从而刺激炎症性因子的表达和释放,增强炎症反应进而加重DN的损伤[15]。
本研究通过双酶切、超滤管回收等方法构建HO-1真核双表达载体,不仅节省减少了实验步骤,也提高了连接效率。通过荧光拍照和Western blot检测了质粒的转染效率以及表达效果,同时也表明当HO-1过表达时,细胞在高脂条件下的炎性因子表达降低。
综上所述,本研究构建了pCDNA3.1-ho-1:t2a:egfp双表达载体,为研究HO-1生物保护功能奠定了基础,同时也为糖尿病及相关疾病的诊断和治疗提供了新思路。
