没食子酸经线粒体途径对癌细胞的诱导凋亡作用研究*
2023-05-10韦华琴解晓敏孙燕玲马梦君
韦华琴,李 燕,解晓敏,梁 潇,武 阳,杨 旭,孙燕玲,马 萍**,马梦君
(1.湖北科技学院医学部药学院,湖北 咸宁 437100;2.湖北科技学院医学部基础医学院咸宁市健康环境工程技术研究中心;3.湖北省智慧康养产业技术研究院;4.咸宁市农业科学院)
近几年,在茶叶成分的生化研究中,没食子酸(gallic acid,GA)作为黑茶中的特征性酚类物质受到关注[1]。有研究表明,湖北青砖茶中GA的含量较高,且随着储藏时间的延长,GA的含量逐年增高[2]。作为一种有机酸类化合物,GA很容易被吸收,特别是对人体的重要脏器有较强的亲和力,同时有非常广的作用范围,其药理作用多样,主要用于抗肿瘤、抗溃疡、抗过敏和抗病毒等[3-4]。
线粒体是细胞的能量工厂,也是生产车间。线粒体功能的正常是细胞进行有序代谢活动的基础,也是机体进行正常生命活动的前提。You等[5]发现GA可以显著增加人宫颈癌HeLa细胞内的活性氧(reactive oxygen species,ROS)水平,抑制细胞的增殖;吴昊等[6]实验也表明,GA可通过提高ROS水平并上调促凋亡蛋白caspase-3、caspase-9、Bax的表达等方式促使细胞凋亡。本研究经MTT、CCK-8实验检测GA对肝癌HepG2细胞、胃癌SGC7901细胞、结肠癌EC109细胞生长情况、ROS水平以及HepG2细胞膜电位的变化、HepG2细胞凋亡水平的影响,探讨GA对癌细胞的作用及机制,为青砖茶的保健作用提供理论依据。
1 材料与方法
1.1 实验仪器与试剂
主要仪器:酶标仪(elx800,美国bio-TEK);多功能荧光酶标仪(Hide Chameleon V,芬兰Hidex);显微镜(dp73,日本奥林巴斯)。
主要试剂:DMEM、1640、FBS、胰酶、双抗(美国GIBCO);GA、CCK-8(上海源叶生物科技有限公司);N-乙酰半胱氨酸(NAC)、线粒体膜电位与细胞凋亡检测试剂盒、Hoechst 33258(碧云天生物科技有限公司);噻唑蓝(MTT)(南京建成生物工程研究所);ROS试剂盒(碧云天生物技术有限公司,S0033);其余试剂均为实验室常用分析纯。
1.2 细胞培养及处理
肝癌细胞HepG2、胃癌细胞SGC7901、结肠癌细胞EC109购自武汉大学中国典型培养保存中心(武汉CCTCC)。立刻放入37℃水浴锅解冻,直至细胞冻存液完全溶解,转移到离心管内,加入约1mL培养液,用吸管轻轻吹打混匀,在1000r/min离心2min,弃上清,再加入适量培养液,轻轻吹打混匀,转移到培养瓶中,置于37℃、5% CO2的培养箱。24h后观察细胞贴壁情况,待细胞长到80%~90%后传代,吸除或倒掉细胞瓶内旧培养液,加少量PBS润洗细胞,加入1mL胰酶37℃孵育2min,然后加入2mL完全培养基终止消化,用吸管小心吹打贴壁的细胞,制成细胞悬液。在1000r/min离心2min,弃去上清,用3mL完全培养液重悬细胞,按照1∶3的比例传代,放入37℃含有5% CO2的潮湿培养箱内培养。
1.3 药物配置
(1)2mg/mL GA母液:称取20mg GA(纯度>98%),加入10mL无水乙醇溶解,滤过器(0.22μm)过滤除菌,分装4℃保存。后续实验将母液以完全培养基稀释成所需浓度。
(2)500mmol/L抗氧化剂NAC(N-乙酰半胱氨酸)原液配制:用24mL PBS稀释2g NAC,充分溶解后用滤过器(0.22μm)过滤作为原液,分装-20℃冻存备用。
1.4 检测方法
1.4.1 MTT法检测
取生长良好的3种癌细胞用含10%FBS的培养液配成单个细胞悬液,计数并分组,每组6个复孔,每孔2×104个细胞,200μL培基,接种到96孔板,在5% CO2、37℃的潮湿培养箱中培养24h后给药,再继续培养24h后,吸弃培养基,每孔加入200μL含10%MTT溶液(PBS配终浓度5mg/mL)培养基,继续孵育4h。吸弃孔内培养上清,每孔加入200μL DMSO振荡10min后检测。
1.4.2 CCK-8法检测
取生长良好的3种癌细胞用含10%FBS的培养液配成单个细胞悬液,计数并分组,每组6个复孔,每孔2×104个细胞,200μL培基,接种到96孔板,在5% CO2、37℃的潮湿培养箱中培养24h后给药,继续培养24h后,弃掉培养基,每孔加200μL含10%CCK-8溶液的培养基,继续孵育3h后在450nm检测。
1.4.3 ROS测定
取生长状态良好的3种癌细胞,用含10%FBS的培养液配成单个细胞悬液,计数并分组,每组6个复孔,每孔4×104个细胞,200μL培养基接种到96孔板,在5% CO2、37℃的潮湿培养箱中培养24h后处理。用含10%FBS培养液按照1∶1000稀释DCFH-DA,使终浓度为10μmol/L。弃掉培养液,每孔加入200μL稀释好的DCFH-DA。阳性对照组按照1∶1000的比例使用。先装载探针,再每孔加入1μL的阳性对照刺激。使用488nm激发波长,525nm发射波长,在荧光酶标仪上测定0.5、1、1.5、2、3、4、6、8、12、24h时各孔光吸收值。
1.4.4 Hoechst 33258荧光染色法
取洁净盖玻片置于六孔板内,取生长状态良好的HepG2细胞,用含10%FBS的培养液配成细胞悬液,计数并分组,每孔3×105个细胞,2mL培基,接种到6孔板中,在5% CO2、37℃的潮湿培养箱中培养24h后给药。刺激细胞发生凋亡6h后,吸去培养液,每孔加入0.5mL固定液,固定10min后用PBS洗两遍,每次3min,加入0.5mL Hoechst 33258染色液,染色5min后再用PBS洗两遍,每次3min,用抗荧光淬灭封片液封片。
1.4.5 线粒体膜电位与细胞凋亡检测
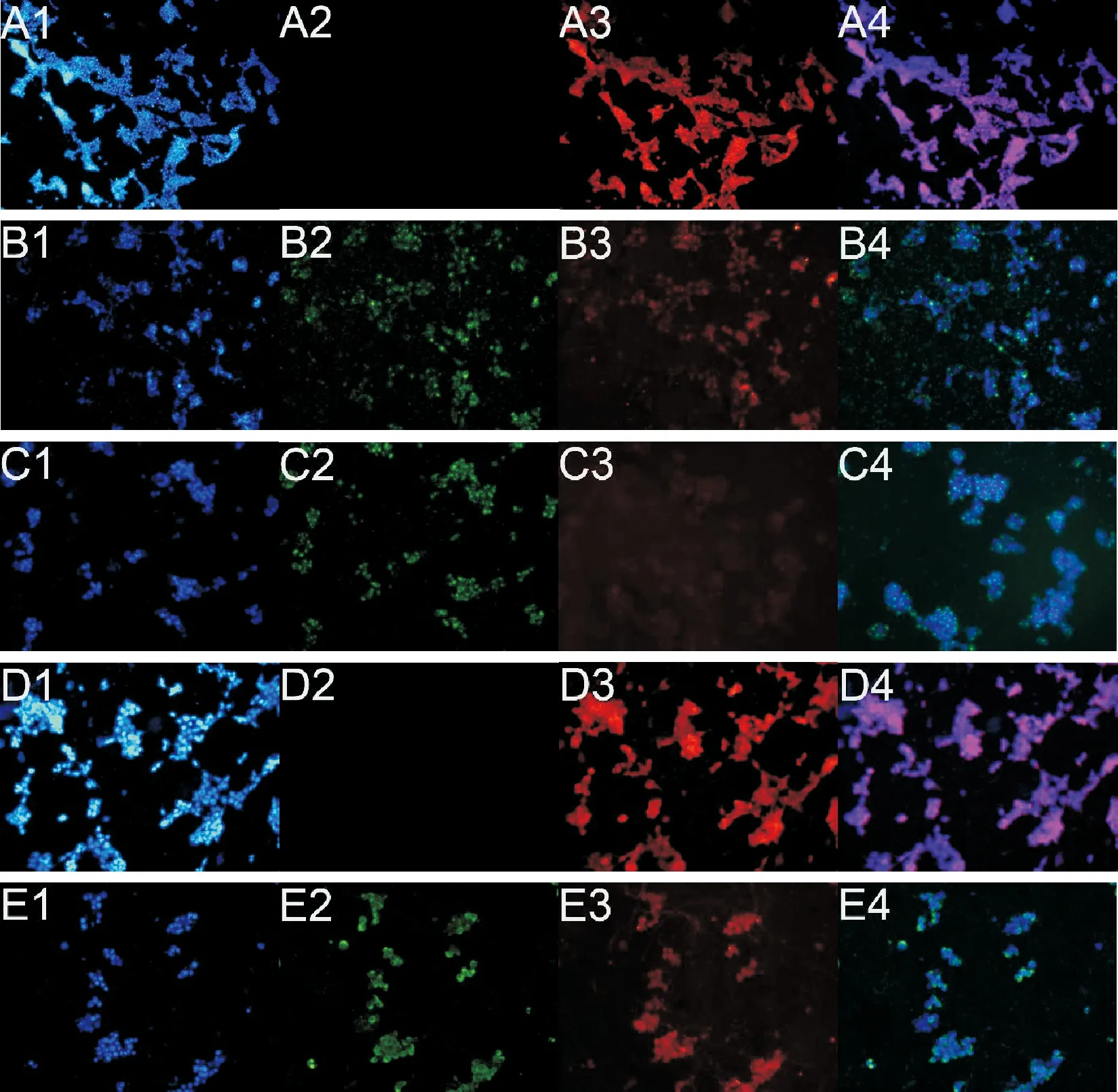
取洁净盖玻片置于六孔板内,取生长状态良好的HepG2细胞用含10%FBS的培养液配成细胞悬液,计数并分组,每孔3×105个细胞,2mL培基,接种到6孔板,在5% CO2、37℃的潮湿培养箱中培养24h后给药。药物刺激细胞12h后,弃去培养液,用PBS洗涤一次,加入188μL Annexin V-FITC结合液。加入5μL Annexin V-FITC,轻轻混匀。加入2μL Mito-Tracker Red CMXRos染色液和5μL Hoechst 33342染色液,轻轻混匀。室温避光孵育20~30min,随后置于冰浴中。随即在荧光显微镜下观察,Mito-Tracker Red CMXRos为红色荧光,Annexin V-FITC为绿色荧光,Hoechst 33342为蓝色荧光。
1.5 统计学方法
利用Graphpad prism 9.0软件建立实验数据统计图。经方差分析(Analysis of Variance)和LSDt检验,P<0.05表示差异有统计学意义。采用SPSS 18.0统计软件进行数据分析。
2 结 果
2.1 GA对HepG2、SGC7901和EC109细胞增殖的影响
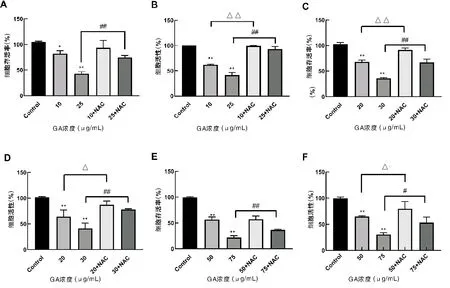
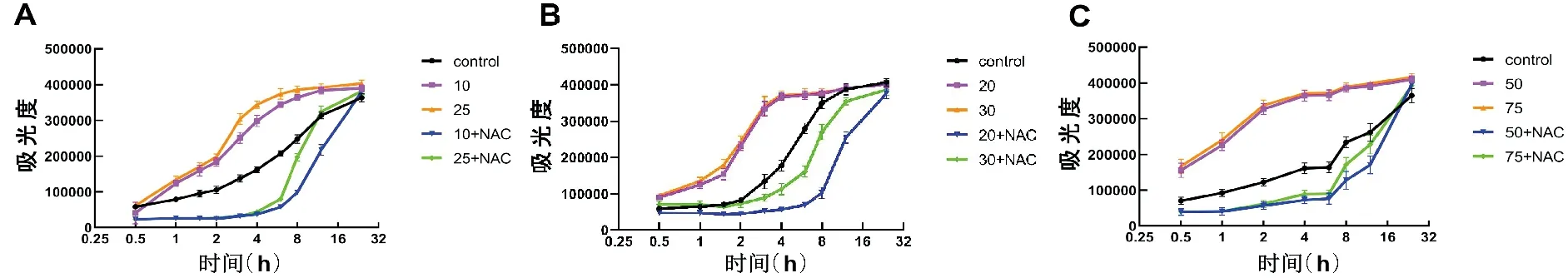
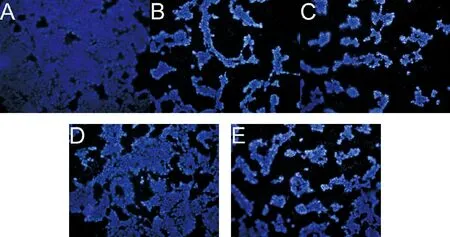
如图1A-B可以看出,当GA浓度≥10μg/mL时,对HepG2细胞的存活率和活性具有明显的抑制作用,且随着GA浓度的升高,抑制作用增强;除在2μg/mL浓度下与Control组相比没有显著性差异外,其他浓度作用下,GA对HepG2细胞抑制作用显著增强(P<0.01)。GA对HepG2细胞50%抑制浓度为:10μg/mL A,C,E:HepG2细胞、SGC7901细胞、EC109细胞MTT检测结果;B,D,F:HepG2细胞、SGC7901细胞、EC109细胞CCK-8检测结果(与对照组比较,*P<0.05,**P<0.01)图1 GA对HepG2细胞、SGC790细胞、EC109细胞增殖的影响 如图1C-D所示,当GA浓度≥10μg/mL时,对SGC790细胞的存活率和活性具有明显的抑制作用,且随着GA浓度的升高,抑制作用增强;除在5μg/mL浓度下与Control组相比没有显著性差异外,其他浓度作用下,GA对SGC790细胞抑制作用显著增强(P<0.01)。GA对SGC7901细胞50%抑制浓度为:20μg/mL 如图1E-F所示,GA对EC109细胞的存活率和活性具有显著的抑制作用,且随着GA浓度的升高,抑制作用增强(P<0.01)。MTT结果显示,GA对EC109细胞50%抑制浓度为:50μg/mL 结果清楚地表明,随着浓度的增加,GA对肝癌HepG2、胃癌SGC7901、结肠癌EC109三种细胞增殖的抑制作用都逐渐增强,并且具有剂量依赖性(P<0.01)。 N-乙酰半胱氨酸(N-acetylcysteine,NAC)是氨基酸左旋半胱氨酸的代谢物,目前作为抗氧化剂的生物保护剂被广泛研究[7]。 如图2A-B所示,与Control组相比,10μg/mL GA组与25μg/mL GA组明显抑制HepG2细胞的增殖。MTT结果显示,25μg/mL GA+NAC组与25μg/mL GA组相比,细胞存活率显著增高(P<0.01),10μg/mL GA+NAC组与10μg/mL GA组相比,细胞存活率也有所增高,但没有显著性差异。CCK-8结果显示,与10μg/mL GA组和25μg/mL GA组相比,10μg/mL GA+NAC组与25μg/mL GA+NAC组细胞活性显著增高(P<0.01)。 A,C,E:HepG2细胞、SGC7901细胞、EC109细胞MTT检测结果,B,D,F:HepG2细胞、SGC7901细胞、EC109细胞CCK-8检测结果(与Control组相比,*P<0.05,**P<0.01;与低浓度GA组相比,△P<0.05,△△P<0.01;与高浓度GA组相比,#P<0.05,##P<0.01)图2 HepG2细胞、SGC7901细胞、EC109细胞生存率的变化 如图2C-D所示,与Control组相比,20μg/mL GA组与30μg/mL GA组明显抑制SGC7901细胞的增殖。MTT结果显示,与20μg/mL GA组和30μg/mL GA组相比,20μg/mL GA+NAC组与30μg/mL GA+NAC组细胞存活率显著增多(P<0.01)。CCK-8结果显示,与20μg/mL GA组和30μg/mL GA组相比,20μg/mL GA+NAC组与30μg/mL GA+NAC组细胞活性显著增高(P<0.05,P<0.01)。 如图2E-F所示,与Control组相比,50μg/mL GA组与75μg/mL GA组EC109细胞活性与细胞存活率显著降低(P<0.01)。MTT结果显示,与50μg/mL GA组和75μg/mL GA组相比,50μg/mL GA+NAC组与75μg/mL GA+NAC组细胞存活率显著提高(P<0.01)。CCK-8结果显示,与50μg/mL GA组和75μg/mL GA组相比,50μg/mL GA+NAC组与75μg/mL GA+NAC组细胞活性显著增高(P<0.05)。 如图3所示,三种癌细胞内的ROS水平检测结果一致,与Control组相比,在加入不同浓度GA 0.5~16h后三种癌细胞的ROS水平均明显升高;与单纯GA组相比,在相同浓度的GA+NAC组三种细胞内ROS水平均显著降低。检测结果表明,与Control组相比,不同浓度的GA均能提高肝癌HepG2、胃癌SGC7901、结肠癌EC109三种细胞中ROS水平,而NAC可以阻断这种促进作用。 A:HepG2细胞;B:SGC7901细胞;C:EC109细胞图3 细胞内ROS水平的变化情况 Hoechst 33258为非嵌入性荧光染料,它们在活细胞中与DNA结合,是针对细胞核进行染色的染料,可以反映细胞的凋亡情况。在荧光显微镜紫外光激发时,Hoechst-DNA发出亮蓝色荧光,常用于细胞凋亡检测。HepG2细胞的荧光染色结果如图4所示,与Control组相比,10μg/mL GA组和25μg/mL GA组HepG2细胞凋亡明显增多,25μg/mL GA组比10μg/mL GA组HepG2细胞凋亡明显增多,说明GA诱导HepG2细胞凋亡且具有浓度依赖性。与GA组相比,10μg/mL GA+NAC组与25μg/mL GA+NAC组的细胞凋亡情况有所改善。 A:Control组;B:10μg/mL GA组;C:25μg/mL GA组;D:10μg/mL GA+NAC组;E:25μg/mL GA+NAC组图4 HepG2细胞Hoechst 33258荧光染色 荧光染色的蓝色荧光为Hoechst 33342对活细胞细胞核的染色,绿色荧光标记的是发生了凋亡或坏死的细胞,红色荧光标记的是保持线粒体膜电位的活细胞。如图5所示,与Control组相比,10μg/mL GA组和25μg/mL GA组蓝色荧光明显减弱,而绿色荧光增强,说明活细胞减少而凋亡细胞增多,红色荧光也明显减弱,说明线粒体膜电位有所降低。而与10μg/mL GA组和25μg/mL GA组相比,10μg/mL GA+NAC组和25μg/mL GA+NAC组蓝色和红色荧光有所增强,绿色荧光减弱,说明GA+NAC组细胞凋亡减少,线粒体膜电位有所恢复。 A:Control组;B:10μg/mL GA组;C:25μg/mL GA组;D:10μg/mL GA+NAC组;E:25μg/mL GA+NAC组;1:Hoechest 33342;2:Annexin V-FITC;3:Mito-Tracker Red CMXRos;4:Merge图5 HepG2细胞的线粒体膜电位及细胞凋亡情况 随着老龄化进程的加速和环境污染因素的加重,未来恶性肿瘤的发病率可能会更加严重。在癌症的临床治疗中,大多数患者不能耐受化疗带来的严重不良反应,且许多患者在长期使用化疗药物后出现耐药性和复发转移。因此,探索新的治疗药物和作用机制是治疗癌症的关键。 细胞凋亡是生物体内细胞在特定的内源和外源信号诱导,并在有关基因的调控下发生的程序性死亡过程,它对生物体的正常发育、自稳态的平衡以及各种病理过程有重要意义[8]。诱导肿瘤细胞的凋亡,在癌症的预防和治疗中可能发挥着重要的作用[9]。关于细胞凋亡与肿瘤的发生、发展的报道很多,GA也因其诱导肿瘤细胞凋亡的作用受到众多学者青睐,包括非小细胞肺癌细胞[10]、人宫颈癌HeLa细胞[11]、黑素瘤A375细胞[12]、膀胱癌T24细胞[13]等。但对于不同的肿瘤类型,GA及其衍生物诱导细胞凋亡的途径又不尽相同。在非小细胞肺癌中,GA通过抑制EGFR的活化和损伤CARM1与PELP1的结合[14];在人卵巢癌细胞中,通过诱导癌细胞S期、G2期阻滞[15];在结肠癌细胞中,通过干扰JAK-STAT信号通路的运转[16];在黑色素瘤B16-F10细胞中,通过诱导活性氧的产生,对细胞周期进行阻滞[17]。据报道,GA具有促氧化[18]特性,越来越多的证据表明,GA诱导的细胞凋亡与源自ROS的氧化应激有关,很多GA酯(甲基、丙基和十四烷基GA酯)可诱导ROS增加[19-21],GA通过自氧化产生O2-、OH-和H2O2等ROS,诱导氧化应激、产生细胞毒性,使线粒体膜电位降低,进而使细胞氧化磷酸化发生障碍,进一步造成体内ROS生成,从而引起组织细胞氧化应激,这是引起细胞凋亡等细胞死亡的关键因素[24-25]。以上研究表明细胞内ROS的水平与细胞凋亡程度密切相关,有学者认为细胞凋亡过程必然伴随线粒体跨膜电位的下降和ROS水平的级联性升高。有研究发现用GA处理肺癌细胞后,细胞内ROS水平显著增高并伴随线粒体膜电位消失,引起促凋亡蛋白和抗凋亡蛋白表达失衡,从而导致细胞凋亡显著增高[25]。 本实验也发现GA能够引起肝癌HepG2、胃癌SGC7901及结肠癌EC109细胞内的ROS水平升高,线粒体膜电位降低,细胞凋亡增多,加入抗氧化剂NAC后伴随着ROS的产生被抑制,线粒体膜电位也有所恢复,细胞凋亡水平降低。这些结果表明GA作为促氧化剂可以影响细胞中ROS水平,但其在GA诱导细胞死亡中的确切作用需要进一步研究。总之,GA抑制肝癌HepG2、胃癌SGC7901及结肠癌EC109细胞的生长。GA诱导的细胞通过凋亡而死亡,伴随着ROS增加和线粒体膜电位降低。这正好说明了GA可以通过激活内源性凋亡途径来诱导癌细胞的凋亡,这些开创性研究结果为青砖茶的保健作用提供了深厚的理论基础。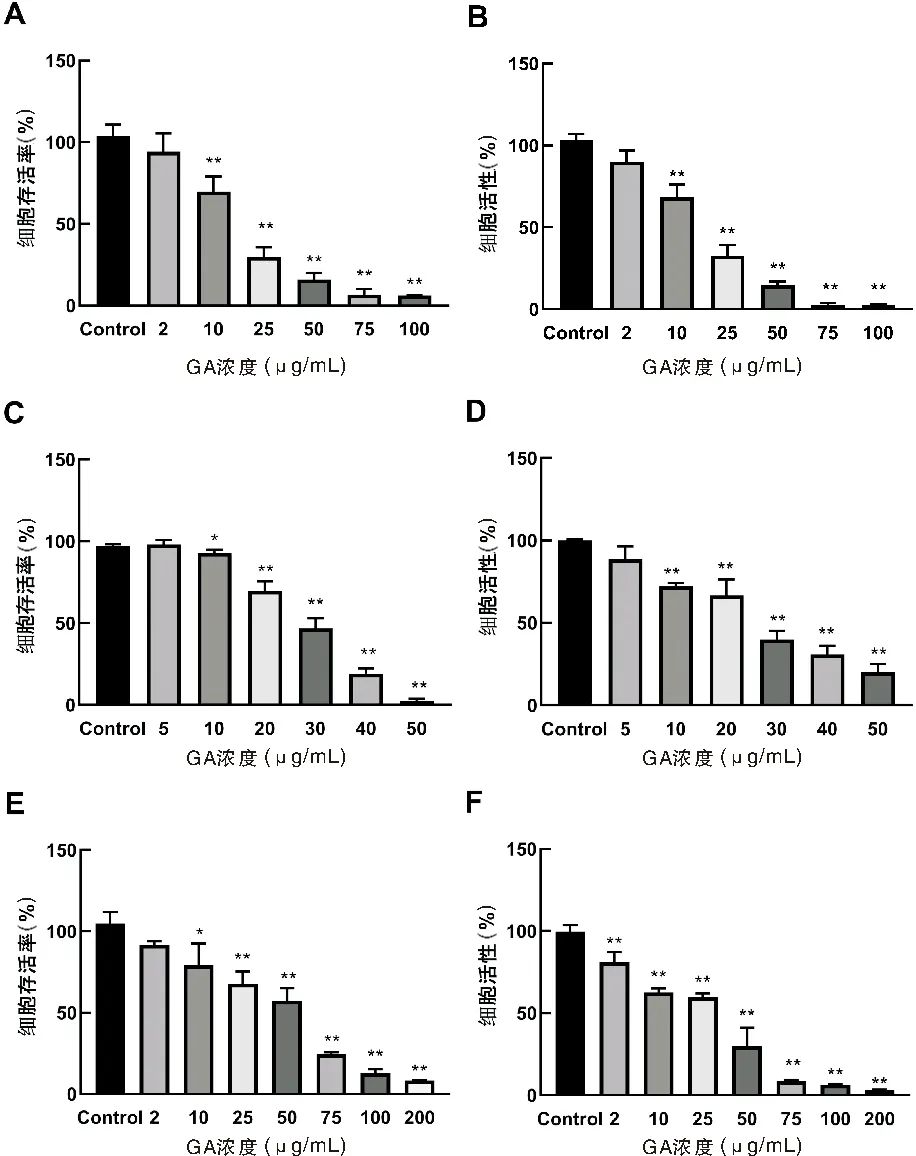
2.2 在NAC作用下,GA对HepG2、SGC7901和EC109细胞增殖的影响
2.3 细胞内的ROS水平
2.4 HepG2细胞的荧光染色
2.5 HepG2细胞线粒体膜电位、细胞凋亡
3 讨 论
